Trắc nghiệm Tổng hợp bài tập muối aluminat tác dụng với axit - Hóa 12Đề bài
Câu 1 :
Cho p mol Na[Al(OH)4] tác dụng với dung dịch chứa q mol HCl. Để thu được kết tủa thì cần có tỉ lệ
Câu 2 :
Hòa tan hỗn hợp gồm 0,27 gam bột Al và 2,04 gam bột Al2O3 trong dung dịch NaOH dư thu được dung dịch X. Cho CO2 dư tác dụng với dung dịch X thu được kết tủa X1, nung X1 ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn X2. Biết H = 100%, khối lượng X2 là
Câu 3 :
Cho 12,6 gam hỗn hợp X gồm Al và Al4C3 vào dung dịch KOH dư, sau khi các phản ứng xảy ra hoàn toàn thu được a mol hỗn hợp khí Y và dung dịch Z. Sục khí CO2 dư vào dung dịch Z thu được 31,2 gam kết tủa. Giá trị của a là
Câu 4 :
Cho hỗn hợp X gồm Ba và Al (đều có a mol) tan hoàn toàn trong nước dư thu được dung dịch Y và khí Z. Nhỏ tiếp a mol H2SO4 vào dung dịch Y thu được kết tủa T. Nung T ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn G. Thành phần của chất rắn G là
Câu 5 :
Sục từ từ tới dư khí CO2 vào 400 ml dung dịch Ba(AlO2)2 0,25M. Sau phản ứng hoàn toàn thu được kết tủa có khối lượng là
Câu 6 :
Cho m gam hỗn hợp X gồm Al và Ba có tỉ lệ mol 1 : 1 vào nước dư thu được dung dịch Y và V lít H2. Sục V lít CO2 vào dung dịch Y thu được 5,85 gam kết tủa. Thể tích các khí đo ở cùng điều kiện. Giá trị của m là
Câu 7 :
Cho V lít dung dịch NaOH 1M vào 200 ml dung dịch Al2(SO4)3 0,25M thì thu được kết tủa X và dung dịch Y. Sục khí CO2 tới dư vào dung dịch Y lại thu được 2,34 gam kết tủa. Giá trị của V là
Câu 8 :
Cần ít nhất bao nhiêu ml dung dịch HCl 1M cần cho vào 500 ml dung dịch Na[Al(OH)4] 0,1M để thu được 0,78 g chất kết tủa?
Câu 9 :
Cho dung dịch A chứa 0,05 mol Na[Al(OH)4] và 0,1 mol NaOH tác dụng với dung dịch HCl 2M. Thể tích dung dịch HCl 2M lớn nhất cho vào dung dịch A để xuất hiện 1,56 gam kết tủa là
Câu 10 :
Thêm dung dịch HCl vào dung dịch hỗn hợp gồm 0,1 mol NaOH và 0,1 mol Na[Al(OH)4] thu được 0,08 mol chất kết tủa. Số mol HCl đã thêm vào là:
Câu 11 :
Hòa tan hoàn toàn m gam hỗn hợp Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
Câu 12 :
Cho 12,9 gam hỗn hợp X gồm Al và Al2O3 vào 400 ml dung dịch NaOH 1M, đun nóng. Sau phản ứng hoàn toàn thu được dung dịch Y và thấy thoát ra 3,36 lít H2 (đktc). Thêm 150 ml dung dịch H2SO4 1M vào dung dịch Y, thu được kết tủa có khối lượng là
Câu 13 :
Cho 200 ml dung dịch X gồm Ba(OH)2 0,5M và NaAlO2 (hay Na[Al(OH)4]) 1,5M. Thêm từ từ dung dịch H2SO4 0,5M vào X cho đến khi kết tủa tan trở lại một phần, thu được kết tủa Y. Đem nung Y đến khối lượng không đổi được 24,32 gam chất rắn Z. Thể tích dung dịch H2SO4 0,5M đã dùng là
Câu 14 :
Cho từ từ dung dịch HCl loãng vào dung dịch chứa x mol NaOH và y mol NaAlO2 (hay Na[Al(OH)4]). Sự phụ thuộc của số mol kết tủa thu được vào số mol HCl được biểu diễn theo đồ thị sau: 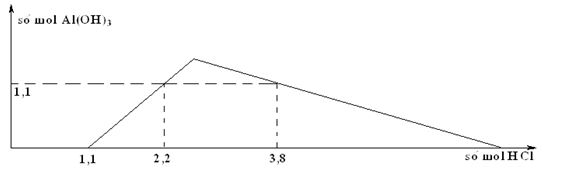 Giá trị của y là
Câu 15 :
Cho đồ thị biểu diễn mối liên hệ giữa lượng ion H+ và lượng kết tủa Al(OH)3 trong phản ứng của dung dịch chứa ion H+ với dung dịch chứa ion AlO2− như sau : 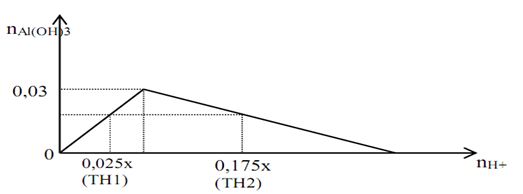 Với x là nồng độ mol/l của dung dịch HCl. Khối lượng kết tủa trong 2 trường hợp đều là a (gam). Dựa vào đồ thị, giá trị của a là
Câu 16 :
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol Ba(OH)2 và b mol Ba(AlO2)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau: 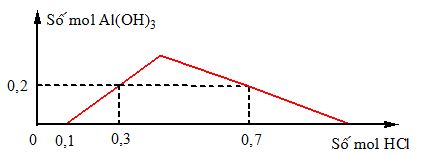 Tỉ lệ a : b là
Câu 17 :
Hỗn hợp X gồm CaC2 x mol và Al4C3 y mol. Cho một lượng nhỏ X vào nước rất dư thu được dung dịch Y, hỗn hợp khí Z gồm C2H2, CH4 và a gam kết tủa Al(OH)3. Đốt cháy hết Z rồi cho toàn bộ sản phẩm vào Y thu được 2a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tỉ lệ x : y bằng
Câu 18 :
Cho 200 ml dung dịch NaOH 3M vào 100 ml dung dịch AlCl3 1M thu được dung dịch X. Nhỏ từ từ đến hết V ml dung dịch HCl 1M vào dung dịch X thu được 5,85 gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị lớn nhất của V là
Lời giải và đáp án
Câu 1 :
Cho p mol Na[Al(OH)4] tác dụng với dung dịch chứa q mol HCl. Để thu được kết tủa thì cần có tỉ lệ
Đáp án : C Phương pháp giải :
Ta có: Na[Al(OH)4]= NaAlO2 + 2 H2O NaAlO2 + H+ + H2O → Al(OH)3 Al(OH)3 + 3H+ → Al3+ + H2O => Thu được kết tủa thì quan hệ giữa H+ và NaAlO2 Lời giải chi tiết :
Na[Al(OH)4]= NaAlO2 + 2 H2O NaAlO2 + H+ + H2O → Al(OH)3 Al(OH)3 + 3H+ → Al3+ + H2O => Để thu được kết tủa thì nH+ (Hay nHCl)< 4.nNa[Al(OH)4] => q< 4p => p/q > 1/4
Câu 2 :
Hòa tan hỗn hợp gồm 0,27 gam bột Al và 2,04 gam bột Al2O3 trong dung dịch NaOH dư thu được dung dịch X. Cho CO2 dư tác dụng với dung dịch X thu được kết tủa X1, nung X1 ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn X2. Biết H = 100%, khối lượng X2 là
Đáp án : A Phương pháp giải :
Bảo toàn Al Lời giải chi tiết :
Thấy được chất rắn sau quá trình phản ứng là Al2O3 Bảo toàn Al: 2nAl2O3 sau phản ứng = nAl + 2nAl2O3 => nAl2O3 sau phản ứng = (0,01 + 0,02.2) / 2 = 0,025 mol => mX = 0,025.102 = 2,55 gam
Câu 3 :
Cho 12,6 gam hỗn hợp X gồm Al và Al4C3 vào dung dịch KOH dư, sau khi các phản ứng xảy ra hoàn toàn thu được a mol hỗn hợp khí Y và dung dịch Z. Sục khí CO2 dư vào dung dịch Z thu được 31,2 gam kết tủa. Giá trị của a là
Đáp án : D Phương pháp giải :
+) Kết tủa thu được sau khi sục CO2 dư là Al(OH)3 +) Bảo toàn Al +) Bảo toàn H Lời giải chi tiết :
Gọi nAl = x mol; nAl4C3 = y mol => 27x + 144y = 12,6 (1) Kết tủa thu được sau khi sục CO2 dư là Al(OH)3 => nAl(OH)3 = 0,4 mol Bảo toàn Al: x + 4y = 0,4 (2) Từ (1) và (2) => x = 0,2 mol; y = 0,05 mol Khí thu được là H2 (1,5x mol) và CH4 (3y mol) => nkhí = a = 1,5x + 3y = 0,45 mol
Câu 4 :
Cho hỗn hợp X gồm Ba và Al (đều có a mol) tan hoàn toàn trong nước dư thu được dung dịch Y và khí Z. Nhỏ tiếp a mol H2SO4 vào dung dịch Y thu được kết tủa T. Nung T ở nhiệt độ cao đến khối lượng không đổi thu được chất rắn G. Thành phần của chất rắn G là
Đáp án : A Phương pháp giải :
xem lại lí thuyết muối aluminat tác dụng với H+ Lời giải chi tiết :
{Ba:amolAl:amol+H2O→{ddY:{Ba(AlO2)2:0,5amolBa(OH)2:0,5amolamolH2SO4→{Al(OH)3:2a3molBaSO4:amolto→{Al2O3BaSO4Z:H2
Câu 5 :
Sục từ từ tới dư khí CO2 vào 400 ml dung dịch Ba(AlO2)2 0,25M. Sau phản ứng hoàn toàn thu được kết tủa có khối lượng là
Đáp án : B Phương pháp giải :
Bảo toàn Al Lời giải chi tiết :
nBa(AlO2)2 = 0,1 mol Bảo toàn nguyên tử Al: nAl(OH)3 = nAlO2- = 0,2 mol => m = 15,6 gam
Câu 6 :
Cho m gam hỗn hợp X gồm Al và Ba có tỉ lệ mol 1 : 1 vào nước dư thu được dung dịch Y và V lít H2. Sục V lít CO2 vào dung dịch Y thu được 5,85 gam kết tủa. Thể tích các khí đo ở cùng điều kiện. Giá trị của m là
Đáp án : B Phương pháp giải :
Ba + H2O → Ba(OH)2 + H2 2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2 +) dung dịch Y gồm Ba(AlO2)2 (0,5a mol) và Ba(OH)2 dư (0,5a mol) Sục V lít CO2 (hay 2,5a mol CO2) vào Y 2CO2 + Ba(AlO2)2 + 4H2O → 2Al(OH)3 + Ba(HCO3)2 a ← 0,5a → a 2CO2 + Ba(OH)2 → Ba(HCO3)2 a ← 0,5a → 0,5a => kết tủa thu được chỉ là Al(OH)3 Lời giải chi tiết :
Gọi nAl = a mol => nBa = a mol Ba + H2O → Ba(OH)2 + H2 a → a 2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2 a → 0,5a → 0,5a → 1,5a => dung dịch Y gồm Ba(AlO2)2 (0,5a mol) và Ba(OH)2 dư (0,5a mol) Sục V lít CO2 (hay 2,5a mol CO2) vào Y 2CO2 + Ba(AlO2)2 + 4H2O → 2Al(OH)3 + Ba(HCO3)2 a ← 0,5a → a 2CO2 + Ba(OH)2 → Ba(HCO3)2 a ← 0,5a → 0,5a => kết tủa thu được chỉ là Al(OH)3 => mkết tủa = 78a = 5,85 => a = 0,075 mol => m = 0,075.27 + 0,075.137 = 12,3 gam
Câu 7 :
Cho V lít dung dịch NaOH 1M vào 200 ml dung dịch Al2(SO4)3 0,25M thì thu được kết tủa X và dung dịch Y. Sục khí CO2 tới dư vào dung dịch Y lại thu được 2,34 gam kết tủa. Giá trị của V là
Đáp án : C Phương pháp giải :
bài toán muối nhôm tác dụng với dung dịch kiềm + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
nAl2(SO4)3 = 0,2. 0,25 = 0,05 mol => n Al3+ = 0,05.2 = 0,1 mol n↓ Al(OH)3 = 2,34: 78 = 0,03 mol => ↓ thực tế là : 0,1 – 0,03 = 0,07 mol Al(OH)3 Vậy dung dịch gồm: NaAlO2 : 0,03 mol và Na2SO4 : 0,05. 3 = 0,15 mol => ∑ nNa = 0,03 + 0,15.2 = 0,33 mol => V = 0,33 : 1 = 0,33 lít
Câu 8 :
Cần ít nhất bao nhiêu ml dung dịch HCl 1M cần cho vào 500 ml dung dịch Na[Al(OH)4] 0,1M để thu được 0,78 g chất kết tủa?
Đáp án : A Phương pháp giải :
+ Nếu b/a ⩽ 1 thì nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3 + Nếu b/a \geqslant 4 thì không có kết tủa Lời giải chi tiết :
Ta có: a = 0,05 mol; b = 0,01 mol => b < a Đề bài yêu cầu tính VHCl nhỏ nhất có nghĩa là phải tính nH+ min thì nH+ = b = 0,01 => V = 0,01 lít = 10 ml
Câu 9 :
Cho dung dịch A chứa 0,05 mol Na[Al(OH)4] và 0,1 mol NaOH tác dụng với dung dịch HCl 2M. Thể tích dung dịch HCl 2M lớn nhất cho vào dung dịch A để xuất hiện 1,56 gam kết tủa là
Đáp án : C Phương pháp giải :
+ Nếu b/a \leqslant 1 thì nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3 + Nếu b/a \geqslant 4 thì không có kết tủa Lời giải chi tiết :
nHCl trung hoà NaOH = 0,1 mol. a = 0,05 mol; b = 0,02 mol => b < a Đề bài yêu cầu tính thể tích HCl lớn nhất có nghĩa là phải tính nH+ max thì nH+ = 4a – 3b = 0,14 mol. => VHCl = (0,1 + 0,14) / 2 = 0,12 lít
Câu 10 :
Thêm dung dịch HCl vào dung dịch hỗn hợp gồm 0,1 mol NaOH và 0,1 mol Na[Al(OH)4] thu được 0,08 mol chất kết tủa. Số mol HCl đã thêm vào là:
Đáp án : B Phương pháp giải :
TH1: Al3+ chưa kết tủa hết: nHCl = nNaOH + nAl(OH)3 TH2: kết tủa bị hoà tan 1 phần OH- + H+ → H2O AlO2- + H+ + H2O → Al(OH)3 Al(OH)3 + 3H+ → Al3+ + 3 H2O Lời giải chi tiết :
Ta có: nHCl trung hoà NaOH = 0,1 mol. TH1: Kết tủa chưa bị hòa tan: OH- + H+ → H2O AlO2- + H+ + H2O → Al(OH)3 nHCl = nNaOH + nAl(OH)3 = 0,1 +b = 0,1 +0,08 = 0,18 mol TH2: Kết tủa bị hòa tan 1 phần OH- + H+ → H2O 0,1 0,1 AlO2- + H+ + H2O → Al(OH)3 0,1 0,1 0,1 Al(OH)3 + 3H+ → Al3+ + 3 H2O 0,02 0,06 nHCl = 0,1 + 0,1 + 0,06 = 0,26 mol
Câu 11 :
Hòa tan hoàn toàn m gam hỗn hợp Na2O và Al2O3 vào nước thu được dung dịch X trong suốt. Thêm từ từ dung dịch HCl 1M vào X, khi hết 100 ml thì bắt đầu xuất hiện kết tủa; khi hết 300 ml hoặc 700 ml thì đều thu được a gam kết tủa. Giá trị của a và m lần lượt là
Đáp án : C Phương pháp giải :
+ Nếu b/a \leqslant 1 thì nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3 + Nếu b/a \geqslant 4 thì không có kết tủa + Bảo toàn nguyên tố Na: 2nNa2O = nNaAlO2 + nNaOH dư + Bảo toàn nguyên tố Al: 2nAl2O3 = nNaAlO2 Lời giải chi tiết :
Dung dịch X gồm NaAlO2 và NaOH dư nHCl trung hòa NaOH dư = 0,1 mol + Khi hết 300 ml dung dịch HCl => kết tủa chưa bị hòa tan, H+ hết, NaAlO2 dư => nAl(OH)3 = nHCl = 0,3 – 0,1 = 0,2 mol => mAl(OH)3 = 0,2.78 = 15,6 gam + Khi hết 700 ml dung dịch HCl => kết tủa bị hòa tan 1 phần => nAl(OH)3 = (4.nNaAlO2 - nHCl) / 3 => 0,2.3 = 4.nNaAlO2 – (0,7 – 0,1) => nNaAlO2 = 0,3 mol Bảo toàn nguyên tố Na: 2nNa2O = nNaAlO2 + nNaOH dư => nNa2O = (0,3 + 0,1) / 2 = 0,2 mol Bảo toàn nguyên tố Al: 2nAl2O3 = nNaAlO2 => nAl2O3 = 0,3 / 2 = 0,15 mol => m = 27,7 gam
Câu 12 :
Cho 12,9 gam hỗn hợp X gồm Al và Al2O3 vào 400 ml dung dịch NaOH 1M, đun nóng. Sau phản ứng hoàn toàn thu được dung dịch Y và thấy thoát ra 3,36 lít H2 (đktc). Thêm 150 ml dung dịch H2SO4 1M vào dung dịch Y, thu được kết tủa có khối lượng là
Đáp án : D Phương pháp giải :
+ Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
nH2= 0,15 mol ; nNaOH = 0,4 mol Do phản ứng hoàn toàn tạo dung dịch Y => Al, Al2O3 hết => nAl = 2/3 nH2 = 0,1 mol => nAl2O3 = 0,1 mol => Dung dịch Y gồm : 0,3 mol NaAlO2 và 0,1 mol NaOH dư nH2SO4 = 0,15 mol => nH+ = 0,3 mol => nAl(OH)3 = nH+ - nNaOH dư = 0,2 mol => mkết tủa = 15,6 gam
Câu 13 :
Cho 200 ml dung dịch X gồm Ba(OH)2 0,5M và NaAlO2 (hay Na[Al(OH)4]) 1,5M. Thêm từ từ dung dịch H2SO4 0,5M vào X cho đến khi kết tủa tan trở lại một phần, thu được kết tủa Y. Đem nung Y đến khối lượng không đổi được 24,32 gam chất rắn Z. Thể tích dung dịch H2SO4 0,5M đã dùng là
Đáp án : B Phương pháp giải :
+ Nếu b/a \leqslant 1 thì nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3 + Nếu b/a \geqslant 4 thì không có kết tủa Lời giải chi tiết :
nBa(OH)2 = 0,1 mol ; nNaAlO2 = 0,3 mol Kết tủa tan trở lại 1 phần : OH- + H+ → H2O AlO2- + H+ + H2O → Al(OH)3 Al(OH)3 + 3H+ → Al3+ + 3H2O => BaSO4 đạt kết tủa tối đa và còn một lượng Al2O3 => nAl2O3 = 0,01 mol => nAl(OH)3 = 0,02 mol => nH+ = nOH- + 4nAlO2 – 3nAl(OH)3 = 1,34 mol => Vdd H2SO4 = 1,34 lít
Câu 14 :
Cho từ từ dung dịch HCl loãng vào dung dịch chứa x mol NaOH và y mol NaAlO2 (hay Na[Al(OH)4]). Sự phụ thuộc của số mol kết tủa thu được vào số mol HCl được biểu diễn theo đồ thị sau:  Giá trị của y là
Đáp án : C Phương pháp giải :
+ Nếu b/a \leqslant 1 thì nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3 + Nếu b/a \geqslant 4 thì không có kết tủa Lời giải chi tiết :
Tại nHCl = 1,1 mol => Trung hòa hết NaOH => x = 1,1 mol +)Tại nHCl = 2,2 mol => AlO2 dư +) Tại : nHCl = 3,8 mol => Kết tủa tan 1 phần => 3nAl(OH)3 = 4nAlO2 – (nH+ - nOH-) => y = 1,5 mol
Câu 15 :
Cho đồ thị biểu diễn mối liên hệ giữa lượng ion H+ và lượng kết tủa Al(OH)3 trong phản ứng của dung dịch chứa ion H+ với dung dịch chứa ion AlO2− như sau :  Với x là nồng độ mol/l của dung dịch HCl. Khối lượng kết tủa trong 2 trường hợp đều là a (gam). Dựa vào đồ thị, giá trị của a là
Đáp án : B Phương pháp giải :
+ Nếu b/a \leqslant 1 thì nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3 + Nếu b/a \geqslant 4 thì không có kết tủa Lời giải chi tiết :
Theo đồ thị ta có nAlO2− = nkết tủa max = 0,03 mol =>TH1: AlO2− dư, còn TH2 thì kết tủa bị hòa tan 1 phần => nkết tủa = 0,025x = (4.0,03 – 0,175x) / 3 => x = 0,48 mol => a = 0,025x.78 = 0,936 gam
Câu 16 :
Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol Ba(OH)2 và b mol Ba(AlO2)2, kết quả thí nghiệm được biểu diễn trên đồ thị sau:  Tỉ lệ a : b là
Đáp án : A Phương pháp giải :
+ Nếu b/a \leqslant 1 thì nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và nAl(OH)3 = (4a – b)/3 + Nếu b/a \geqslant 4 thì không có kết tủa Lời giải chi tiết :
+ Trong khoảng từ 0 – 0,1 thì HCl làm nhiệm vụ trung hòa Ba(OH)2 => nBa(OH)2 = a = nHCl / 2 = 0,05 mol + nHCl = 0,7 mol làm 2 nhiệm vụ: đưa kết tủa cực đại sau đó hòa tan kết tủa => nAl(OH)3 = (4.nAlO2- - nHCl phản ứng với AlO2-) / 3 => 3.0,2 = 4.2b – (0,7 – 0,1) => b = 0,15 mol => a : b = 1 : 3
Câu 17 :
Hỗn hợp X gồm CaC2 x mol và Al4C3 y mol. Cho một lượng nhỏ X vào nước rất dư thu được dung dịch Y, hỗn hợp khí Z gồm C2H2, CH4 và a gam kết tủa Al(OH)3. Đốt cháy hết Z rồi cho toàn bộ sản phẩm vào Y thu được 2a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Tỉ lệ x : y bằng
Đáp án : D Lời giải chi tiết :
Gọi nCaC2 = x mol Bảo toàn Ca và bảo toàn C => nCa(OH)2 = nC2H2 = x mol Gọi nAl4C3 = y mol Bảo toàn Al : nAl(OH)3 = 4y mol Bảo toàn C: nCH4 = 3y mol 2Al(OH)3 + Ca(OH)2 → Ca(AlO2)2 + 4H2O 2x ← x → x => Phần Al(OH)3 còn lại = 4y – 2x = a / 78 (1) Đốt Z thu được nCO2 = 2x + 3y Hấp thụ CO2 này vào phần dung dịch chứa Ca(AlO2)2 (x mol) 2CO2 + Ca(AlO2)2 + 4H2O → Ca(HCO3)2 + 2Al(OH)3 => kết tủa chỉ còn Al(OH)3 = 2x = 2a / 78 (2) Từ (1) và (2) => x = a / 78 và y = 3a / 312 => x : y = 4 : 3
Câu 18 :
Cho 200 ml dung dịch NaOH 3M vào 100 ml dung dịch AlCl3 1M thu được dung dịch X. Nhỏ từ từ đến hết V ml dung dịch HCl 1M vào dung dịch X thu được 5,85 gam kết tủa. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị lớn nhất của V là
Đáp án : D Phương pháp giải :
Lập tỉ lệ nOH-/nAl3+ → xác định được phản ứng tạo ra muối AlO2‑, OH- còn dư sau phản ứng Xác định thành phần các chất trong dd X gồm: AlO2-; OH‑ và Cl‑ Cho dd X + V ml HCl → tạo ra 5,85 gam kết tủa. V lớn nhất ứng với trường hợp tạo kết tủa Al(OH)3 sau đó kết tủa hòa tan 1 phần CT nhanh: nH+ = nOH- + 4nAlO2- - 3nAl(OH)3 còn lại Lời giải chi tiết :
nNaOH = 0,2.3 = 0,6 (mol) nAlCl3 = 0,1.1 = 0,1 (mol) Ta có: \dfrac{{{n_{O{H^ - }}}}}{{{n_{A{l^{3 + }}}}}} = \dfrac{{0,6}}{{0,1}} = 6 > 4→ phản ứng tạo ra muối AlO2-, kết tủa Al(OH)3 tan hoàn toàn, dd sau pư dư OH- Al3+ + 4OH- → AlO2- + H2O 0,1 → 0,4 → 0,1 (mol) Vậy dd X thu được sau pư chứa: \left\{ \begin{gathered}Al{O_2}^ - :0,1\,(mol) \hfill \\O{H^ - }:0,6 - 0,4 = 0,2\,(mol) \hfill \\C{l^ - }:0,3\,(mol) \hfill \\ \end{gathered} \right. Cho dd X + V ml HCl → tạo ra 5,85 gam kết tủa. V lớn nhất ứng với trường hợp tạo kết tủa Al(OH)3 sau đó kết tủa hòa tan 1 phần nAl(OH)3 = 5,85:78 = 0,075 (mol) H+ + OH- → H2O 0,2 ← 0,2 (mol) AlO2- + H+ + H2O → Al(OH)3↓ 0,1 → 0,1 → 0,1 (mol) Al(OH)3 + 3H+ → Al3+ + 3H2O (0,1 - 0,075)→ 0,075 (mol) → ∑ nH+ = 0,2 + 0,1 + 0,075 = 0,375 (mol) → VHCl = nHCl : CM = 0,375 : 1 = 0,375 (lít) = 375 (ml)
|












