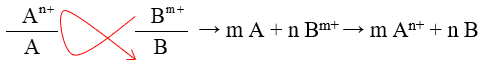Trắc nghiệm Bài 31. Sắt - Hóa 12Đề bài
Câu 1 :
Nguyên tử của nguyên tố sắt có
Câu 2 :
Cho Fe (Z = 26). Cấu hình electron đúng của ion Fe2+ là
Câu 3 :
Tính chất vật lí nào sau đây của sắt khác với các đơn chất kim loại khác ?
Câu 4 :
Phương trình hóa học nào sau đây viết không đúng ?
Câu 5 :
Quặng sắt manhetit có thành phần chính là
Câu 6 :
Dãy bao gồm các ion sắp xếp theo chiều giảm dần tính oxi hóa là
Câu 7 :
Có thể đựng axit nào sau đây trong bình sắt ?
Câu 8 :
Đốt một lượng dư sắt trong khí clo thu được hỗn hợp gồm 2 chất rắn. Thành phần chất rắn đó gồm
Câu 9 :
Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch
Câu 10 :
Kim loại sắt tác dụng với dung dịch nào sau đây tạo muối sắt (II)
Câu 11 :
Để bảo quản dung dịch FeSO4 trong phòng thí nghiệm, người ta cần thêm vào bình chất nào dưới đây
Câu 12 :
Cho từ từ đến dư kim loại Na vào dung dịch có chứa muối FeCl3. Số phản ứng xảy ra là:
Câu 13 :
Khi để trong không khí nhôm khó bị ăn mòn hơn sắt là do
Câu 14 :
Trường hợp không xảy ra phản ứng hoá học là:
Câu 15 :
Ngâm thanh Cu (dư) vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe (dư) vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
Câu 16 :
Cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thu được khí NO là sản phẩm khử duy nhất, dung dịch Y và còn lại chất rắn chưa tan Z. Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra. Thành phần chất tan trong dung dịch Y là:
Câu 17 :
Cho kim loại M tác dụng với Cl2 thu được muối X. Cho kim loại M tác dụng với HCl thu được muối Y. Nếu cho M tác dụng với muối X thu được muối Y. M là
Câu 18 :
Có 4 dung dịch đựng riêng biệt: (a) HCl; (b) CuCl2; (c) FeCl2; (d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh sắt nguyên chất. Số trường hợp xảy ra ăn mòn điện hóa là
Câu 19 :
Để điều chế Fe trong công nghiệp, người ta có thể dùng phương pháp nào sau đây:
Câu 20 :
Trong các kim loại quặng sắt, quặng có hàm lượng sắt cao nhất là:
Câu 21 :
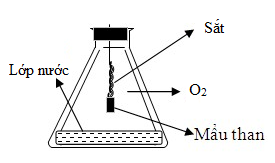
Phản ứng của Fe với O2 như hình vẽ
Cho các phát biểu sau đây: (a) Vai trò của mẩu than để làm mồi cung cấp nhiệt cho phản ứng. (b) Phản ứng tỏa nhiều nhiệt làm đầu dây sắt nóng chảy có thể thành cục tròn. (c) Vai trò của lớp nước ở đáy bình là để tránh vỡ bình. (d) Phản ứng cháy sáng, có các tia lửa bắn ra từ dây sắt. Số phát biểu sai là
Câu 22 :
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố Fe(Z = 26) thuộc chu kì nào?
Câu 23 :
Những nhận định sau về kim loại sắt: (1) Kim loại sắt có tính khử trung bình. (2) Ion Fe2+ bền hơn Fe3+. (3) Fe bị thụ động trong H2SO4 đặc nguội. (4) Quặng manhetit là quặng có hàm lượng sắt cao nhất. (5) Trái đất tự quay và sắt là nguyên nhân làm Trái Đất có từ tính. (6) Kim loại sắt có thể khử được ion Fe3+. Số nhận định đúng là
Câu 24 :
Ở nhiệt độ thường, kim loại Fe phản ứng được với dung dịch nào sau đây?
Câu 25 :
Kim loại sắt phản ứng với lượng dư dung dịch chất nào sau đây tạo ra muối sắt(II)?
Lời giải và đáp án
Câu 1 :
Nguyên tử của nguyên tố sắt có
Đáp án : B Lời giải chi tiết :
- Cấu hình electron: 1s22s22p63s23p63d64s2 => sắt có 6 electron d
Câu 2 :
Cho Fe (Z = 26). Cấu hình electron đúng của ion Fe2+ là
Đáp án : C Lời giải chi tiết :
- Cấu hình electron: 1s22s22p63s23p63d64s2 => cấu hình e của ion Fe2+ là [18Ar]3d6
Câu 3 :
Tính chất vật lí nào sau đây của sắt khác với các đơn chất kim loại khác ?
Đáp án : D Lời giải chi tiết :
Tính chất khác là sắt có tính nhiễm từ
Câu 4 :
Phương trình hóa học nào sau đây viết không đúng ?
Đáp án : B Lời giải chi tiết :
Phương trình hóa học viết không đúng là : 4Fe + 3O2(kk) $\xrightarrow{{{t}^{o}}}$ 2Fe2O3 Vì Fe cháy trong oxi không khí sinh ra oxit sắt từ Fe3O4
Câu 5 :
Quặng sắt manhetit có thành phần chính là
Đáp án : C Lời giải chi tiết :
Quặng sắt manhetit có thành phần chính là Fe3O4
Câu 6 :
Dãy bao gồm các ion sắp xếp theo chiều giảm dần tính oxi hóa là
Đáp án : C Phương pháp giải :
xem lại lí thuyết dãy điện hóa Lời giải chi tiết :
Dãy các ion sắp xếp theo chiều giảm dần tính oxi hóa là Ag+, Fe3+, Cu2+, Fe2+.
Câu 7 :
Có thể đựng axit nào sau đây trong bình sắt ?
Đáp án : C Lời giải chi tiết :
Bình sắt có thể đựng được axit HNO3 đặc nguội vì sắt bị thụ động trong HNO3 đặc nguội
Câu 8 :
Đốt một lượng dư sắt trong khí clo thu được hỗn hợp gồm 2 chất rắn. Thành phần chất rắn đó gồm
Đáp án : B Lời giải chi tiết :
Fe dư => chất rắn sau phản ứng chứa Fe dư và muối Fe(III)
Câu 9 :
Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch
Đáp án : D Lời giải chi tiết :
Kim loại Fe không đẩy được Mg ra khỏi muối MgCl2
Câu 10 :
Kim loại sắt tác dụng với dung dịch nào sau đây tạo muối sắt (II)
Đáp án : B Lời giải chi tiết :
Fe tác dụng với HNO3 và H2SO4 đặc nóng dư đều thu được muối sắt (III) Fe + CuSO4 → FeSO4 + Cu
Câu 11 :
Để bảo quản dung dịch FeSO4 trong phòng thí nghiệm, người ta cần thêm vào bình chất nào dưới đây
Đáp án : A Lời giải chi tiết :
Người ta dùng đinh Fe sạch để sắt khử muối sắt(III) thành muối sắt(II): Fe + Fe2(SO4)3 → 3FeSO4
Câu 12 :
Cho từ từ đến dư kim loại Na vào dung dịch có chứa muối FeCl3. Số phản ứng xảy ra là:
Đáp án : B Phương pháp giải :
xem lại lí thuyết về sắt Lời giải chi tiết :
2Na + 2H2O → 2Na+ + 2OH- + H2 Fe3+ + 3OH- → Fe(OH)3
Câu 13 :
Khi để trong không khí nhôm khó bị ăn mòn hơn sắt là do
Đáp án : B Phương pháp giải :
xem lại lí thuyết về sắt Lời giải chi tiết :
Khi để trong không khí nhôm khó bị ăn mòn hơn sắt là do trên bề mặt nhôm có lớp Al2O3 bền vững bảo vệ
Câu 14 :
Trường hợp không xảy ra phản ứng hoá học là:
Đáp án : D Lời giải chi tiết :
Trường hợp không xảy ra phản ứng hoá học là Cu + dung dịch FeCl2.
Câu 15 :
Ngâm thanh Cu (dư) vào dung dịch AgNO3 thu được dung dịch X. Sau đó ngâm thanh Fe (dư) vào dung dịch X thu được dung dịch Y. Biết các phản ứng xảy ra hoàn toàn. Dung dịch Y có chứa chất tan là:
Đáp án : B Lời giải chi tiết :
- Các phản ứng xảy ra: Cu(dư) + AgNO3 → Cu(NO3)2 + Ag Cu(NO3)2 + Fe(dư) → Fe(NO3)2 + Cu Vậy dung dịch Y chứa Fe(NO3)2.
Câu 16 :
Cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thu được khí NO là sản phẩm khử duy nhất, dung dịch Y và còn lại chất rắn chưa tan Z. Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra. Thành phần chất tan trong dung dịch Y là:
Đáp án : C Lời giải chi tiết :
- Cho Z tác dụng với dung dịch H2SO4 loãng thấy có khí thoát ra Þ trong Z có chứa Fe. - Vì lượng Fe còn dư sau phản ứng nên khi cho hỗn hợp X gồm Fe, Cu vào dung dịch HNO3 loãng, nóng thì dung dịch Y thu được chỉ có chứa Fe(NO3)2.
Câu 17 :
Cho kim loại M tác dụng với Cl2 thu được muối X. Cho kim loại M tác dụng với HCl thu được muối Y. Nếu cho M tác dụng với muối X thu được muối Y. M là
Đáp án : C Lời giải chi tiết :
M tác dụng với Cl2 và với HCl cho 2 muối khác nhau => kim loại M có nhiều hóa trị
Câu 18 :
Có 4 dung dịch đựng riêng biệt: (a) HCl; (b) CuCl2; (c) FeCl2; (d) HCl có lẫn CuCl2. Nhúng vào mỗi dung dịch một thanh sắt nguyên chất. Số trường hợp xảy ra ăn mòn điện hóa là
Đáp án : D Phương pháp giải :
xem lại lí thuyết về sắt Lời giải chi tiết :
Để xảy ra quá trình ăn mòn điện hóa cần thỏa mãn 3 điều kiện: + Có 2 điện cực khác bản + 2 điện cực tiếp xúc trực tiếp hoặc gián tiếp với nhau + 2 điện cực được nhúng trong cùng 1 dung dịch chất điện li Có 2 trường hợp thỏa mãn: Fe nhúng vào dung dịch CuCl2 và Fe nhúng vào dung dịch CuCl2 + HCl
Câu 19 :
Để điều chế Fe trong công nghiệp, người ta có thể dùng phương pháp nào sau đây:
Đáp án : D Phương pháp giải :
xem lại lí thuyết về sắt Lời giải chi tiết :
điều chế Fe trong công nghiệp, người ta có thể dùng phương pháp khử Fe2O3 bằng khí CO A và B sai vì kim loại Mg và Al giá thành cao hơn Fe C sai vì đphương pháp điện phân dung dịch tốn nhiều chi phí
Câu 20 :
Trong các kim loại quặng sắt, quặng có hàm lượng sắt cao nhất là:
Đáp án : B Lời giải chi tiết :
Hematit nâu Fe2O3.nH2O Manhetit Fe3O4 Xiđerit FeCO3 Hematit đỏ Fe2O3 Ta tính %Fe trong các quặng trên, quặng có %Fe lớn nhất là manhetit
Câu 21 :
Phản ứng của Fe với O2 như hình vẽ
Cho các phát biểu sau đây: (a) Vai trò của mẩu than để làm mồi cung cấp nhiệt cho phản ứng. (b) Phản ứng tỏa nhiều nhiệt làm đầu dây sắt nóng chảy có thể thành cục tròn. (c) Vai trò của lớp nước ở đáy bình là để tránh vỡ bình. (d) Phản ứng cháy sáng, có các tia lửa bắn ra từ dây sắt. Số phát biểu sai là
Đáp án : B Phương pháp giải :
Dựa vào kiến thức phản ứng đốt cháy của Fe với O2 Lời giải chi tiết :
Tất cả các đáp án đều đúng → có 0 phát biểu sai
Câu 22 :
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố Fe(Z = 26) thuộc chu kì nào?
Đáp án : D Phương pháp giải :
Viết cấu hình e của Fe sau đó có bao nhiêu lớp e thì Fe thuộc chu kì đó Lời giải chi tiết :
Fe (Z = 26) có cấu hình: [Ar]3d64s2 → Có 4 lớp => thuộc chu kì 4 trong bảng hệ thống tuần hoàn.
Câu 23 :
Những nhận định sau về kim loại sắt: (1) Kim loại sắt có tính khử trung bình. (2) Ion Fe2+ bền hơn Fe3+. (3) Fe bị thụ động trong H2SO4 đặc nguội. (4) Quặng manhetit là quặng có hàm lượng sắt cao nhất. (5) Trái đất tự quay và sắt là nguyên nhân làm Trái Đất có từ tính. (6) Kim loại sắt có thể khử được ion Fe3+. Số nhận định đúng là
Đáp án : B Lời giải chi tiết :
(1) đúng (2) sai, Fe2+ trong không khí dễ bị oxi hóa thành Fe3+ (3) đúng (4) đúng, quặng manhetit (Fe3O4) là quặng có hàm lượng Fe cao nhất. (5) sai, vì từ trường Trái Đất sinh ra do sự chuyển động của các chất lỏng dẫn điện (6) đúng, Fe + 2Fe3+ → 3Fe2+ Vậy có 4 phát biểu đúng
Câu 24 :
Ở nhiệt độ thường, kim loại Fe phản ứng được với dung dịch nào sau đây?
Đáp án : C Phương pháp giải :
Dựa vào quy tắc alpha trong dãy điện hóa
Lời giải chi tiết :
Fe + CuSO4 → FeSO4 + Cu
Câu 25 :
Kim loại sắt phản ứng với lượng dư dung dịch chất nào sau đây tạo ra muối sắt(II)?
Đáp án : C Phương pháp giải :
Xem lại TCHH của sắt Lời giải chi tiết :
- Tác dụng với HNO3 dư (loãng hay đặc nóng) đều cho muối Fe3+ - Tác dụng với H2SO4 đặc nóng cho Fe3+; tác dụng với H2SO4 loãng cho Fe2+ Fe + H2SO4 loãng → FeSO4 + H2
|