Trắc nghiệm Bài 35. Đồng và hợp chất của đồng - Hóa 12Đề bài
Câu 1 :
Trong các hợp chất, đồng có số oxi hóa +1, +2. Biết Cu có Z = 29, cấu hình electron của các ion Cu+ và Cu2+ lần lượt là
Câu 2 :
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng ?
Câu 3 :
Để nhận biết ba axit đặc nguội HCl, H2SO4, HNO3 đựng riêng biệt trong ba lọ bị mất nhãn, ta dùng thuốc thử
Câu 4 :
Cho Cu lần lượt tác dụng hết với mỗi chất oxi hóa dưới đây có cùng số mol. Trường hợp nào thu được số mol Cu(II) nhỏ nhất ?
Câu 5 :
Cu bị hòa tan trong nước cường toan (tỉ lệ mol của HCl và HNO3 là 3 : 1) và giải phóng khí NO. Tổng hệ số cân bằng (khi tối giản) là
Câu 6 :
Cho các dung dịch loãng : (1) FeCl3, (2) FeCl2, (3) H2SO4, (4) HNO3, (5) hỗn hợp gồm HCl và NaNO3. Những dung dịch phản ứng được với Cu là
Câu 7 :
Để khử ion trong dung dịch CuSO4 có thể dùng kim loại nào sau đây ?
Câu 8 :
Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sunfuric loãng đun nóng là vì
Câu 9 :
Cho các phản ứng chuyển hóa quặng thành Cu: CuFeS2 + O2 $\xrightarrow{{{t}^{o}}}$ X X + O2 $\xrightarrow{{{t}^{o}}}$Y Y + X $\xrightarrow{{{t}^{o}}}$ Cu Hai chất X và Y lần lượt là
Câu 10 :
Có thể phát hiện ra dấu vết của nước trong ancol etylic bằng cách dùng
Câu 11 :
Trong không khí ẩm, kim loại đồng bị bao phủ bởi lớp màng
Câu 12 :
Thêm NH3 đến dư vào dung dịch hỗn hợp chứa MgCl2, AlCl3, FeCl3 và CuCl2 thu được kết tủa X. Cho X vào dung dịch NaOH dư, còn lại chất rắn không tan Z. Chất rắn Z là
Câu 13 :
Cho các chất sau: CuO, Cu2O, CuSO4, Cu(NO3)2, [Cu(NH3)4](OH)2, Cu. Số chất có thể điều chế trực tiếp từ Cu(OH)2 là
Câu 14 :
Cho các hợp chất: CuS, CuO, Cu2O, CuCO3, Cu2S lần lượt phản ứng với dung dịch H2SO4 đặc, nóng, dư. Số phản ứng oxi hóa khử xảy ra là
Câu 15 :
Cho các dung dịch: HCl, NaOH, NH3, KCl. Số dung dịch phản ứng được với Cu(OH)2 là
Câu 16 :
Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung ở nhiệt độ cao. Sau phản ứng hỗn hợp chất rắn còn lại là
Câu 17 :
Một mẫu nước thải được sục vào dung dịch CuSO4 thấy xuất hiện kết tủa màu đen. Hiện tượng này do chất nào có trong khí thải sinh ra ?
Câu 18 :
Chọn câu đúng trong các câu sau :
Câu 19 :
Hỗn hợp rắn X gồm Al, Fe2O3, Cu có số mol bằng nhau. Hỗn hợp X có thể tan hoàn toàn trong dung dịch
Câu 20 :
Cho PTHH : aCuFeS2 + bHNO3 → cCu(NO3)2 + dFe(NO3)3 + eH2SO4 + fNO2 + gH2O Giá trị của b là
Câu 21 :
Cho hỗn hợp X gồm Cu, Ag, Fe, Al tác dụng với oxi dư khi đun nóng thu được chất rắn Y. Cho Y vào dung dịch HCl dư, khuấy kĩ sau đó lấy sản phẩm thu được cho tác dụng với dung dịch NaOH loãng dư. Lọc lấy kết tủa tạo thành đem nung trong không khí đến khối lượng không đổi thu được chất rắn Z. Biết các phản ứng xảy ra hoàn toàn. Thành phần của Z gồm
Câu 22 :
Cho sơ đồ sau : Cu → X1 → X2 → X3 → X4 → Cu. Dãy chất nào sau đây không thể tương ứng với X1, X2, X3, X4 ?
Câu 23 :
Cho 7,68 gam Cu vào 200 ml dung dịch X gồm HNO3 0,6M và H2SO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn (sản phẩm khử duy nhất là NO), cô cạn cẩn thận toàn bộ dung dịch sau phản ứng thì khối lượng muối khan thu được là
Câu 24 :
Nung 6,58 gam Cu(NO3)2 trong bình kín không có không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
Câu 25 :
Nhiệt phân hoàn toàn 34,65 gam hỗn hợp gồm KNO3 và Cu(NO3)2, thu được hỗn hợp khí X có tỉ khối so với khí hiđro bằng 18,8. Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Câu 26 :
Cho 19,2 gam Cu vào 500 ml dung dịch NaNO3 1M, sau đó thêm vào 500 ml dung dịch HCl 2M. Kết thúc phản ứng thu được dung dịch X và khí NO duy nhất. Phải thêm bao nhiêu ml dung dịch NaOH 1M vào X để vừa đủ kết tủa hết ion Cu2+ ?
Câu 27 :
Thực hiện hai thí nghiệm: TN 1: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO3 1M thoát ra V1 lít NO. TN 2: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1M và H2SO4 0,5 M. thoát ra V2 lít NO. Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. Quan hệ giữa V1 và V2 là
Câu 28 :
Hòa tan hoàn toàn 1,23 gam hỗn hợp X gồm Cu và Al vào dung dịch HNO3 đặc, nóng, dư thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Sục từ từ khí NH3 đến dư vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Phần trăm về khối lượng của Cu trong hỗn hợp X và giá trị của m lần lượt là
Câu 29 :
Đốt cháy m gam CuS trong khí oxi dư thu được chất rắn X có khối lượng bằng (m – 4,8) gam. Nung X với khí NH3 dư tới khi khối lượng không đổi được chất rắn Y. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng dư, thu được V lít khí Z (đktc) không màu, hóa nâu trong không khí. Giá trị của m và V là
Câu 30 :
Cho 8 gam bột Cu vào 20 ml dung dịch AgNO3, sau một thời gian thu được dung dịch A và lọc được 9,52 gam chất rắn. Cho tiếp 8 gam bột Pb vào dung dịch A đến khi phản ứng hoàn toàn thu được dung dịch B chỉ chứa một muối duy nhất và tách ra được 6,705 gam chất rắn. Nồng độ mol của AgNO3 ban đầu là
Câu 31 :
Hòa tan hoàn toàn 40 gam hỗn hợp X gồm CuS, FeS, Cu2S trong dung dịch HNO3 đun nóng. Sau phản ứng thu được hỗn hợp khí gồm SO2 và NO2 có tổng khối lượng là 153,04 gam và dung dịch Y chỉ chứa 90 gam các muối trung hòa. Cho Y tác dụng với dung dịch BaCl2 dư thấy tách ra 60,58 gam kết tủa. Hiệu số mol NO2 và SO2 gần nhất với giá trị nào sau đây
Câu 32 :
Cho dung dịch KOH vào dung dịch chất X, thu được kết tủa màu xanh lam. Chất X là
Câu 33 :
Dung dịch nào dưới đây không hòa tan được Cu kim loại?
Câu 34 :
Cho m gam bột Zn tác dụng hoàn toàn với dung dịch CuSO4 dư, thu được 9,6 gam kim loại Cu. Giá trị của m là
Câu 35 :
Điện phân 200 ml dung dịch CuCl2 sau một thời gian người ta thu được 1,12 lít khí (đktc) ở anot. Ngâm đinh sắt sạch trong dung dịch còn lại sau khi điện phân, phản ứng xong thấy khối lượng đinh sắt tăng 1,2 gam. Nồng độ mol ban đầu của dung dịch CuCl2 là
Câu 36 :
Cho 19,2 g Cu vào dung dịch loãng chứa 0,4 mol HNO3, phản ứng xảy ra hoàn toàn thì thể tích khí NO (đktc) thu được là
Câu 37 :
Chia 4 g hỗn hợp bột kim loại gồm Al, Fe, Cu thành hai phần đều nhau: - Cho phần (1) tác dụng với lượng dư dung dịch HCl, thu được 560 ml H2. - Cho phần (2) tác dụng với lượng dư dung dịch NaOH, thu được 336 ml H2. Các thể tích khí đo ở đktc. Phần trăm khối lượng của Cu có trong hỗn hợp là
Câu 38 :
Cho 1,52 gam hỗn hợp Fe và Cu vào 200 ml dung dịch HNO3 sau khi phản ứng xảy ra hoàn toàn thu được dung dịch A và 224 ml khí NO duy nhất (đktc) đồng thời còn lại 0,64 gam chất rắn. Nồng độ mol của dung dịch HNO3 đã dùng ban đầu là
Câu 39 :
Hoà tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ) thu được dung dịch X (chỉ chứa 2 muối sunfat) và khí duy nhất NO. Giá trị của a là
Câu 40 :
Cho 19,2 g Cu tác dụng hết với dung dịch HNO3 loãng, dư. Khí NO thu được đem oxi hoá thành NO2 rồi sục vào nước cùng với dòng khí O2 để chuyển hết thành HNO3. Thể tích khí O2 (đktc) đã tham gia vào quá trình trên là
Câu 41 :
Cho hỗn hợp gồm 0,1 mol Ag2O và 0,2 mol Cu tác dụng hết với dung dịch HNO3 loãng, dư. Cô cạn dung dịch thu được sau phản ứng được hỗn hợp muối khan A. Nung A đến khối lượng không đổi thu được chất rắn B có khối lượng là
Câu 42 :
Cho V lít khí H2 (đktc) đi qua bột CuO (dư) đun nóng, thu được 32 g Cu. Nếu cho V lít H2 (đktc) đi qua bột FeO (dư) đun nóng thì khối lượng Fe thu được (giả sử hiệu suất của các phản ứng là 100%) là
Câu 43 :
Hoà tan hoàn toàn 9,6 gam Cu bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
Câu 44 :
Khử hết m gam CuO bằng H2 dư, thu được chất rắn X. Cho X tan hết trong dung dịch HNO3 dư thu được 2,24 lít khí NO (sản phẩm khử duy nhất của N+5). Giá trị của m là:
Câu 45 :
Cho 42,4 g hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3:1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn không tan. Giá trị của m là
Câu 46 :
Cho 42,4 g hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3:1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn không tan. Giá trị của m là
Câu 47 :
Hòa tan hoàn toàn 7,6 gam chất rắn X gồm Cu, Cu2S và S bằng dung dịch HNO3 dư thấy thoát ra 5,04 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào dung dịch Y được m gam kết tủa. Giá trị của m là
Câu 48 :
Cho 1,68 gam bột sắt và 0,36 gam Mg tác dụng với 375 ml dung dịch CuSO4 khuấy nhẹ cho đến khi dung dịch mất màu xanh, thấy khối lượng kim loại thu được sau phản ứng là 2,82 gam. Nồng độ mol/l của CuSO4 trong dung dịch trước phản ứng là
Câu 49 :
Cho hỗn hợp bột hai kim loại Mg, Cu vào cốc đựng dung dịch HCl (vừa đủ) thu được chất khí X, dung dịch chứa muối Y và chất rắn không tan Z. Các chất X, Y, Z lần lượt là
Câu 50 :
Chia 1,6 lít dung dịch Cu(NO3)2 và HCl làm 2 phần bằng nhau. - Phần 1: Điện phân với điện cực trơ với I = 2,5A sau thời gian t giây thu được 0,14 mol một khí duy nhất ở anot. Dung dịch sau điện phân phản ứng vừa đủ với 550 ml dung dịch NaOH 0,8M được 1,96g kết tủa. - Cho m gam bột Fe vào phần 2 đến khi phản ứng xảy ra hoàn toàn thu được 0,7m gam hỗn hợp kim loại và V lít khí NO (sản phẩm khử duy nhất ở đktc) Giá trị của m và V lần lượt là:
Câu 51 :
Hòa tan hoàn toàn 12,9 gam hỗn hợp Cu, Zn bằng dung dịch H2SO4 đặc, nóng thu được sản phẩm khử là 3,136 lít SO2 (đktc) và 0,64 gam lưu huỳnh. Phần trăm khối lượng của Cu trong hỗn hợp ban đầu là
Câu 52 :
Đun nóng m gam hỗn hợp Cu và Fe với tỉ lệ khối lượng tương ứng là 7 : 3 với một lượng dung dịch HNO3. Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít (đktc) hỗn hợp sản phẩm khử gồm NO và NO2. Biết lưỡng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là
Câu 53 :
Hòa tan hoàn toàn 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Cu(NO3)2 và Fe(NO3)3 trong X lần lượt là:
Lời giải và đáp án
Câu 1 :
Trong các hợp chất, đồng có số oxi hóa +1, +2. Biết Cu có Z = 29, cấu hình electron của các ion Cu+ và Cu2+ lần lượt là
Đáp án : C Lời giải chi tiết :
Cấu hình e của Cu (Z = 29) : 1s22s22p63s23p63d104s1 → Cấu hình e của Cu+ : 1s22s22p63s23p63d10 Cấu hình e của Cu2+ : 1s22s22p63s23p63d9
Câu 2 :
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng ?
Đáp án : D Lời giải chi tiết :
Kim loại không tác dụng với dung dịch H2SO4 loãng là Cu
Câu 3 :
Để nhận biết ba axit đặc nguội HCl, H2SO4, HNO3 đựng riêng biệt trong ba lọ bị mất nhãn, ta dùng thuốc thử
Đáp án : D Lời giải chi tiết :
A, C sai vì Fe và Al bị thụ động hóa trong H2SO4 đặc nguội và HNO3 đặc nguội. B sai vì CuO tác dụng với 3 axit đều tạo dung dịch màu xanh và không có khí thoát ra D đúng vì Cu + HCl → không phản ứng Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O Khí mùi hắc Cu + 4HNO3 → Cu(NO3)2 + 2NO2↑ + 2H2O Khí màu nâu
Câu 4 :
Cho Cu lần lượt tác dụng hết với mỗi chất oxi hóa dưới đây có cùng số mol. Trường hợp nào thu được số mol Cu(II) nhỏ nhất ?
Đáp án : A Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
PTHH : Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O 0,25 ← 1 → 0,25 2Cu + O2 $\xrightarrow{{{t}^{o}}}$ 2CuO 1 → 2 Cu + Cl2 $\xrightarrow{{{t}^{o}}}$ CuCl2 1 → 1 Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O 1 → 0,5
Câu 5 :
Cu bị hòa tan trong nước cường toan (tỉ lệ mol của HCl và HNO3 là 3 : 1) và giải phóng khí NO. Tổng hệ số cân bằng (khi tối giản) là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Phương trình hóa học : 3Cu + 6HCl + 2HNO3 → 3CuCl2 + 2NO + 4H2O → tổng hệ số cân bằng : 3 + 6 + 2 + 3 + 2 + 4 = 20
Câu 6 :
Cho các dung dịch loãng : (1) FeCl3, (2) FeCl2, (3) H2SO4, (4) HNO3, (5) hỗn hợp gồm HCl và NaNO3. Những dung dịch phản ứng được với Cu là
Đáp án : D Lời giải chi tiết :
Những dung dịch phản ứng được với Cu là (1) FeCl3; (4) HNO3; (5) hỗn hợp HCl và NaNO3
Câu 7 :
Để khử ion trong dung dịch CuSO4 có thể dùng kim loại nào sau đây ?
Đáp án : A Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Để khử ion trong dung dịch CuSO4 có thể dùng kim loại Fe Vì Na, Ba khi tan vào nước tạo kết tủa với CuSO4 Ag không khử được ion Cu2+
Câu 8 :
Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sunfuric loãng đun nóng là vì
Đáp án : D Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sunfuric loãng đun nóng là vì phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Câu 9 :
Cho các phản ứng chuyển hóa quặng thành Cu: CuFeS2 + O2 $\xrightarrow{{{t}^{o}}}$ X X + O2 $\xrightarrow{{{t}^{o}}}$Y Y + X $\xrightarrow{{{t}^{o}}}$ Cu Hai chất X và Y lần lượt là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Ta có: 2Cu2O + Cu2S → 6Cu + SO2 => X là Cu2S; Y là Cu2O
Câu 10 :
Có thể phát hiện ra dấu vết của nước trong ancol etylic bằng cách dùng
Đáp án : B Lời giải chi tiết :
Có thể phát hiện ra dấu vết của nước trong ancol etylic bằng cách dùng CuSO4 khan vì CuSO4 + nH2O → CuSO4.nH2O Trắng xanh
Câu 11 :
Trong không khí ẩm, kim loại đồng bị bao phủ bởi lớp màng
Đáp án : D Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Trong không khí ẩm, kim loại đồng bị bao phủ bởi lớp màng CuCO3.Cu(OH)2 (màu xanh).
Câu 12 :
Thêm NH3 đến dư vào dung dịch hỗn hợp chứa MgCl2, AlCl3, FeCl3 và CuCl2 thu được kết tủa X. Cho X vào dung dịch NaOH dư, còn lại chất rắn không tan Z. Chất rắn Z là
Đáp án : D Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
$\left\{ \begin{gathered}MgC{l_2} \hfill \\AlC{l_3} \hfill \\FeC{l_3} \hfill \\CuC{l_2} \hfill \\ \end{gathered} \right.\xrightarrow{{N{H_3}}}\left\{ \begin{gathered}Mg{(OH)_2} \hfill \\Al{(OH)_3} \hfill \\Fe{(OH)_3} \hfill \\Cu{(OH)_2} \hfill \\ \end{gathered} \right.\xrightarrow{{N{H_3}}}\left\{ \begin{gathered}Mg{(OH)_2} \hfill \\Al{(OH)_3} \hfill \\Fe{(OH)_3} \hfill \\ \end{gathered} \right.\xrightarrow{{NaOH}}\left\{ \begin{gathered}Mg{(OH)_2} \hfill \\Fe{(OH)_3} \hfill \\ \end{gathered} \right.$
Câu 13 :
Cho các chất sau: CuO, Cu2O, CuSO4, Cu(NO3)2, [Cu(NH3)4](OH)2, Cu. Số chất có thể điều chế trực tiếp từ Cu(OH)2 là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Các chất có thể điều chế trực tiếp từ Cu(OH)2 là CuO, Cu2O, CuSO4, Cu(NO3)2, [Cu(NH3)4](OH)2
Câu 14 :
Cho các hợp chất: CuS, CuO, Cu2O, CuCO3, Cu2S lần lượt phản ứng với dung dịch H2SO4 đặc, nóng, dư. Số phản ứng oxi hóa khử xảy ra là
Đáp án : D Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Các chất tác dụng với H2SO4 đặc nóng xảy ra phản ứng oxi hóa khử là: CuS, Cu2O, Cu2S.
Câu 15 :
Cho các dung dịch: HCl, NaOH, NH3, KCl. Số dung dịch phản ứng được với Cu(OH)2 là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Các dung dịch phản ứng được với Cu(OH)2 là HCl, NH3
Câu 16 :
Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung ở nhiệt độ cao. Sau phản ứng hỗn hợp chất rắn còn lại là
Đáp án : A Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
$\left\{ \begin{gathered}CuO{\text{ }} \hfill \\F{e_2}{O_3} \hfill \\ZnO \hfill \\MgO \hfill \\ \end{gathered} \right.\xrightarrow{{ + {H_2}}}\left\{ \begin{gathered}Cu \hfill \\Fe \hfill \\Zn \hfill \\MgO \hfill \\ \end{gathered} \right.$
Câu 17 :
Một mẫu nước thải được sục vào dung dịch CuSO4 thấy xuất hiện kết tủa màu đen. Hiện tượng này do chất nào có trong khí thải sinh ra ?
Đáp án : C Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Kết tủa đen đó là CuS => trong khí thải chứa H2S
Câu 18 :
Chọn câu đúng trong các câu sau :
Đáp án : C Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
A sai vì Cu yếu hơn Al nên không đẩy được Al ra khỏi dung dịch. B sai vì NH3 tác dụng được với CuSO4 khi có nước. 2NH3 + 2H2O + CuSO4 → Cu(OH)2 + (NH4)2SO4 C đúng vì CuSO4 không tác dụng với dầu hỏa, xăng. D sai vì Cu yếu hơn Fe nên không đẩy được Fe ra khỏi dung dịch.
Câu 19 :
Hỗn hợp rắn X gồm Al, Fe2O3, Cu có số mol bằng nhau. Hỗn hợp X có thể tan hoàn toàn trong dung dịch
Đáp án : B Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Giả sử mỗi chất trong X có 1 mol A sai vì NaOH chỉ hòa tan Al 2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2 B đúng vì Cu tan vừa đủ trong dung dịch FeCl3 2Al + 6HCl → 2AlCl3 + 3H2 Fe2O3 + 6HCl → 2FeCl3 + 3H2O 1 → 2 Cu + 2FeCl3 → 2FeCl2 + CuCl2 1 → 2 C sai vì không hòa tan được Fe2O3. D sai vì NH3 không hòa tan được cả 3 chất rắn.
Câu 20 :
Cho PTHH : aCuFeS2 + bHNO3 → cCu(NO3)2 + dFe(NO3)3 + eH2SO4 + fNO2 + gH2O Giá trị của b là
Đáp án : C Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
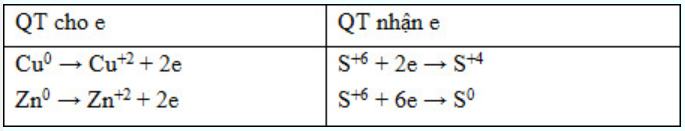
Quá trình cho nhận e : \(\begin{array}{l}CuFe{S_2} \to C{u^{2 + }} + F{e^{3 + }} + 2\mathop S\limits^{ + 6} + 17e\\\mathop N\limits^{ + 5} + 1e \to \mathop N\limits^{ + 4} \end{array}\) Ta có cân bằng : CuFeS2 + 22HNO3 $\xrightarrow{{}}$ Cu(NO3)2 + Fe(NO3)3 + 2H2SO4 + 17NO2 + 9H2O → b = 22
Câu 21 :
Cho hỗn hợp X gồm Cu, Ag, Fe, Al tác dụng với oxi dư khi đun nóng thu được chất rắn Y. Cho Y vào dung dịch HCl dư, khuấy kĩ sau đó lấy sản phẩm thu được cho tác dụng với dung dịch NaOH loãng dư. Lọc lấy kết tủa tạo thành đem nung trong không khí đến khối lượng không đổi thu được chất rắn Z. Biết các phản ứng xảy ra hoàn toàn. Thành phần của Z gồm
Đáp án : C Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
$hhX\left\{ \begin{gathered}Cu \hfill \\Ag \hfill \\Fe \hfill \\Al \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + {O_2},{t^o}}}Y\left\{ \begin{gathered}CuO \hfill \\Ag \hfill \\F{e_3}{O_4} \hfill \\A{l_2}{O_3} \hfill \\ \end{gathered} \right.\xrightarrow{{ + HCl}}\left\{ \begin{gathered}CuC{l_2} \hfill \\Ag \hfill \\FeC{l_2},\,\,FeC{l_3} \hfill \\AlC{l_3} \hfill \\ \end{gathered} \right.\xrightarrow{{ + NaOH}}\left\{ \begin{gathered}\downarrow \left\{ \begin{gathered}Cu{(OH)_2} \hfill \\Ag \hfill \\Fe{(OH)_2},Fe{(OH)_3} \hfill \\ \end{gathered} \right.\xrightarrow{{ + {O_2},{t^o}}}\left\{ \begin{gathered}CuO \hfill \\Ag \hfill \\F{e_2}{O_3} \hfill \\ \end{gathered} \right. \hfill \\NaAl{O_2} \hfill \\ \end{gathered} \right.$
Câu 22 :
Cho sơ đồ sau : Cu → X1 → X2 → X3 → X4 → Cu. Dãy chất nào sau đây không thể tương ứng với X1, X2, X3, X4 ?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết đồng và hợp chất của đồng Lời giải chi tiết :
Dãy chất không thể tương ứng là CuS, CuCl2, Cu(OH)2, CuO vì từ CuS không thể điều chế CuCl2 bằng 1 phản ứng
Câu 23 :
Cho 7,68 gam Cu vào 200 ml dung dịch X gồm HNO3 0,6M và H2SO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn (sản phẩm khử duy nhất là NO), cô cạn cẩn thận toàn bộ dung dịch sau phản ứng thì khối lượng muối khan thu được là
Đáp án : A Phương pháp giải :
$3Cu\,\,\,\,+\,\,\,\,8{{H}^{+}}\,\,\,+\,\,\,2NO_{3}^{-}\,\,\to\,\,\,\,3C{{u}^{2+}}\,\,\,+\,\,\,2NO\,\,+\,\,4{{H}_{2}}O$ 0,12 → 0,32 → 0,08 → 0,12 => sau phản ứng dung dịch thu được gồm Cu2+ (0,12 mol); NO3- (0,04 mol); SO42- (0,1 mol) Lời giải chi tiết :
nCu = 0,12 mol; nHNO3 = 0,12 mol; nH2SO4 = 0,1 mol => nH+ = 0,32 $3Cu\,\,\,\,+\,\,\,\,8{{H}^{+}}\,\,\,+\,\,\,2NO_{3}^{-}\,\,\to \,\,\,\,3C{{u}^{2+}}\,\,\,+\,\,\,2NO\,\,+\,\,4{{H}_{2}}O$ 0,12 → 0,32 → 0,08 → 0,12 => sau phản ứng dung dịch thu được gồm Cu2+ (0,12 mol); NO3- (0,04 mol); SO42- (0,1 mol) => mmuối = 0,12.64 + 0,04.62 + 0,1.96 = 19,76 gam
Câu 24 :
Nung 6,58 gam Cu(NO3)2 trong bình kín không có không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
Đáp án : C Lời giải chi tiết :
nCu(NO3)2 ban đầu = 0,035 mol. Gọi nCu(NO3)2 phản ứng = a mol 2Cu(NO3)2 → 2CuO + 4NO2 + O2 a → a → 2a → 0,5a Khối lượng chất rắn giảm = khối lượng khí bay đi => mNO2 + mO2 = 2a.46 + 0,5a.32 = 6,58 – 4,96 => a = 0,015 mol Hấp thụ X vào nước : 4NO2 + O2 + 2H2O → 4HNO3 0,03 → 0,0075 → 0,03 $=>\,\,\text{ }\!\![\!\!\text{ }{{H}^{+}}\text{ }\!\!]\!\!\text{ }=\frac{0,03}{0,3}=0,1\,\,M$=> pH = 1
Câu 25 :
Nhiệt phân hoàn toàn 34,65 gam hỗn hợp gồm KNO3 và Cu(NO3)2, thu được hỗn hợp khí X có tỉ khối so với khí hiđro bằng 18,8. Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Đáp án : A Phương pháp giải :
$\left\{\begin{gathered}101{\text{x}}+188y=34,65 \hfill \\\frac{{(0,5{\text{x}} + 0,5y).32 + 2y.46}}{{0,5{\text{x}} + 0,5y + 2y}} = 18,8.2 \hfill \\ \end{gathered} \right.$ Lời giải chi tiết :
2KNO3 → 2KNO2 + O2 x → 0,5x 2Cu(NO3)2 → 2CuO + 4NO2 + O2 y → 2y → 0,5y Ta có hệ phương trình: $\left\{ \begin{gathered} 101{\text{x}} + 188y = 34,65 \hfill \\ \frac{{(0,5{\text{x}} + 0,5y).32 + 2y.46}}{{0,5{\text{x}} + 0,5y + 2y}} = 18,8.2 \hfill \\ \end{gathered} \right. = > \left\{ \begin{gathered} x = 0,25 \hfill \\ y = 0,05 \hfill \\ \end{gathered} \right.$ => mCu(NO3)2 = 0,05.188 = 9,4 gam Chú ý
lấy nhầm số mol KNO3 => chọn nhầm D
Câu 26 :
Cho 19,2 gam Cu vào 500 ml dung dịch NaNO3 1M, sau đó thêm vào 500 ml dung dịch HCl 2M. Kết thúc phản ứng thu được dung dịch X và khí NO duy nhất. Phải thêm bao nhiêu ml dung dịch NaOH 1M vào X để vừa đủ kết tủa hết ion Cu2+ ?
Đáp án : B Phương pháp giải :
$3Cu\,\,\,\,+\,\,\,\,8{{H}^{+}}\,\,\,+\,\,\,2NO_{3}^{-}\,\,\to \,\,\,\,3C{{u}^{2+}}\,\,\,+\,\,\,2NO\,\,+\,\,4{{H}_{2}}O$ 0,3 → 0,8 → 0,2 → 0,3 +) nNaOH = nH+ dư + 2.nCu2+ Lời giải chi tiết :
nCu = 0,3 mol; nNaNO3 = 0,5 mol; nHCl = 1 mol $3Cu\,\,\,\,+\,\,\,\,8{{H}^{+}}\,\,\,+\,\,\,2NO_{3}^{-}\,\,\to \,\,\,\,3C{{u}^{2+}}\,\,\,+\,\,\,2NO\,\,+\,\,4{{H}_{2}}O$ 0,3 → 0,8 → 0,2 → 0,3 Để kết tủa hết ion Cu2+ thì nNaOH = nH+ dư + 2.nCu2+ = 0,2 + 0,3.2 = 0,8 mol => VNaOH = 0,8 lít = 800 ml Chú ý
Quên tính số mol NaOH để trung hòa hết H+ dư => chọn nhầm A
Câu 27 :
Thực hiện hai thí nghiệm: TN 1: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch HNO3 1M thoát ra V1 lít NO. TN 2: Cho 3,84 gam Cu phản ứng với 80 ml dung dịch chứa HNO3 1M và H2SO4 0,5 M. thoát ra V2 lít NO. Biết NO là sản phẩm khử duy nhất, các thể tích khí đo ở cùng điều kiện. Quan hệ giữa V1 và V2 là
Đáp án : B Phương pháp giải :
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O 0,03 ← 0,08 → 0,02 $3Cu\,\,\,\,+\,\,\,\,8{{H}^{+}}\,\,\,+\,\,\,2NO_{3}^{-}\,\,\to \,\,\,\,3C{{u}^{2+}}\,\,\,+\,\,\,2NO\,\,+\,\,4{{H}_{2}}O$ 0,06 → 0,16 → 0,04 → 0,04 +) nNO (TN2) = 2.nNO (TN1) => V2 = 2V1 Lời giải chi tiết :
TN1: nCu = 0,06 mol; nHNO3 = 0,08 mol 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O 0,03 ← 0,08 → 0,02 TN2: nCu = 0,06; nH+ = 1,08 mol; nNO3- = 0,08 $3Cu\,\,\,\,+\,\,\,\,8{{H}^{+}}\,\,\,+\,\,\,2NO_{3}^{-}\,\,\to \,\,\,\,3C{{u}^{2+}}\,\,\,+\,\,\,2NO\,\,+\,\,4{{H}_{2}}O$ 0,06 → 0,16 → 0,04 → 0,04 => nNO (TN2) = 2.nNO (TN1) => V2 = 2V1
Câu 28 :
Hòa tan hoàn toàn 1,23 gam hỗn hợp X gồm Cu và Al vào dung dịch HNO3 đặc, nóng, dư thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Sục từ từ khí NH3 đến dư vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Phần trăm về khối lượng của Cu trong hỗn hợp X và giá trị của m lần lượt là
Đáp án : D Phương pháp giải :
+) Lập hệ pt liên quan đến khối lượng hỗn hợp X và bảo toàn e: 2.nCu + 3.nAl = nNO2 +) Sục khí NH3 đến dư vào Y chỉ thu được kết tủa Al(OH)3 (vì Cu(OH)2 tan trong NH3 dư tạo phức) Lời giải chi tiết :
Gọi nCu = x mol; nAl = y mol => mhỗn hợp = 64x + 27y = 1,23 (1) Bảo toàn e: 2.nCu + 3.nAl = nNO2 => 2x + 3y = 0,06 (2) Từ (1) và (2) => x = 0,015; y = 0,01 => %mCu = 78,05% Dung dịch Y chứa Cu2+ và Al3+ Sục khí NH3 đến dư vào Y chỉ thu được kết tủa Al(OH)3 (vì Cu(OH)2 tan trong NH3 dư tạo phức) => m = 0,01.78 = 0,78 gam
Câu 29 :
Đốt cháy m gam CuS trong khí oxi dư thu được chất rắn X có khối lượng bằng (m – 4,8) gam. Nung X với khí NH3 dư tới khi khối lượng không đổi được chất rắn Y. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng dư, thu được V lít khí Z (đktc) không màu, hóa nâu trong không khí. Giá trị của m và V là
Đáp án : B Phương pháp giải :
1 mol S đổi thành 1 mol O khối lượng giảm đi = 32 – 16 = 16 gam => 0,3 mol S đổi thành 0,3 mol O khối lượng giảm đi = 4,8 gam +) Bảo toàn e: 2.nCu = 3.nNO Lời giải chi tiết :
2CuS + 3O2 → 2CuO + 2SO2 3CuO + 2NH3 → 3Cu + N2 + 3H2O 1 mol S đổi thành 1 mol O khối lượng giảm đi = 32 – 16 = 16 gam khối lượng giảm đi = 4,8 gam => 0,3 mol S đổi thành 0,3 mol O => nCuS = 0,3 mol => m = 28,8 gam Bảo toàn nguyên tố Cu: nCu = nCuS = 0,3 mol Khí Z là NO Bảo toàn e: 2.nCu = 3.nNO => nNO = 2/3.nCu = 0,2 mol => V = 0,2.22,4 = 4,48 lít
Câu 30 :
Cho 8 gam bột Cu vào 20 ml dung dịch AgNO3, sau một thời gian thu được dung dịch A và lọc được 9,52 gam chất rắn. Cho tiếp 8 gam bột Pb vào dung dịch A đến khi phản ứng hoàn toàn thu được dung dịch B chỉ chứa một muối duy nhất và tách ra được 6,705 gam chất rắn. Nồng độ mol của AgNO3 ban đầu là
Đáp án : B Phương pháp giải :
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag 1 mol 2 mol tăng: 2.108 - 64 = 152 gam 0,01 mol ← tăng: 1,52 gam +) nAgNO3 dư = 0,02a – 0,02 +) nPb phản ứng = ½.nAgNO3 +) nPb phản ứng = nCu (2) = nCu(NO3)2 +) mchất rắn = mPb (dư) + mAg (1) + mCu (2) = 6,705 gam Lời giải chi tiết :
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag 1 mol 2 mol tăng: 2.108 - 64 = 152 gam 0,01 mol ← tăng: 1,52 gam => nCu(NO3)2 = nCu phản ứng = 0,01 mol => nAgNO3 phản ứng = 2nCu phản ứng = 2.0,01 = 0,02 mol Gọi a M là nồng độ của dung dịch AgNO3 ban đầu, ta có: nAgNO3 dư = 0,02a – 0,02 mol Sau phản ứng với Pb chỉ thu được 1 muối sản phẩm duy nhất chứng tỏ các muối nitrat đã phản ứng hết Pb + 2AgNO3 → 2Ag + Pb(NO3)2 (1) nPb phản ứng = ½.nAgNO3 = 0,01.(a - 1) mol nAg (1) = nAgNO3 = 0,02.(a - 1) mol Pb + Cu(NO3)2 → Pb(NO3)2 + Cu (2) nPb phản ứng = nCu (2) = nCu(NO3)2 = 0,01 mol => mPb (dư) = 8 - 207.[0,01(a - 1) + 0,01] = 8 – 2,07a (g) mchất rắn = mPb (dư) + mAg (1) + mCu (2) = 6,705 gam => 8 – 2,07a + 108.0,02(a - 1) + 64.0,01 = 6,705 => a = 2,5M
Câu 31 :
Hòa tan hoàn toàn 40 gam hỗn hợp X gồm CuS, FeS, Cu2S trong dung dịch HNO3 đun nóng. Sau phản ứng thu được hỗn hợp khí gồm SO2 và NO2 có tổng khối lượng là 153,04 gam và dung dịch Y chỉ chứa 90 gam các muối trung hòa. Cho Y tác dụng với dung dịch BaCl2 dư thấy tách ra 60,58 gam kết tủa. Hiệu số mol NO2 và SO2 gần nhất với giá trị nào sau đây
Đáp án : B Phương pháp giải :
Quy đổi X thành Fe (a mol), Cu (b mol), S (c mol) mX = 56a + 64b + 32c = 40 (1) Muối trong Y gồm có Fe3+ (a mol), Cu2+ (b mol), SO42- (0,26 mol) và NO3- +) Bảo toàn điện tích : $2.{{n}_{SO_{4}^{2-}}}+{{n}_{NO_{3}^{-}}}=3.{{n}_{F{{e}^{3+}}}}+\text{ }2.{{n}_{C{{u}^{2+}}}}$ +) mmuối = mFe3+ + mCu2+ + mSO4 + mNO3 +) Bảo toàn S : nSO2 = c – 0,26 +) Bảo toàn electron : nNO2 = n e cho = 3.nfe + 2.nCu + 4.nSO2 + 6.nSO4 → mkhí = mSO2 + mNO2 Lời giải chi tiết :
Quy đổi X thành Fe (a mol), Cu (b mol), S (c mol) mX = 56a + 64b + 32c = 40 (1) Muối trong Y gồm có Fe3+ (a mol), Cu2+ (b mol), SO42- (0,26 mol) và NO3- Bảo toàn điện tích : $2.{{n}_{SO_{4}^{2-}}}+{{n}_{NO_{3}^{-}}}=3.{{n}_{F{{e}^{3+}}}}+\text{ }2.{{n}_{C{{u}^{2+}}}}$ => nNO3- 3a + 2b – 0,52 mmuối = 56a + 64b + 0,26.96 + 62.(3a + 2b – 0,52) = 90 (2) Bảo toàn S : nSO2 = c – 0,26 Bảo toàn electron : nNO2 = 3a + 2b + 4.(c – 0,26) + 6.0,26 = 3a + 2b + 4c + 0,52 → mkhí = 64.(c – 0,26) + 46.(3a + 2b + 4c + 0,52) = 153,04 (3) Từ (1), (2), (3) → a = 0,2; b = 0,26; c = 0,38 → nSO2 = c – 0,26 = 0,12 nNO2 = 3a + 2b + 4c + 0,52 = 3,16 → nNO2 – nSO2 = 3,04
Câu 32 :
Cho dung dịch KOH vào dung dịch chất X, thu được kết tủa màu xanh lam. Chất X là
Đáp án : A Phương pháp giải :
Dựa vào màu sắc kết tủa của các hiđroxit Lời giải chi tiết :
2KOH + CuCl2 → KCl + Cu(OH)2↓xanh lam 2KOH + FeCl2 → KCl + Fe(OH)2↓ trắng xanh 2KOH + MgCl2 → KCl + Mg(OH)2↓trắng 3KOH + FeCl3 → KCl + Fe(OH)3↓ nâu đỏ
Câu 33 :
Dung dịch nào dưới đây không hòa tan được Cu kim loại?
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của Cu. Lời giải chi tiết :
Dung dịch NaHSO4 không hòa tan được Cu kim loại. PTHH xảy ra: Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2 3Cu + 8NaNO3 + 8HCl → 3Cu(NO3)2 + 2NO + 8NaCl + 4H2O 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O Đáp án C
Câu 34 :
Cho m gam bột Zn tác dụng hoàn toàn với dung dịch CuSO4 dư, thu được 9,6 gam kim loại Cu. Giá trị của m là
Đáp án : C Phương pháp giải :
Tính toán theo PTHH: Zn + CuSO4 → ZnSO4 + Cu Lời giải chi tiết :
PTHH: Zn + CuSO4 → ZnSO4 + Cu \( \to {n_{Zn}} = {n_{Cu}} = 0,15{\rm{ }}mol \to {m_{Zn}} = 0,15.65 = 9,75g\)
Câu 35 :
Điện phân 200 ml dung dịch CuCl2 sau một thời gian người ta thu được 1,12 lít khí (đktc) ở anot. Ngâm đinh sắt sạch trong dung dịch còn lại sau khi điện phân, phản ứng xong thấy khối lượng đinh sắt tăng 1,2 gam. Nồng độ mol ban đầu của dung dịch CuCl2 là
Đáp án : C Phương pháp giải :
Từ số mol khí Cl2 tính được số mol CuCl2 tham gia phản ứng điện phân Áp dụng tăng giảm khối lượng tính được số mol CuCl2 tham gia phản ứng với đinh sắt Từ đó tính được số mol và nồng độ dung dịch CuCl2 ban đầu Lời giải chi tiết :
Ta có: \({n_{C{l_2}}} = \frac{{1,12}}{{22,4}} = 0,05 (mol)\) Vì sau phản ứng đem ngâm đinh sắt sạch trong dung dịch thấy khối lượng đinh sắt tăng lên nên dung dịch sau điện phân có chứa CuCl2 → CuCl2 chưa điện phân hết - Phản ứng điện phân dung dịch: CuCl2 \(\xrightarrow{{dpdd}}\) Cu + Cl2 → nCu (đp) = nCl2 = 0,05 mol - Nhúng thanh Fe vào dd sau điện phân: Gọi số mol CuCl2 còn dư sau điện phân là x (mol) CuCl2 + Fe → Cu + FeCl2 x → x → x (mol) Ta có: ∆m = mCu - mFe pư ⟹ 64x - 56x = 1,2 ⟹ x = 0,15 Vậy: nCu (ban đầu) = 0,05 + 0,15 = 0,2 (mol) \( \to {C_{M CuC{l_2}}} = \frac{{0,2}}{{0,2}} = 1(M)\)
Câu 36 :
Cho 19,2 g Cu vào dung dịch loãng chứa 0,4 mol HNO3, phản ứng xảy ra hoàn toàn thì thể tích khí NO (đktc) thu được là
Đáp án : B Phương pháp giải :
Dựa vào số mol ban đầu của Cu, HNO3 và hệ số PTHH suy ra chất dư và chất hết Tính số mol NO theo chất hết, từ đó tính được thể tích khí Lời giải chi tiết :
\({n_{Cu}} = 0,3 mol; {n_{HN{O_3}}} = 0,4 mol{\rm{ }}\) PTHH: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O Ban đầu: 0,3 0,4 (ta thấy: \(\frac{{0,3}}{3} > \frac{{0,4}}{8}\) → HNO3 là chất hết) Pư: 0,15 ← 0,4 → 0,1 (mol) ⟹ VNO = 0,1.22,4 = 2,24 lít
Câu 37 :
Chia 4 g hỗn hợp bột kim loại gồm Al, Fe, Cu thành hai phần đều nhau: - Cho phần (1) tác dụng với lượng dư dung dịch HCl, thu được 560 ml H2. - Cho phần (2) tác dụng với lượng dư dung dịch NaOH, thu được 336 ml H2. Các thể tích khí đo ở đktc. Phần trăm khối lượng của Cu có trong hỗn hợp là
Đáp án : D Phương pháp giải :
Viết PTHH cho phản ứng trong mỗi phần Trong phản ứng với dung dịch NaOH tìm được số mol Al Trong phản ứng với dung dịch HCl tìm được số mol Fe Tính được khối lượng và phần trăm của Cu Lời giải chi tiết :
Chia đôi hỗn hợp nên khối lượng mỗi phần là 2 gam. Phần 1: (1) 2Al + 6HCl → 2AlCl3 + 3H2 (2) Fe + 2HCl → FeCl2 + H2 Phần 2: (3) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 Từ pt (3): \({n_{Al}} = \frac{2}{3}{n_{{H_2}}} = \frac{2}{3}.\frac{{0,336}}{{22,4}} = 0,01\left( {mol} \right) \to {m_{Al}} = 0,27g\) Theo (1), (2) và (3) ta có: \({V_{{H_2}\left( 2 \right)}} = 560 - 336 = 224\left( {ml} \right)\) Theo (2) ta có: \({n_{Fe}} = {n_{{H_2}}} = \frac{{0,224}}{{22,4}} = 0,01\left( {mol} \right) \to {m_{Fe}} = 0,56\left( g \right)\) → mCu = mhỗn hợp - (mAl + mFe) = 2 - 0,27 - 0,56 = 1,17 (g) \( \to \% {m_{Cu}} = \frac{{1,17}}{2}.100\% = 58,5\% \)
Câu 38 :
Cho 1,52 gam hỗn hợp Fe và Cu vào 200 ml dung dịch HNO3 sau khi phản ứng xảy ra hoàn toàn thu được dung dịch A và 224 ml khí NO duy nhất (đktc) đồng thời còn lại 0,64 gam chất rắn. Nồng độ mol của dung dịch HNO3 đã dùng ban đầu là
Đáp án : C Phương pháp giải :
Viết phương trình bán phản ứng của HNO3, tính số mol HNO3 theo NO, từ đó tìm được nồng độ mol của dung dịch HNO3 đã dùng Lời giải chi tiết :
Do kim loại còn dư sau phản ứng nên HNO3 phản ứng hết. Ta có bán phản ứng sau: 4H+ + NO3- + 3e → NO + 2H2O \( \to {n_{{H^ + }}} = 4{n_{NO}} = 4.\frac{{0,224}}{{22,4}} = 0,04\left( {mol} \right)\) \( \to {n_{HN{O_3}}} = 0,04{\kern 1pt} mol \to {C_{M\left( {HN{O_3}} \right)}} = \frac{{0,04}}{{0,2}} = 0,2\left( M \right)\)
Câu 39 :
Hoà tan hoàn toàn hỗn hợp gồm 0,12 mol FeS2 và a mol Cu2S vào axit HNO3 (vừa đủ) thu được dung dịch X (chỉ chứa 2 muối sunfat) và khí duy nhất NO. Giá trị của a là
Đáp án : D Phương pháp giải :
Bảo toàn nguyên tố. Lời giải chi tiết :
Ta có sơ đồ phản ứng: {FeS2, Cu2S} + HNO3 → Fe2(SO4)3 + CuSO4 + NO + H2O Bảo toàn nguyên tố Fe ta có: \({n_{F{{\rm{e}}_2}{{\left( {S{O_4}} \right)}_3}}} = \frac{1}{2}{n_{F{\rm{e}}{{\rm{S}}_2}}} = \frac{1}{2}.0,12 = 0,06\left( {mol} \right)\) Bảo toàn nguyên tố Cu ta có: \({n_{CuS{O_4}}} = 2{n_{C{u_2}S}} = 2{\rm{a}}\left( {mol} \right)\) Bảo toàn nguyên tố S có: \({n_{S\left( {F{\rm{e}}{{\rm{S}}_2},C{u_2}S} \right)}} = {n_{S\left( {muoi\,sunf{\rm{a}}t} \right)}}\) \( \to 2{n_{F{\rm{e}}{{\rm{S}}_2}}} + {n_{C{u_2}S}} = 3{n_{F{{\rm{e}}_2}{{\left( {S{O_4}} \right)}_3}}} + {n_{CuS{O_4}}}\) → 2.0,12 + a = 3.0,06 + 2a → a = 0,06 mol
Câu 40 :
Cho 19,2 g Cu tác dụng hết với dung dịch HNO3 loãng, dư. Khí NO thu được đem oxi hoá thành NO2 rồi sục vào nước cùng với dòng khí O2 để chuyển hết thành HNO3. Thể tích khí O2 (đktc) đã tham gia vào quá trình trên là
Đáp án : B Phương pháp giải :
Theo cách thông thường: Viết phương trình phản ứng và tính số mol O2 theo phương trình phản ứng Theo bảo toàn electron: trong quá trình chỉ có Cu và O2 thay đổi số oxi hóa, tính số mol O2 theo bảo toàn electron Lời giải chi tiết :
Ta có: \({n_{Cu}} = \frac{{19,2}}{{64}} = 0,3\left( {mol} \right)\) - Phương pháp thông thường: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O 0,3 → 0,2 (mol) 2NO + O2 → 2NO2 0,2 → 0,1 → 0,2 (mol) 4NO2 + O2 + 2H2O → 4HNO3 0,2 → 0,05 (mol) \( \to {n_{{O_2}}} = 0,1 + 0,05 = 0,15\left( {mol} \right)\) \( \to {V_{{O_2}}} = 0,15.22,4 = 3,36\left( l \right)\) - Phương pháp bảo toàn electron: Trong quá trình phản ứng trên thì Cu nhường electron và O2 thu electron. Còn N+5 trong HNO3 chỉ vận chuyển electron nên ta có: Quá trình nhường electron: Cu0 → Cu+2+ 2e 0,3 → 0,6 (mol) Quá trình thu electron: O2 + 4e → 2O-2 x → 4x (mol) Áp dụng bảo toàn e: 4x = 0,6 → x = 0,15 (mol) \( \to {V_{{O_2}}} = 0,15.22,4 = 3,36\left( l \right)\)
Câu 41 :
Cho hỗn hợp gồm 0,1 mol Ag2O và 0,2 mol Cu tác dụng hết với dung dịch HNO3 loãng, dư. Cô cạn dung dịch thu được sau phản ứng được hỗn hợp muối khan A. Nung A đến khối lượng không đổi thu được chất rắn B có khối lượng là
Đáp án : C Phương pháp giải :
- Viết các PTHH - Tính toán theo các PTHH Lời giải chi tiết :
Các PTHH: - Hòa tan hỗn hợp Ag2O, Cu vào dung dịch HNO3 loãng, dư: Ag2O + 2HNO3 → 2AgNO3 + H2O 0,1 → 0,2 (mol) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O 0,2 → 0,2 (mol) → Muối khan A có chứa: AgNO3 (0,2 mol) và Cu(NO3)2 (0,2 mol) - Nung muối A đến khối lượng không đổi: 2AgNO3 \(\xrightarrow{{{t^o}}}\) 2Ag + 2NO2 + O2 0,2 → 0,2 (mol) Cu(NO3)2 \(\xrightarrow{{{t^o}}}\) CuO + NO2 + O2 0,2 → 0,2 (mol) → Chất rắn B thu được gồm Ag (0,2 mol) và CuO (0,2 mol) → mB = 0,2.108 + 0,2.80 = 37,6 (g)
Câu 42 :
Cho V lít khí H2 (đktc) đi qua bột CuO (dư) đun nóng, thu được 32 g Cu. Nếu cho V lít H2 (đktc) đi qua bột FeO (dư) đun nóng thì khối lượng Fe thu được (giả sử hiệu suất của các phản ứng là 100%) là
Đáp án : C Phương pháp giải :
Trong phản ứng với CuO, tìm được số mol H2 Trong phản ứng với FeO, tính được số mol Fe theo số mol H2 Tính khối lượng Fe thu được Lời giải chi tiết :
- Cho H2 qua bột CuO đun nóng: CuO + H2 → Cu + H2O \( \to {n_{{H_2}}} = {n_{Cu}} = \frac{{32}}{{64}} = 0,5\left( {mol} \right)\) - Cho H2 qua bột FeO đun nóng: FeO + H2 → Fe + H2O \( \to {n_{F{\rm{e}}}} = {n_{{H_2}}} = 0,5\left( {mol} \right)\) - Khối lượng Fe thu được là: mFe = 0,5.56 = 28 (g)
Câu 43 :
Hoà tan hoàn toàn 9,6 gam Cu bằng dung dịch HNO3 loãng (dư), sinh ra V lít khí NO (sản phẩm khử duy nhất, ở đktc). Giá trị của V là
Đáp án : D Phương pháp giải :
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O Từ số mol Cu, dựa vào PTHH để tính số mol NO và giá trị của V. Lời giải chi tiết :
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O Theo PTHH ta có: nNO = 2/3.nCu = 2/3.0,15 = 0,1 (mol) Vậy V = VNO = 0,1.22,4 = 2,24 (lít)
Câu 44 :
Khử hết m gam CuO bằng H2 dư, thu được chất rắn X. Cho X tan hết trong dung dịch HNO3 dư thu được 2,24 lít khí NO (sản phẩm khử duy nhất của N+5). Giá trị của m là:
Đáp án : D Phương pháp giải :
Các phương trình hóa học xảy ra: CuO + H2 → Cu + H2O (1) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2) Tính số mol CuO theo 2 phương trình hóa học trên để tính giá trị m. Lời giải chi tiết :
Các phương trình hóa học xảy ra: CuO + H2 → Cu + H2O (1) 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O (2) Theo (2) =>nCu = 3/2.nNO = 3/2 . 0,1 = 0,15 mol Theo (1) => nCuO = nCu = 0,15 mol => mCuO = 0,15.80 = 12 (g)
Câu 45 :
Cho 42,4 g hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3:1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn không tan. Giá trị của m là
Đáp án : C Phương pháp giải :
- Từ khối lượng và tỉ lệ mol ta tính được mol của Cu và Fe3O4 - Viết và tính theo PTHH: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O Cu + 2FeCl3 → CuCl2 + 2FeCl2 Lời giải chi tiết :
Đặt mol của Cu và Fe3O4 lần lượt là 3x và x (mol) → m hỗn hợp = 64.3x + 232.x = 42,4 → x = 0,1 mol PTHH: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O 0,1 → 0,2 (mol) Cu + 2FeCl3 → CuCl2 + 2FeCl2 0,1 ← 0,2 (mol) → nCu dư = 0,3 - 0,1 = 0,2 mol → m chất rắn = mCu dư = 0,2.64 = 12,8 gam
Câu 46 :
Cho 42,4 g hỗn hợp gồm Cu và Fe3O4 (có tỉ lệ số mol tương ứng là 3:1) tác dụng với dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn còn lại m gam chất rắn không tan. Giá trị của m là
Đáp án : C Phương pháp giải :
- Từ khối lượng và tỉ lệ mol ta tính được mol của Cu và Fe3O4 - Viết và tính theo PTHH: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O Cu + 2FeCl3 → CuCl2 + 2FeCl2 Lời giải chi tiết :
Đặt mol của Cu và Fe3O4 lần lượt là 3x và x (mol) → m hỗn hợp = 64.3x + 232.x = 42,4 → x = 0,1 mol PTHH: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O 0,1 → 0,2 (mol) Cu + 2FeCl3 → CuCl2 + 2FeCl2 0,1 ← 0,2 (mol) → nCu dư = 0,3 - 0,1 = 0,2 mol → m chất rắn = mCu dư = 0,2.64 = 12,8 gam
Câu 47 :
Hòa tan hoàn toàn 7,6 gam chất rắn X gồm Cu, Cu2S và S bằng dung dịch HNO3 dư thấy thoát ra 5,04 lít khí NO duy nhất (đktc) và dung dịch Y. Thêm dung dịch Ba(OH)2 dư vào dung dịch Y được m gam kết tủa. Giá trị của m là
Đáp án : A Phương pháp giải :
Quy đổi hh X thành Cu và S Sau đó viết quá trình nhường nhận e, sử dụng bảo toàn e, bảo toàn nguyên tố để giải Lời giải chi tiết :
Tóm tắt: \(7,6\,(g)\,X\left\{ \matrix{ Quy đổi X thành Cu (a) và S (b) → mX = 64a + 32b = 7,6 (I) quá trình nhường e quá trình nhận e Cu → Cu+2 +2e N+5 +3e → N+3 a → 2a (mol) 0,675 ← 0,225 (mol) S0 → S+6 + 6e b → 6b (mol) Bảo toàn electron: 2a + 6b = 0,675 (II) giải hệ (I) và (II) → a = 0,075; b = 0,0875 → nCu = 0,075 (mol) và nS = 0,0875 (mol) BTNT “S”: nBaSO4 = nS = 0,0875 (mol) BTNT “Cu”: nCu(OH)2 = nCu = 0,075 (mol) → m↓ = mBaSO4 + mCu(OH)2 = 0,0875.233 + 0,075.98 = 27,7375 (g)
Câu 48 :
Cho 1,68 gam bột sắt và 0,36 gam Mg tác dụng với 375 ml dung dịch CuSO4 khuấy nhẹ cho đến khi dung dịch mất màu xanh, thấy khối lượng kim loại thu được sau phản ứng là 2,82 gam. Nồng độ mol/l của CuSO4 trong dung dịch trước phản ứng là
Đáp án : C Phương pháp giải :
Cho hh Mg và Fe vào dd CuSO4 phản ứng xảy ra theo thứ tự: Mg + CuSO4 → MgSO4 + Cu↓ (1) Fe + CuSO4 → FeSO4 + Cu↓ (2) - Nếu Mg phản ứng hết: Theo (1) → mKL thu được = 2,64 (g) - Nếu cả Mg và Fe pư hết: Theo (1) và (2): → mKL thu được = 2,88 (g) Theo bài 2,64 (g) < mKL thu được = 2,82 (g) < 2,88 (g) Vậy Mg phản ứng hết, Fe mới phản ứng một phần. Từ đó tính toán theo PTHH Lời giải chi tiết :
nMg = 0,36 : 24 = 0,015 (mol); nFe = 1,68 : 56 = 0,03 (mol) Cho hh Mg và Fe vào dd CuSO4 phản ứng xảy ra theo thứ tự: Mg + CuSO4 → MgSO4 + Cu↓ (1) Fe + CuSO4 → FeSO4 + Cu↓ (2) - Nếu Mg phản ứng hết: Theo (1): nCu = nMg = 0,015 (mol) → mKL thu được = mCu(1) + mFe = 0,015.64 + 1,68 = 2,64 (g) - Nếu cả Mg và Fe pư hết: Theo (1) và (2): ∑ nCu = nMg + nFe = 0,015 + 0,03 = 0,045 (mol) → mKL thu được = mCu = 0,045.64 = 2,88 (g) Theo bài 2,64 (g) < mKL thu được = 2,82 (g) < 2,88 (g) Vậy Mg phản ứng hết, Fe mới phản ứng một phần. Đặt nFe pư = x (mol) Theo PTHH (1): nCu = nMg = 0,015 (mol) Theo PTHH (2): nCu = nFe pư = x (mol) → mKL thu được = mCu(1)+(2) + mFe dư → 64(0,015 + x) + 1,68 – 56x = 2,82 → x = 0,0225 → ∑ nCu = 0,015 + 0,0225 = 0,0375 (mol) BTNT “Cu”: nCuSO4 = nCu = 0,0375 (mol) → CM CuSO4 = nCuSO4 : VCuSO4 = 0,0375 : 0,375 = 0,1 (M)
Câu 49 :
Cho hỗn hợp bột hai kim loại Mg, Cu vào cốc đựng dung dịch HCl (vừa đủ) thu được chất khí X, dung dịch chứa muối Y và chất rắn không tan Z. Các chất X, Y, Z lần lượt là
Đáp án : D Phương pháp giải :
Viết PTHH xảy ra, từ đó xác định được các chất X, Y, Z Lời giải chi tiết :
Mg, Cu cho tác dụng với dd HCl chỉ có Mg pư, Cu không pư → rắn không tan Z là Cu PTHH: Mg + 2HCl → MgCl2 + H2↑ → Khí X là H2; dd Y là MgCl2
Câu 50 :
Chia 1,6 lít dung dịch Cu(NO3)2 và HCl làm 2 phần bằng nhau. - Phần 1: Điện phân với điện cực trơ với I = 2,5A sau thời gian t giây thu được 0,14 mol một khí duy nhất ở anot. Dung dịch sau điện phân phản ứng vừa đủ với 550 ml dung dịch NaOH 0,8M được 1,96g kết tủa. - Cho m gam bột Fe vào phần 2 đến khi phản ứng xảy ra hoàn toàn thu được 0,7m gam hỗn hợp kim loại và V lít khí NO (sản phẩm khử duy nhất ở đktc) Giá trị của m và V lần lượt là:
Đáp án : B Phương pháp giải :
Thứ tự điện phân: Catot: Cu2+ +2e → Cu 2H+ + 2e → H2 2H2O + 2e → 2OH- + H2 Anot: 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e - Phần 1:Dựa vào sản phầm phản ứng với NaOH => chất nào còn dư, quá trình điện phân dừng ở phản ứng nào - Phần 2: Sản phẩm thu được khi cho Fe + dung dịch sau điện phân là hỗn hợp kim loại => Biện luận chất còn dư sau phản ứng => số mol các ion => m, V Lời giải chi tiết :
- Phần 1: Vì dung dịch sau điện phân + NaOH tạo kết tủa => Cu2+dư và khí duy nhất chính là Cl2 nCl2 = 0,14 mol Catot: Cu2+ +2e → Cu Anot: 2Cl- → Cl2 + 2e - Khi + NaOH: OH- + H+ → H2O 2OH- + Cu2+ → Cu(OH)2 nCu2+ dư = nCu(OH)2 = 1,96: 98 = 0,02 mol nH+ dư = nNaOH – 2nCu(OH)2 = 0,55.0,8 – 2.0,02 = 0,4 mol = nHCl (Vì H+ dư nên Cu2+ chưa điện phân hết) Bảo toàn e: ne = 2nCu2+ = 2nCl2 => nCu2+ pứ = nCl2 = 0,14 mol => nCu(NO3)2 = 0,14 + 0,02 = 0,16 mol - Phần 2: Vì thu được hỗn hợp kim loại => Fe dư => dung dịch chỉ có Fe2+ Các phản ứng: 2Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O Mol 0,15 0,4 0,1 0,15 0,1 Fe + Cu2+ → Fe2+ + Cu Mol 0,16 0,16 0,16 Gọi nFe dư = a => 0,16.64 + 56a = 0,7.56.(a + 0,15 + 0,16) => a = 239/2100 => mFe = (239/2100 + 0,31).56 = 23,73g => VNO = 0,1.22,4 = 2,24 lít
Câu 51 :
Hòa tan hoàn toàn 12,9 gam hỗn hợp Cu, Zn bằng dung dịch H2SO4 đặc, nóng thu được sản phẩm khử là 3,136 lít SO2 (đktc) và 0,64 gam lưu huỳnh. Phần trăm khối lượng của Cu trong hỗn hợp ban đầu là
Đáp án : D Phương pháp giải :
Đặt ẩn là số mol của Cu, Zn. Lập hệ 2 phương trình dựa vào: + Khối lượng hỗn hợp + Bảo toàn electron Giải hệ tìm được số mol mỗi kim loại Lời giải chi tiết :
nSO2 = 0,14 mol; nS = 0,02 mol Đặt nCu = x mol và nZn = y mol + m hh = 64x + 65y = 12,9 (1) + Bảo toàn electron:
Áp dụng bảo toàn electron: 2nCu + 2nZn = 2nSO2 + 6nS => 2x + 2y = 2.0,14 + 6.0,02 (2) Giải hệ (1) và (2) được: x = 0,1 và y = 0,1 => %mCu = 0,1.64/12,9.100% = 49,61%
Câu 52 :
Đun nóng m gam hỗn hợp Cu và Fe với tỉ lệ khối lượng tương ứng là 7 : 3 với một lượng dung dịch HNO3. Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít (đktc) hỗn hợp sản phẩm khử gồm NO và NO2. Biết lưỡng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là
Đáp án : A Phương pháp giải :
Ta có: mCu = 0,7m và mFe = 0,3m Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m => Dung dịch muối sau phản ứng chỉ chứa muối sắt (II) Áp dụng định luật bảo toàn e=> n NO, n NO2 Quá trình cho electron là: Fe → Fe2+ + 2e Áp dụng định luật bảo toàn electron ta có: 2.nFe = nNO2 + 3.nNO → nFe pứ = 0,25m/56 → Tính được giá trị m. Lời giải chi tiết :
Ta có: nHNO3 = 44,1: 63 = 0,7 mol Ta có: mCu = 0,7m và mFe = 0,3m Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m Ta có: nNO + nNO2 = 0,25 mol (1) Quá trình nhận electron: NO3-+ 1e + 2H+ → NO2 + H2O NO3-+ 3e + 4H+ → NO + 2H2O Ta có: nH+ = 2.nNO2 + 4.nNO = 0, 7 mol (2) Giải hệ (1) và (2) ta có: nNO = 0,1 mol và nNO2 = 0,15 mol Do sau phản ứng vẫn còn Fe dư và Cu nên quá trình cho electron là: Fe → Fe2+ + 2e Áp dụng định luật bảo toàn electron ta có: 2.nFe = nNO2 + 3.nNO = 0,15 + 3.0,1 = 0,45 mol → nFe pứ = 0,225 mol = 0,25m/56 (mol) → m = 50,4 gam
Câu 53 :
Hòa tan hoàn toàn 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Cu(NO3)2 và Fe(NO3)3 trong X lần lượt là:
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố, bảo toàn khối lượng, bảo toàn điện tích. Lời giải chi tiết :
Nếu KOH phản ứng hết thì T chứa KNO2: nKNO2 = nKOH = 0,5 mol => m chất rắn = 0,5.101 = 50,5 gam > 41,05 (g) (vô lí) => KOH dư - Đặt T gồm: KOH dư (a mol) và KNO2 (b mol) + BTNT "K": nKOH = nKOH dư + nKNO2 => a + b = 0,5 + m chất rắn = 56a + 85b = 41,05=> a = 0,05 và b = 0,45 BTNT "N": nKNO2 = nNO3- (dd X) = 0,45 mol - Đặt A gồm: Fe (x mol) và Cu (y mol) + mA = 56x + 64y = 11,6 + mFe2O3 + mCuO = 160.0,5x + 80y = 16=> x = 0,15 và y = 0,05 TH1: Giả sử dd X chứa: Fe3+ (0,15), Cu2+ (0,05), H+ và NO3- (0,45) \(11,6(g)A\left\{ \begin{gathered} BTĐT => nH+ = nNO3- - 2nFe3+ - 2nCu2+ = 0,45 - 0,15.3 - 0,05.2 = -0,1 < 0 (loại) TH2: Dung dịch X chứa: Fe2+ (u); Fe3+ (v); Cu2+ (0,05) và NO3- (0,45) + BTĐT: 2u + 3v + 2.0,05 = 0,45 + BTNT "Fe": u + v = 0,15 Giải hệ được u = 0,1 và v = 0,05 BTNT H: nH2O = 0,5.nHNO3 = 0,35 mol BTNT "N": nN(B) = nHNO3 - nNO3- = 0,7 - 0,45 = 0,25 mol Do dd X chứa NO3- dư nên không sinh ra H2 => Khí B chỉ chứa N và O BTNT "O": nO(B) = 3nHNO3 - 3nNO3- - nH2O = 0,7.3 - 0,45.3 - 0,35 = 0,4 mol => mB = mN + mO = 0,25.14 + 0,4.16 = 9,9 gam BTKL: m dd X = mA + mdd HNO3 - mB = 11,6 + 87,5 - 9,9 = 89,2 (g) => C% Cu(NO3)2 = (0,05.188/89,2).100% = 10,5%; C% Fe(NO3)3 = (0,05.242/89,2).100% = 13,6%
|