Trắc nghiệm Ôn tập chương 7 - Hóa 12Đề bài
Câu 1 :
Các hợp chất trong dãy chất nào dưới đây đều có tính lưỡng tính?
Câu 2 :
Cho sơ đồ phản ứng Cr $\xrightarrow{{ + C{l_2},\,{t^ \circ }}}$ X $\xrightarrow[{{t^o}}]{{{\text{dd}}\,\,NaOH\,\,đặc}}$ Y Chất Y trong sơ đồ trên là
Câu 3 :
Hiện tượng xảy ra khi nhỏ vài giọt dung dịch H2SO4 vào dung dịch Na2CrO4 là:
Câu 4 :
Phát biểu nào sau đây là sai?
Câu 5 :
Cho 13,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí), thu được dung dịch X và 7,84 lít khí H2 (ở đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) được m gam muối khan. Giá trị của m là:
Câu 6 :
Hòa tan hoàn toàn 1,23 gam hỗn hợp X gồm Cu và Al vào dung dịch HNO3 đặc, nóng thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Sục từ từ khí NH3 (dư) vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Phần trăm về khối lượng của Cu trong hỗn hợp X và giá trị của m lần lượt là
Câu 7 :
Phát biểu nào sau đây không đúng?
Câu 8 :
Bốn kim loại Na; Al; Fe và Cu được ấn định không theo thứ tự X, Y, Z, T. Biết rằng: - X; Y được điều chế bằng phương pháp điện phân nóng chảy - X đẩy được kim loại T ra khỏi dung dịch muối - Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội. X, Y, Z, T theo thứ tự là
Câu 9 :
Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl (dư) thoát ra V lít khí H2 (ở đktc). Giá trị của V là
Câu 10 :
Cho 7,68 gam Cu và 200 ml dung dịch gồm HNO3 0,6M và H2SO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn (sản phẩm khử duy nhất là NO), cô cạn cẩn thận toàn bộ dung dịch sau phản ứng thì khối lượng muối khan thu được là:
Câu 11 :
Cho m gam bột Cu vào 400 ml dung dịch AgNO3 0,2M, sau một thời gian phản ứng thu được 7,76 gam hỗn hợp chất rắn X và dung dịch Y. Lọc tách X, rồi thêm 5,85 gam bột Zn và Y, sau khi phản ứng xảy ra hoàn toàn thu được 10,53 gam chất rắn Z. Giá trị của m là:
Câu 12 :
Dung dịch loãng (dư) nào sau đây tác dụng được với kim loại sắt tạo thành muối sắt(III) ?
Câu 13 :
Hòa tan hoàn toàn x mol Fe vào dung dịch chứa y mol FeCl3 và z mol HCl, thu được dung dịch chỉ chứa một chất tan duy nhất. Biểu thức liên hệ giữa x, y và z là
Câu 14 :
Cho x mol Fe tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ x : y = 2 : 5), thu được một sản phẩm khử duy nhất và dung dịch chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị hoà tan là
Câu 15 :
Phát biểu nào sau đây không đúng?
Câu 16 :
Cho hỗn hợp gồm 1 mol chất X và 1 mol chất Y tác dụng hết với dung dịch H2SO4 đặc, nóng (dư), tạo ra 1 mol khí SO2 (sản phẩm khử duy nhất). Hai chất X, Y là
Câu 17 :
Cho 6,72 gam Fe vào dung dịch chứa 0,3 mol H2SO4 đặc, nóng (giả thiết SO2 là sản phẩm khử duy nhất). Sau khi phản ứng xảy ra hoàn toàn, thu được
Câu 18 :
Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
Câu 19 :
Hòa tan hoàn toàn 1,805 gam hỗn hợp gồm Fe và kim loại X bằng dung dịch HCl, thu được 1,064 lít khí H2. Mặt khác, hòa tan hoàn toàn 1,805 gam hỗn hợp trên bằng dung dịch HNO3 loãng (dư), thu được 0,896 lít khí NO (sản phẩm khử duy nhất). Biết các thể tích khí đều đo ở điều kiện tiêu chuẩn. Kim loại X là
Câu 20 :
Cho m gam hỗn hợp X gồm FeO, Fe2O3 , Fe3O4 vào một lượng vừa đủ dung dịch HCl 2M, thu được dung dịch Y có tỉ lệ số mol Fe2+ và Fe3+ là 1 : 2. Chia Y thành 2 phần bằng nhau. Cô cạn phần một thu được m1 gam muối khan. Sục khí clo (dư) vào phần hai, cô cạn dung dịch sau phản ứng thu được m2 gam muối khan. Biết m2 – m1 = 0,71. Thể tích dung dịch HCl đã dùng là
Câu 21 :
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4. Cho khí CO qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ca(OH)2 dư, đến phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc, nóng (dư), thu được 1,008 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Giá trị của m là
Câu 22 :
Hỗn hợp X gồm Al, Fe3O4 và CuO, trong đó oxi chiếm 25% khối lượng hỗn hợp. Cho 1,344 lít khí CO (đktc) đi qua m gam X nung nóng, sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 bằng 18. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng (dư), thu được dung dịch chứa 3,08m gam muối và 0,896 lít khí NO (ở đktc, là sản phẩm khử duy nhất). Giá trị m gần giá trị nào nhất sau đây?
Câu 23 :
Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau: - Phần 1 tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc); - Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc). Giá trị của m là
Câu 24 :
Hỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một tác dụng với dung dịch H2SO4 loãng (dư), thu được 4a mol khí H2. Phần hai phản ứng với dung dịch NaOH dư, thu được a mol khí H2. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
Câu 25 :
Nung một hỗn hợp rắn gồm a mol FeCO3 và b mol FeS2 trong bình kín chứa không khí (dư). Sau khi các phản ứng xảy ra hoàn toàn, đưa bình về nhiệt độ ban đầu, thu được chất rắn duy nhất là Fe2O3 và hỗn hợp khí. Biết áp suất khí trong bình trước và sau phản ứng bằng nhau, mối liên hệ giữa a và b là (biết sau các phản ứng, lưu huỳnh ở mức oxi hoá +4, thể tích các chất rắn là không đáng kể)
Câu 26 :
Nung m gam hỗn hợp X gồm FeS và FeS2 trong một bình kín chứa không khí (gồm 20% thể tích O2 và 80% thể tích N2) đến khi các phản ứng xảy ra hoàn toàn, thu được một chất rắn duy nhất và hỗn hợp khí Y có thành phần thể tích: 84,8% N2, 14% SO2, còn lại là O2. Phần trăm khối lượng của FeS trong hỗn hợp X là
Câu 27 :
Cho 18,4 gam hỗn hợp X gồm Cu2S, CuS, FeS2 và FeS tác dụng hết với HNO3 (đặc nóng, dư) thu được V lít khí chỉ có NO2 (ở đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho toàn bộ Y vào một lượng dư dung dịch BaCl2, thu được 46,6 gam kết tủa; còn khi cho toàn bộ Y tác dụng với dung dịch NH3 dư thu được 10,7 gam kết tủa. Giá trị của V là
Câu 28 :
Cho 0,01 mol một hợp chất của sắt tác dụng hết với H2SO4 đặc nóng (dư), chỉ thấy thoát ra 0,112 lít (ở đktc) khí SO2 (là sản phẩm khử duy nhất). Công thức của hợp chất sắt đó là
Câu 29 :
Để luyện được 800 tấn gang có hàm lượng sắt 95%, cần dùng x tấn quặng manhetit chứa 80% Fe3O4 (còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt bị hao hụt trong quá trình sản xuất là 1%. Giá trị của x là
Câu 30 :
Cho các phát biểu: (1) Nhôm là một kim loại lưỡng tính; (2) CrO3 là oxit lưỡng tính; (3) Al2O3 là oxit lưỡng tính; Al(OH)3 là hidroxit lưỡng tính. Số phát biểu đúng là
Câu 31 :
Cho 34,138 gam hỗn hợp X gồm FeCl2 và CrCl3 tác dụng với lượng dư dung dịch NaOH, thu được dung dịch Y và kết tủa Z. Lọc lấy Z rồi nung trong không khí đến khối lượng không đổi thì thu được 11,52 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Khối lượng của CrCl3 trong X là
Lời giải và đáp án
Câu 1 :
Các hợp chất trong dãy chất nào dưới đây đều có tính lưỡng tính?
Đáp án : B Phương pháp giải :
Chất lưỡng tính là chất tác dụng với cả axit và bazơ Lời giải chi tiết :
A sai vì Mg(OH)2, Fe(OH)2 không có tính lưỡng tính. C, D sai vì Mg(OH)2 không có tính lưỡng tính.
Câu 2 :
Cho sơ đồ phản ứng Cr $\xrightarrow{{ + C{l_2},\,{t^ \circ }}}$ X $\xrightarrow[{{t^o}}]{{{\text{dd}}\,\,NaOH\,\,đặc}}$ Y Chất Y trong sơ đồ trên là
Đáp án : B Lời giải chi tiết :
2Cr + 3Cl2 $\xrightarrow{{{t^ \circ }}}$ 2CrCl3 X CrCl3 + 4NaOH $\xrightarrow{{{t^ \circ }}}$ 3NaCl + NaCrO2 + 2H2O Y
Câu 3 :
Hiện tượng xảy ra khi nhỏ vài giọt dung dịch H2SO4 vào dung dịch Na2CrO4 là:
Đáp án : C Lời giải chi tiết :
$C{r_2}O_7^{2 - } + {H_2}O\,\,\,\overset {} \leftrightarrows \,\,2CrO_4^{2 - } + 2{H^ + }$ (Da cam) (vàng) Thêm H2SO4 → $\left[ {{H^ + }} \right]$ tăng → cân bằng chuyển dịch sang trái → dung dịch chuyển từ màu vàng sang màu da cam.
Câu 4 :
Phát biểu nào sau đây là sai?
Đáp án : C Lời giải chi tiết :
A đúng vì $\,\,3Cr{O_3} + 2{H_2}O\xrightarrow{{}}{H_2}Cr{O_4} + {H_2}C{r_2}{O_7}$ $\,2Cr{O_3} + {H_2}O\xrightarrow{{}}{H_2}C{r_2}{O_7}$ B đúng vì $\,Cr{(OH)_3} + NaOH\xrightarrow{{}}NaCr{O_2} + 2{H_2}O$ C sai vì $Cr + {H_2}S{O_4}\xrightarrow{{}}CrS{O_4} + {H_2} \uparrow $ D đúng vì $\,3B{r_2} + 2CrO_2^ - + 8O{H^ - }\xrightarrow{{}}6B{r^ - } + 2CrO_4^{2 - } + 4{H_2}O$
Câu 5 :
Cho 13,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí), thu được dung dịch X và 7,84 lít khí H2 (ở đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) được m gam muối khan. Giá trị của m là:
Đáp án : D Phương pháp giải :
+) ${n_{{H_2}}} = {n_{SO_4^{2 - }}}$ +) m = mkl + ${m_{SO_4^{2 - }}}$ Lời giải chi tiết :
${n_{{H_2}}} = 0,35\,(mol)$ ${n_{{H_2}}} = {n_{SO_4^{2 - }}} = 0,35\,mol$ → m = mkl + ${m_{SO_4^{2 - }}}$ = 13,5 + 0,35.96 = 47,1 gam
Câu 6 :
Hòa tan hoàn toàn 1,23 gam hỗn hợp X gồm Cu và Al vào dung dịch HNO3 đặc, nóng thu được 1,344 lít khí NO2 (sản phẩm khử duy nhất, ở đktc) và dung dịch Y. Sục từ từ khí NH3 (dư) vào dung dịch Y, sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Phần trăm về khối lượng của Cu trong hỗn hợp X và giá trị của m lần lượt là
Đáp án : D Phương pháp giải :
Gọi nCu = x mol; nAl = y mol +) PT (1) khối lượng hh X +) PT (2) bảo toàn e +) Cu(OH)2 tan trong NH3 dư Lời giải chi tiết :
$\begin{array}{*{20}{c}}{{n_{Cu}} = x\,(mol)} \\ {{n_{Al}} = y\,(mol)} \end{array}\xrightarrow{{ + HN{O_3}}}\left\{ \begin{gathered}Cu{(N{O_3})_3} \hfill \\Al{(N{O_3})_3} \hfill \\ \end{gathered} \right.\xrightarrow{{ + N{H_3}\,du}}\left\{ \begin{gathered}[Cu{(N{H_3})_4}]{Cu(OH)_2} \hfill \\Al{(OH)_3} \downarrow \hfill \\ \end{gathered} \right.$ ${n_{N{O_2}}} = 0,06\,(mol)$ $\begin{align} & Cu\to C{{u}^{2+}}+2e \\ & Al\to A{{l}^{3+}}+3e \\ \end{align}$ $\begin{align} & \overset{+5}{\mathop{N}}\,+1e\to \overset{+4}{\mathop{N}}\, \\ & \,\,\,\,\,0,06\leftarrow 0,06 \\ \end{align}$ $ \to \left\{ \begin{gathered}64x + 27y = 1,23 \hfill \\2x + 3y = 0,06 \hfill \\ \end{gathered} \right.\xrightarrow{{}}\left\{ \begin{gathered}x = 0,015 \hfill \\y = 0,01 \hfill \\ \end{gathered} \right.$ %mCu = $\dfrac{{0,015.64}}{{1,23}}$ .100% = 78,05% ${n_{Al{{(OH)}_3}}} = {n_{Al}} = 0,01\,(mol)$ → ${m_{Al{{(OH)}_3}}}$ = 0,01.78 = 0,78 (g)
Câu 7 :
Phát biểu nào sau đây không đúng?
Đáp án : B Lời giải chi tiết :
A đúng vì Cu(OH)2 + 4NH3 → $\left[ {Cu{{(N{H_3})}_4}} \right]{(OH)_2}$ B sai, Cr(OH)2 là bazơ, không có tính lưỡng tính C đúng vì: $3Cu + 2NO_3^ - + 8{H^ + } \to 3C{u^{2 + }} + 2NO \uparrow \, + 4{H_2}O$ D đúng vì 2NH3 + 3CuO $\xrightarrow{{{t^ \circ }}}$ 3Cu + N2↑ + 3H2O
Câu 8 :
Bốn kim loại Na; Al; Fe và Cu được ấn định không theo thứ tự X, Y, Z, T. Biết rằng: - X; Y được điều chế bằng phương pháp điện phân nóng chảy - X đẩy được kim loại T ra khỏi dung dịch muối - Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội. X, Y, Z, T theo thứ tự là
Đáp án : A Lời giải chi tiết :
X; Y được điều chế bằng phương pháp điện phân nóng chảy => X và Y là kim loại đứng trước Zn => Na và Al +) X đẩy được T ra khỏi dung dịch muối => X là Al (vì Na phản ứng với H2O trong dd trước) => Y là Na +) Z tác dụng được với dung dịch H2SO4 đặc nóng nhưng không tác dụng được với dung dịch H2SO4 đặc nguội => Z là Fe (vì Fe bị thụ động hóa trong H2SO4 đặc nguội). => T là Cu
Câu 9 :
Nung hỗn hợp bột gồm 15,2 gam Cr2O3 và m gam Al ở nhiệt độ cao. Sau khi phản ứng hoàn toàn, thu được 23,3 gam hỗn hợp rắn X. Cho toàn bộ hỗn hợp X phản ứng với axit HCl (dư) thoát ra V lít khí H2 (ở đktc). Giá trị của V là
Đáp án : A Phương pháp giải :
+) ĐLBT khối lượng: ${m_X}\, = \,\,{m_{C{r_2}{O_3}}}\, + \,\,{m_{Al}}$ → mAl +) Bảo toàn e: 3.nAl + 2.nCr = 2.nH2 Lời giải chi tiết :
Cr2O3 + Al → Rắn X Theo ĐLBT khối lượng: ${m_X}\, = \,\,{m_{C{r_2}{O_3}}}\, + \,\,{m_{Al}}$→ mAl = 23,3 – 15,2 = 8,1 (g) ${n_{Al}} = 0,3\,(mol);\,{n_{C{r_2}{O_3}}} = 0,1\,(mol)$ Xét phản ứng: 2Al + Cr2O3 → Al2O3 + 2Cr Vì $\dfrac{{{n_{Al}}}}{{{n_{C{r_2}{O_3}}}}} = \dfrac{{0,3}}{{0,1}}$ >2 → Al dư $\left\{ \begin{gathered}{n_{Al}} = 0,3\,(mol) \hfill \\{n_{C{r_2}{O_3}}} = 0,1\,(mol) \hfill \\ \end{gathered} \right.\xrightarrow{{{t^ \circ }}}\left\{ \begin{gathered}Al\,dư \hfill \\A{l_2}{O_3} \hfill \\C{\text{r}} \hfill \\ \end{gathered} \right.\xrightarrow{{ + HCl}}\left\{ \begin{gathered}AlC{l_3} \hfill \\CrC{l_2} \hfill \\{n_{{H_2}}} \uparrow = x\,\,(mol) \hfill \\ \end{gathered} \right.$  Áp dụng ĐLBT electron: $0,9 = 0,2 + 2x \to x = 0,35\,\,\, \to {V_{{H_2}}} = 0,35.22,4 = 7,84\,(l)$
Câu 10 :
Cho 7,68 gam Cu và 200 ml dung dịch gồm HNO3 0,6M và H2SO4 0,5M. Sau khi các phản ứng xảy ra hoàn toàn (sản phẩm khử duy nhất là NO), cô cạn cẩn thận toàn bộ dung dịch sau phản ứng thì khối lượng muối khan thu được là:
Đáp án : C Phương pháp giải :
+) Xét $2.{n_{Cu}} = \dfrac{3}{4}.{n_{{H^ + }}}$ +) ${n_{NO_3^ - \,dư}} = {n_{NO_3^ - \,bd}} - \dfrac{2}{3}.{n_{Cu}}$ +) mmuối = ${m_{C{u^{2 + }}}} + {m_{SO_4^{2 - }}} + {m_{NO_3^ - }}$ Lời giải chi tiết :
${n_{Cu}} = 0,12\,mol;\,{n_{{H^ + }}} = 0,32\,mol;\,{n_{NO_3^ - }} = 0,12\,mol;\,{n_{SO_4^{2 - }}} = 0,1\,mol$ Ta có: $2.{n_{Cu}} = \dfrac{3}{4}.{n_{{H^ + }}}$ nên Cu và H+ hết , NO3- dư ${n_{NO_3^ - \,dư}} = 0,12 - \dfrac{2}{3}.{n_{Cu}} = 0,04\,mol$ => mmuối = ${m_{C{u^{2 + }}}} + {m_{SO_4^{2 - }}} + {m_{NO_3^ - }} = 19,76\,gam$
Câu 11 :
Cho m gam bột Cu vào 400 ml dung dịch AgNO3 0,2M, sau một thời gian phản ứng thu được 7,76 gam hỗn hợp chất rắn X và dung dịch Y. Lọc tách X, rồi thêm 5,85 gam bột Zn và Y, sau khi phản ứng xảy ra hoàn toàn thu được 10,53 gam chất rắn Z. Giá trị của m là:
Đáp án : A Phương pháp giải :
+) BT NO3- → nZn(NO3)2 +) BTKL ba kim loại => m Lời giải chi tiết :
Dd muối cuối cùng là Zn(NO3)2 Ta có: ${n_{NO_3^ - }}$ = 0, 4.0, 2 = 0,08 mol BT NO3- → nZn(NO3)2 = 0,04 mol BTKL ba kim loại: m + 0, 4.0, 2.108 + 5,85 = 7,76 + 10,53 + 0, 04.65 => m = 6,4 gam
Câu 12 :
Dung dịch loãng (dư) nào sau đây tác dụng được với kim loại sắt tạo thành muối sắt(III) ?
Đáp án : B Lời giải chi tiết :
Fe + H2SO4(l) → FeSO4 + H2↑ Fe + 4HNO3(l) → Fe(NO3)3 + NO↑ + 2H2O Fe + 2FeCl3 → 3FeCl2 Fe + 2HCl → FeCl2 + H2↑
Câu 13 :
Hòa tan hoàn toàn x mol Fe vào dung dịch chứa y mol FeCl3 và z mol HCl, thu được dung dịch chỉ chứa một chất tan duy nhất. Biểu thức liên hệ giữa x, y và z là
Đáp án : B Phương pháp giải :
Sử dụng phương pháp bảo toàn e Lời giải chi tiết :
Dung dịch chỉ chứa một chất tan duy nhất là muối FeCl2 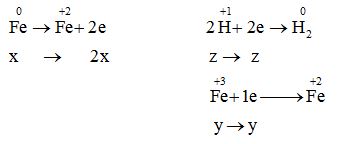 Bảo toàn electron: 2x = y + z
Câu 14 :
Cho x mol Fe tan hoàn toàn trong dung dịch chứa y mol H2SO4 (tỉ lệ x : y = 2 : 5), thu được một sản phẩm khử duy nhất và dung dịch chỉ chứa muối sunfat. Số mol electron do lượng Fe trên nhường khi bị hoà tan là
Đáp án : D Phương pháp giải :
Sử dụng bảo toàn e Lời giải chi tiết :
Giả sử nFe = 2 mol → ${n_{{H_2}S{O_4}}} = 5\,\,mol$ TH1: Fe + H2SO4 $\xrightarrow{{}}$ FeSO4 + H2 ↑ 2 5 → H2SO4 dư → loại TH2: 2Fe + 6H2SO4 $\xrightarrow{{}}$Fe2(SO4)3 + 3SO2 ↑ + 6H2O $\dfrac{5}{3}$ ← 5 → $\dfrac{5}{6}$ Fe dư + Fe2(SO4)3 $\xrightarrow{{}}$3FeSO4 $\dfrac{1}{3}$ $\dfrac{5}{6}$ → 1 Sau phản ứng: FeSO4 1 mol và Fe2(SO4)3 0,5 mol → ne.tđ = 1.2 + 3.2.0,5 = 5 = ${n_{{H_2}S{O_4}}}$
Câu 15 :
Phát biểu nào sau đây không đúng?
Đáp án : D Phương pháp giải :
Sử dụng bảo toàn e Lời giải chi tiết :
A đúng vì Fe + 2HCl → FeCl2 + H2↑ B đúng vì Fe + 2FeCl3 → 3FeCl2 C đúng vì Fe bị thụ động hóa trong dung dịch H2SO4 đặc, nguội D sai vì Fe2+ là trạng thái oxi hóa trung gian của sắt → Fe2+ vừa có tính oxi hóa, vừa có tính khử.
Câu 16 :
Cho hỗn hợp gồm 1 mol chất X và 1 mol chất Y tác dụng hết với dung dịch H2SO4 đặc, nóng (dư), tạo ra 1 mol khí SO2 (sản phẩm khử duy nhất). Hai chất X, Y là
Đáp án : A Lời giải chi tiết :
Xét quá trình cho – nhận e: Cho e: Fe: $\,\mathop {Fe}\limits^0 \to \,\mathop {\,\,F{\text{e}}}\limits^{ + 3} \, + \,3{\text{e}}$ FeO : $\mathop {F{\text{e}}}\limits^{ + 2} \,\,\, \to \,\mathop {\,\,F{\text{e}}}\limits^{ + 3} \, + \,1{\text{e}}$ Fe3O4: ${\mathop {F{\text{e}}}\limits^{ + \dfrac{8}{3}} _3}\, \to \,\,3\mathop {F{\text{e}}}\limits^{ + 3} $+ 1e Nhận e: $\mathop S\limits^{ + 6} \,\,\, \to \,\,\mathop S\limits^{ + 4} $ + 2e A. FeO, Fe3O4 : ${n_{S{O_2}}}$ = $\dfrac{{1\, + \,1}}{2}$ = 1 mol B. Fe3O4, Fe2O3: ${n_{S{O_2}}}$ = $\dfrac{{1\,}}{2}$ = 0,5 mol C. Fe, Fe2O3 : ${n_{S{O_2}}}$ = $\dfrac{3}{2}\,\, = \,\,1,5\,mol$ D. Fe, FeO : ${n_{S{O_2}}}$ = $\dfrac{{3\, + \,1}}{2}$ = 2 mol
Câu 17 :
Cho 6,72 gam Fe vào dung dịch chứa 0,3 mol H2SO4 đặc, nóng (giả thiết SO2 là sản phẩm khử duy nhất). Sau khi phản ứng xảy ra hoàn toàn, thu được
Đáp án : A Phương pháp giải :
Xét 2 TH nếu Fe tạo hết thành muối Fe(III) và Fe tạo hết thành muối Fe(II): +) Sử dụng bảo toàn e: 3.nFe = 2.nSO2 => nSO2 +) ${n_{SO_4^{2 - }}} = 2.{n_{S{O_2}}}$ Lời giải chi tiết :
nFe = 0,12 mol Nếu Fe tạo hết thành muối Fe(III) Bảo toàn e: 3.nFe = 2.nSO2 => nSO2 = 0,18 mol $ \Rightarrow {n_{SO_4^{2 - }}} = 2.{n_{S{O_2}}} = 0,36\, > 0,3$ Nếu Fe tạo hết thành muối Fe(II): Bảo toàn e: 3.nFe = 2.nSO2 => nSO2 = 0,12 mol $ \Rightarrow {n_{SO_4^{2 - }}} = 2.{n_{S{O_2}}} = 0,24 < 0,3$ => phản ứng tạo 2 muối FeSO4 (x mol) và Fe2(SO4)3 (y mol) $\left\{ \begin{gathered}\xrightarrow{{BTNT\,F{\text{e}}}}x + 2y = 0,12 \hfill \\{n_{{H_2}S{O_4}}} = 2.{n_{S{O_2}}} = 2.\frac{{2{\text{x}} + 3.2y}}{2} = 0,3 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}x = 0,06 \hfill \\y = 0,03 \hfill \\ \end{gathered} \right.$ → dung dịch sau phản ứng: $\left\{ \begin{gathered}FeS{O_4}:\,0,06\,mol \hfill \\F{e_2}{(S{O_4})_3}\,:0,03\,mol \hfill \\ \end{gathered} \right.$
Câu 18 :
Thể tích dung dịch HNO3 1M (loãng) ít nhất cần dùng để hoà tan hoàn toàn một hỗn hợp gồm 0,15 mol Fe và 0,15 mol Cu là (biết phản ứng tạo chất khử duy nhất là NO)
Đáp án : C Phương pháp giải :
+) HNO3 dùng ít nhất => phản ứng tạo muối Fe(II) +) Sử dụng bảo toàn e => nNO +) ${n_{HN{O_3}}} = 4{n_{NO}}$ Lời giải chi tiết :
Thể tích HNO3 cần dùng là ít nhất nên chỉ tạo thành muối sắt (II) $\left\{ \begin{gathered}Fe \hfill \\Cu \hfill \\ \end{gathered} \right.$+ HNO3(loãng) $\xrightarrow{{{t^0}}}$ $\left\{ \begin{gathered}Fe{(N{O_3})_2} \hfill \\Cu{(N{O_3})_2} \hfill \\ \end{gathered} \right.$ + NO↑ + H2O  Bảo toàn e: 0,3 + 0,3 = 3x → x = 0,2 ${n_{HN{O_3}}} = 4{n_{NO}} = 4.0,2 = 0,8\,mol$ → ${V_{HN{O_3}}}$ = 0,8.1 = 0,8 lít
Câu 19 :
Hòa tan hoàn toàn 1,805 gam hỗn hợp gồm Fe và kim loại X bằng dung dịch HCl, thu được 1,064 lít khí H2. Mặt khác, hòa tan hoàn toàn 1,805 gam hỗn hợp trên bằng dung dịch HNO3 loãng (dư), thu được 0,896 lít khí NO (sản phẩm khử duy nhất). Biết các thể tích khí đều đo ở điều kiện tiêu chuẩn. Kim loại X là
Đáp án : B Phương pháp giải :
Sử dụng phương pháp bảo toàn e Lời giải chi tiết :
Gọi nFe = x mol; nX = y mol ${n_{{H_2}}}$ = $\dfrac{{1,064}}{{22,4}}$ = 0,0475 mol ; nNO = $\dfrac{{0,896}}{{22,4}}$ = 0,04 mol $\left\{ \begin{gathered}Fe \hfill \\X \hfill \\ \end{gathered} \right.$ + HCl $\xrightarrow{{}}$ $\left\{ \begin{gathered}FeC{l_2} \hfill \\XC{l_n} \hfill \\ \end{gathered} \right.$ + H2 Áp dụng định luật bảo toàn electron: $2.{n_{Fe}} + n.{n_X} = 2.{n_{{H_2}}}$ => 2x + ny = 0,095 (1) $\left\{ \begin{gathered}Fe \hfill \\X \hfill \\ \end{gathered} \right.$ + HNO3 $\xrightarrow{{}}$ $\left\{ \begin{gathered}F{e^{3 + }} \hfill \\{X^{n + }} \hfill \\ \end{gathered} \right.$ + NO + H2O Áp dụng định luật bảo toàn electron: $3.{n_{Fe}} + n.{n_X} = 2.{n_{{H_2}}}$ => 3x + ny = 0,12 (2) Từ (1) và (2) → x = 0,025 và ny = 0,045 mFe = 0,025.56 = 1,4 gam → mX = 1,805 – 1,4 = 0,405 gam → $\dfrac{{0,405.n}}{X}\,$ = 0,045 →$\dfrac{X}{n}\,\,\, = \,\,\,9$ → X = 9n Với n = 3 => X = 27 => X là Al
Câu 20 :
Cho m gam hỗn hợp X gồm FeO, Fe2O3 , Fe3O4 vào một lượng vừa đủ dung dịch HCl 2M, thu được dung dịch Y có tỉ lệ số mol Fe2+ và Fe3+ là 1 : 2. Chia Y thành 2 phần bằng nhau. Cô cạn phần một thu được m1 gam muối khan. Sục khí clo (dư) vào phần hai, cô cạn dung dịch sau phản ứng thu được m2 gam muối khan. Biết m2 – m1 = 0,71. Thể tích dung dịch HCl đã dùng là
Đáp án : D Phương pháp giải :
Phần 1: muối thu được gồm FeCl2 và FeCl3 Phần 2: sục khí Clo dư vào thu được muối FeCl3 → khối lượng tăng lên là khối lượng Cl2 phản ứng Lời giải chi tiết :
Phần 1: muối thu được gồm FeCl2 và FeCl3 Phần 2: sục khí Clo dư vào: 2FeCl2 + Cl2 → 2FeCl3 → khối lượng tăng lên là khối lượng Cl2 phản ứng ${n_{C{l_2}}} = 0,01mol$ $2F{\text{eC}}{{\text{l}}_2} + C{l_2} \to 2F{\text{e}}C{l_3}$ 0,02 ← 0,01 → Trong phần 1 có: ${n_{F{\text{e}}C{l_2}}} = 0,02\,\,mol,\,\,{n_{F{\text{e}}C{l_3}}} = 0,04\,\,mol$ Bảo toàn nguyên tố Clo $ \to {n_{HCl}} = {n_{C{l^ - }}} = (0,02.2 + 0,04.3).2 = 0,32\,\,mol$ $ \to {V_{HCl}} = \dfrac{{0,32}}{2} = 0,16\,(l) = 160{\text{ }}ml$
Câu 21 :
Hỗn hợp X gồm FeO, Fe2O3 và Fe3O4. Cho khí CO qua m gam X nung nóng, sau một thời gian thu được hỗn hợp chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào dung dịch Ca(OH)2 dư, đến phản ứng hoàn toàn, thu được 4 gam kết tủa. Mặt khác, hòa tan hoàn toàn Y trong dung dịch H2SO4 đặc, nóng (dư), thu được 1,008 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch chứa 18 gam muối. Giá trị của m là
Đáp án : B Phương pháp giải :
Quy đổi hỗn hợp X ban đầu gồm Fe và O +) ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}}$ → nCO pứ Hỗn hợp rắn Y + H2SO4 tạo muối Fe2(SO4)3 → ${n_{F{{\text{e}}_2}{{(S{O_4})}_3}}} \to {n_{F{\text{e}}}}$ +) Bảo toàn e → y → mX Lời giải chi tiết :
Quy đổi hỗn hợp X ban đầu gồm Fe và O $m\,(g)\,hh\,X\left\{ \begin{gathered}F{\text{e}}:x\,\,mol \hfill \\O:\,y\,\,mol \hfill \\ \end{gathered} \right.\xrightarrow{{CO}}$ hh rắn Y + hh khí Z $\left\{ \begin{gathered}C{O_2} \hfill \\CO \hfill \\ \end{gathered} \right.\xrightarrow{{Ca{{(OH)}_2}}}4\,\,g\,CaC{{\text{O}}_3} \downarrow $ → ${n_{C{O_2}}} = {n_{CaC{{\text{O}}_3}}} = 0,04\,mol$ → nCO pứ = 0,04 mol Hỗn hợp rắn Y + H2SO4 tạo muối Fe2(SO4)3 →${n_{F{{\text{e}}_2}{{(S{O_4})}_3}}} = \dfrac{{18}}{{400}} = 0,045\,mol \to {n_{F{\text{e}}}} = x = 0,09\,mol$ ${n_{S{O_2}}} = \dfrac{{1,008}}{{22,4}} = 0,045\,\,mol$ Quá trình cho-nhận e: 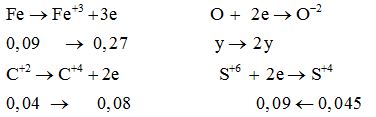 Bảo toàn e: 0,27 + 0,08 = 2y + 0,09 → y = 0,13 mol → mX = 56.0,09 + 16.0,13 = 7,12 g
Câu 22 :
Hỗn hợp X gồm Al, Fe3O4 và CuO, trong đó oxi chiếm 25% khối lượng hỗn hợp. Cho 1,344 lít khí CO (đktc) đi qua m gam X nung nóng, sau một thời gian thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 bằng 18. Hòa tan hoàn toàn Y trong dung dịch HNO3 loãng (dư), thu được dung dịch chứa 3,08m gam muối và 0,896 lít khí NO (ở đktc, là sản phẩm khử duy nhất). Giá trị m gần giá trị nào nhất sau đây?
Đáp án : B Phương pháp giải :
+) Coi hỗn hợp X gồm Al, Fe, Cu và O +) Tính m kim loại và mO theo m +) Tính số mol CO2 và CO dư +) mmuối = ${m_{KL}} + {m_{N{O_3}^ - }}$ $ \to {m_{N{O_3}^ - }}$ +) ${n_{NO_3^ - }} = 4{n_{{O_2}}} + 3{n_{NO}} - 2{n_{C{O_2}}}$ Lời giải chi tiết :
${n_{CO}} = 0,06\,mol$; ${n_{NO}} = 0,04\,mol$ Coi hỗn hợp X gồm Al, Fe, Cu và O → m kim loại = 0,75m và mO = 0,25m Hỗn hợp khí Z gồm CO2 và CO dư. $\overline {{M_Z}} = 36$ $ \to \% {n_{CO}} = \dfrac{{44 - 36}}{{44 - 28}} = 50\% \to {n_{CO}} = {n_{C{O_2}}} = 0,03\,\,mol$ Quá trình cho – nhận e: 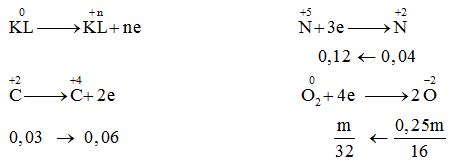 mmuối = ${m_{KL}} + {m_{N{O_3}^ - }}$ $ = 0,75m + {m_{NO_3^ - }} = 3,08m$ $ \to {m_{N{O_3}^ - }} = 2,33m$ ${n_{NO_3^ - }} = 4{n_{{O_2}}} + 3{n_{NO}} - 2{n_{C{O_2}}} \to (\dfrac{m}{{32}} + 0,12 - 0,06).62 = 2,33m\,\, \to \,\,m \approx 9,48\,$
Câu 23 :
Nung nóng m gam hỗn hợp Al và Fe2O3 (trong môi trường không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn Y. Chia Y thành hai phần bằng nhau: - Phần 1 tác dụng với dung dịch H2SO4 loãng (dư), sinh ra 3,08 lít khí H2 (ở đktc); - Phần 2 tác dụng với dung dịch NaOH (dư), sinh ra 0,84 lít khí H2 (ở đktc). Giá trị của m là
Đáp án : A Phương pháp giải :
Vì Y tác dụng với NaOH sinh ra H2 → Y có Al dư. +) Phần 1: Bảo toàn e: 3nAl = ${n_{F{e^{3 + }}}} + 2{n_{{H_2}}}$ → PT (1) +) Phần 2: Bảo toàn e: 3nAl = $3{n_{F{e^{3 + }}}} + 2{n_{{H_2}}}$ → PT (2) Lời giải chi tiết :
Vì Y tác dụng với NaOH sinh ra H2 → Y có Al dư. $\left\{ \begin{gathered}Al:\,x\,\,mol \hfill \\F{e_2}{O_3}:\,y\,\,mol \hfill \\ \end{gathered} \right.\xrightarrow{{{t^ \circ }}}\left\{ \begin{gathered}Fe \hfill \\A{l_2}{O_3} \hfill \\A{l_{dư }} \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + {H_2}S{O_4}}}\left\{ \begin{gathered}FeS{O_4} \hfill \\A{l_2}{(S{O_4})_3} \hfill \\ \end{gathered} \right. + {H_2}$ Bảo toàn e: 3nAl = ${n_{F{e^{3 + }}}} + 2{n_{{H_2}}}$ → 3x = 2y + 2. $\dfrac{{3,08}}{{22,4}}.2$ → 3x – 2y = 0,55 (1) $\left\{ \begin{gathered}Al:\,x\,\,mol \hfill \\F{e_2}{O_3}:\,y\,\,mol \hfill \\ \end{gathered} \right.\xrightarrow{{{t^ \circ }}}\left\{ \begin{gathered}Fe \hfill \\A{l_2}{O_3} \hfill \\A{l_{dư }} \hfill \\ \end{gathered} \right.\,\,\xrightarrow{{ + NaOH}}\left\{ \begin{gathered}Fe \hfill \\NaAl{O_2} \hfill \\ \end{gathered} \right. + {H_2}$ Bảo toàn e: 3nAl = $3{n_{F{e^{3 + }}}} + 2{n_{{H_2}}}$ → 3x = 3.2y + $2.\dfrac{{0,84}}{{22,4}}.2$ → 3x – 6y = 0,15 (2) Từ (1) và (2) suy ra x = 0,25; y = 0,1. → m = 0,25.27 + 0,1.160 = 22,75 g
Câu 24 :
Hỗn hợp X gồm 3,92 gam Fe, 16 gam Fe2O3 và m gam Al. Nung X ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn Y. Chia Y thành hai phần bằng nhau. Phần một tác dụng với dung dịch H2SO4 loãng (dư), thu được 4a mol khí H2. Phần hai phản ứng với dung dịch NaOH dư, thu được a mol khí H2. Biết các phản ứng đều xảy ra hoàn toàn. Giá trị của m là
Đáp án : B Phương pháp giải :
Do Y phản ứng với dung dịch NaOH dư thu được khí H2 nên Al dư → Hỗn hợp Y gồm Al dư, Al2O3 và Fe. Gọi số mol Al dư (trong từng phần) là x mol +) Phần 1 Al và Fe phản ứng Bảo toàn e: 3.nAl + 2.nFe = 2.nH2 => PT (1) +) Phần 2 chỉ có Al phản ứng Bảo toàn electron: 3.nAl = 2.nH2 => PT (2) Từ (1) và (2) => x Lời giải chi tiết :
${n_{Fe}} = \dfrac{{3,92}}{{56}} = 0,07\,mol\,;\,\,\,{n_{F{e_2}{O_3}}} = \dfrac{{16}}{{160}} = 0,1\,mol$ $F{e_2}{O_3} + 2Al\xrightarrow{{{t^ \circ }}}A{l_2}{O_3} + 2Fe$ $0,1\,\,\,\,\, \to \,\,\,0,2\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,2$ $ \to {n_{Fe}} = 0,07 + 0,2 = 0,27\,mol$ Do Y phản ứng với dung dịch NaOH dư thu được khí H2 nên Al dư → Hỗn hợp Y gồm Al dư, Al2O3 và Fe. Gọi số mol Al dư (trong từng phần) là x mol +) Phần 1 tác dụng với H2SO4 => Al và Fe phản ứng Bảo toàn e: 3.nAl + 2.nFe = 2.nH2 => 3.0,5x + 0,5.0,27 = 2.4a (1) +) Phần 2 tác dụng với dd NaOH => chỉ có Al phản ứng Bảo toàn electron: 3.nAl = 2.nH2 => 3.0,5x = 2a (2) Từ (1) và (2) $\to \dfrac{{1,5x + 0,135}}{{1,5x}} = \dfrac{{4a}}{a} = 4 \to x = 0,03\,mol$ $\to m = 2.0,03.27 + 0,2.27 = 7,02\,gam$
Câu 25 :
Nung một hỗn hợp rắn gồm a mol FeCO3 và b mol FeS2 trong bình kín chứa không khí (dư). Sau khi các phản ứng xảy ra hoàn toàn, đưa bình về nhiệt độ ban đầu, thu được chất rắn duy nhất là Fe2O3 và hỗn hợp khí. Biết áp suất khí trong bình trước và sau phản ứng bằng nhau, mối liên hệ giữa a và b là (biết sau các phản ứng, lưu huỳnh ở mức oxi hoá +4, thể tích các chất rắn là không đáng kể)
Đáp án : B Phương pháp giải :
Áp suất khí trong bình trước và sau phản ứng bằng nhau nên số mol khí trước và sau phản ứng bằng nhau => viết PT và cho tổng số mol trước và sau phản ứng bằng nhau Lời giải chi tiết :
4FeCO3 + O2 → 2Fe2O3 + 4CO2 a → 0,25a → a 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 b → 2,75b → 2b Vì áp suất khí trong bình trước và sau phản ứng bằng nhau nên số mol khí trước và sau phản ứng bằng nhau => 0,25a + 2,75b = a + 2b => a = b
Câu 26 :
Nung m gam hỗn hợp X gồm FeS và FeS2 trong một bình kín chứa không khí (gồm 20% thể tích O2 và 80% thể tích N2) đến khi các phản ứng xảy ra hoàn toàn, thu được một chất rắn duy nhất và hỗn hợp khí Y có thành phần thể tích: 84,8% N2, 14% SO2, còn lại là O2. Phần trăm khối lượng của FeS trong hỗn hợp X là
Đáp án : D Phương pháp giải :
Giả sử lấy 100 mol khí sau phản ứng => tính số mol mỗi khí +) Gọi số mol FeS và FeS2 là a và b => lập hệ PT tìm a, b Lời giải chi tiết :
Lấy 100 mol khí sau phản ứng → ${n_{{N_2}}} = 84,8\,\,mol \to {n_{{O_2}}}$ (ban đầu) = 84,8 : 4 = 21,2 mol ${n_{S{O_2}}} = 14\,\,mol;\,\,{n_{{O_2}}} = 1,2\,\,mol$ 4FeS + 7O2 $\xrightarrow{{}}$ 2Fe2O3 + 4SO2 a → 1,75a → a 4FeS2 + 11O2 $\xrightarrow{{}}$ 2Fe2O3 + 8SO2 b → 2,75b → 2b $\left\{ \begin{gathered}a + 2b = 14 \hfill \\1,75a + 2,75b = 21,2 - 1,2 \hfill \\ \end{gathered} \right. \to \left\{ \begin{gathered}a = 2 \hfill \\b = 6 \hfill \\ \end{gathered} \right.$ $ \to \% FeS = \dfrac{{88.2}}{{88.2 + 120.6}}.100\% = 19,64\% $
Câu 27 :
Cho 18,4 gam hỗn hợp X gồm Cu2S, CuS, FeS2 và FeS tác dụng hết với HNO3 (đặc nóng, dư) thu được V lít khí chỉ có NO2 (ở đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho toàn bộ Y vào một lượng dư dung dịch BaCl2, thu được 46,6 gam kết tủa; còn khi cho toàn bộ Y tác dụng với dung dịch NH3 dư thu được 10,7 gam kết tủa. Giá trị của V là
Đáp án : A Phương pháp giải :
+) Coi hỗn hợp X gồm Cu; Fe; S $B{a^{2 + }}\, + \,\,SO_4^{2 - }$→ BaSO4↓ $F{e^{3 + }}\,\, + \,\,3O{H^ - }$ → Fe(OH)3↓ +) mCu = mX – mFe – mS +) ${n_{N{O_2}}} = 3{n_{Fe}} + 2{n_{Cu}} + 6{n_S} \to {V_{N{O_2}}}$ Lời giải chi tiết :
Coi hỗn hợp X gồm Cu; Fe; S X + HNO3 (đặc, dư) $\xrightarrow{{{t^0}}}$ dung dịch Y gồm: $C{u^{2 + }},\,\,F{e^{3 + }},\,SO_4^{2 - }$, HNO3 dư $Y + \left\{ \begin{gathered}BaCl_2\xrightarrow{{{t^0}}}BaS{O_4} \downarrow \hfill \\dd\,N{H_3} \to Fe{(OH)_3} \downarrow \hfill \\ \end{gathered} \right.$ ${n_{BaS{O_4}}} = 0,2mol;\,{n_{Fe{{(OH)}_3}}} = 0,1\,mol$ $B{a^{2 + }}\, + \,\,SO_4^{2 - }$ $\to BaS{{O}_{4}}\downarrow $ 0,2 ← 0,2 $F{e^{3 + }}\,\, + \,\,3O{H^ - }$ $\to Fe({{OH)}_{3}}\downarrow $ 0,1 ← 0,1 => mCu = mX – mFe – mS = 18,4 – 0,1.56 – 0,2.32 = 6,4 (gam) => nCu = 0,1 mol ${n_{N{O_2}}} = 3{n_{Fe}} + 2{n_{Cu}} + 6{n_S} = 3.0,1 + 2.0,1 + 6.0,2 = 1,7\,\,mol$ $ \to {V_{N{O_2}}} = 1,7.22,4 = 38,08\,\,\,(l)$
Câu 28 :
Cho 0,01 mol một hợp chất của sắt tác dụng hết với H2SO4 đặc nóng (dư), chỉ thấy thoát ra 0,112 lít (ở đktc) khí SO2 (là sản phẩm khử duy nhất). Công thức của hợp chất sắt đó là
Đáp án : C Phương pháp giải :
+) ${n_e} = 2{n_{S{O_2}}}$ +) Từ số mol e mà hợp chất trao đổi => số e nhường Lời giải chi tiết :
${n_{S{O_2}}} = \dfrac{{0,112}}{{22,4}} = 0,005mol\,\, \to \,\,\,{n_e} = 2{n_{S{O_2}}} = 0,01\,\,mol$ => số mol e mà hợp chất trao đổi = 0,01 mol => số e nhường bằng 1 => FeO
Câu 29 :
Để luyện được 800 tấn gang có hàm lượng sắt 95%, cần dùng x tấn quặng manhetit chứa 80% Fe3O4 (còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt bị hao hụt trong quá trình sản xuất là 1%. Giá trị của x là
Đáp án : B Phương pháp giải :
+) Tính khối lượng Fe có trong gang +) Vì sắt bị hao hụt 1% => khối lượng Fe có trong quặng → khối lượng Fe3O4 trong quặng => x Lời giải chi tiết :
m Fe (gang) = $\dfrac{{800.95}}{{100}}$ = 760 tấn Vì sắt bị hao hụt 1% → mFe (quặng) = $\dfrac{{760.100}}{{99}}$ = 767,68 tấn → ${m_{F{e_3}{O_4}}}$ = $\dfrac{{767,68}}{{56.3}}.(56.3 + 16.4)$ = 1060,129 tấn → x = $\dfrac{{1060,129.100}}{{80}}$ = 1325,16 tấn
Câu 30 :
Cho các phát biểu: (1) Nhôm là một kim loại lưỡng tính; (2) CrO3 là oxit lưỡng tính; (3) Al2O3 là oxit lưỡng tính; Al(OH)3 là hidroxit lưỡng tính. Số phát biểu đúng là
Đáp án : B Lời giải chi tiết :
(1) sai, không có khái niệm kim loại lưỡng tính (2) sai, CrO3 là oxit axit (3) (4) đúng Vậy có 2 phát biểu đúng
Câu 31 :
Cho 34,138 gam hỗn hợp X gồm FeCl2 và CrCl3 tác dụng với lượng dư dung dịch NaOH, thu được dung dịch Y và kết tủa Z. Lọc lấy Z rồi nung trong không khí đến khối lượng không đổi thì thu được 11,52 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Khối lượng của CrCl3 trong X là
Đáp án : A Phương pháp giải :
Bảo toàn nguyên tố Fe: \({n_{FeC{l_2}}} = 2{n_{F{e_2}{O_3}}}\) \( \to {m_{CrC{l_3}}} = {m_X} - {m_{FeC{l_2}}}\) Lời giải chi tiết :
PTHH: FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl CrCl3 + 4NaOH → NaCrO2 + NaCl + 2H2O 4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O \({n_{F{e_2}{O_3}}} = \dfrac{{11,52}}{{160}} = 0,072\,\,mol\) Bảo toàn nguyên tố Fe: \({n_{FeC{l_2}}} = 2{n_{F{e_2}{O_3}}}\) = 0,144 mol \( \to {m_{CrC{l_3}}} = {m_X} - {m_{FeC{l_2}}}\) = 34,138 - 0,144.127 = 15,85 gam
|












