Trắc nghiệm Bài 22. Sự điện phân - Hóa 12Đề bài
Câu 1 :
Sản phẩm thu được khi điện phân NaOH nóng chảy là gì ?
Câu 2 :
Trong quá trình điện phân dung dịch AgNO3, ở cực dương xảy ra phản ứng
Câu 3 :
Ở cực âm (catot) bình điện phân nào có xảy ra quá trình đầu tiên 2H2O + 2e →2OH- + H2 khi điện phân dung dịch ?
Câu 4 :
Điện phân với điện cực trơ, màng ngăn xốp một dung dịch chứa các ion Fe2+, Fe3+, Cu2+ và Cl-. Thứ tự điện phân xảy ra ở catot (theo chiều từ trái sang phải) là
Câu 5 :
Phương trình điện phân dung dịch CuSO4 với điện cực trơ là
Câu 6 :
Điện phân dung dịch NaCl điện cực trơ, không có vách ngăn. Sản phấm thu được gồm
Câu 7 :
Cho dung dịch chứa các ion: Na+, Al3+, Cu2+, Cl-, SO42-, NO3- . Các ion không bị điện phân khi ở trạng thái dung dịch là:
Câu 8 :
Cho 4 dung dịch muối: CuSO4, K2SO4, NaCl, KNO3. Dung dịch nào sau điện phân cho ra một dung dịch axit ?
Câu 9 :
Điện phân NaCl nóng chảy bằng điện cực trơ, ở catot thu được
Câu 10 :
Khi điện phân dung dịch KCl và dung dịch CuCl2 bằng điện cực trơ, ở cực dương đều xảy ra quá trình đầu tiên là
Câu 11 :
Khi điện phân điện cực trơ có màng ngăn dung dịch hỗn hợp gồm NaCl và CuSO4 đến khi NaCl và CuSO4 đều hết nếu dung dịch sau điện phân hoà tan được Fe và sinh khí thì dung dịch sau điện phân chắc chắn chứa
Câu 12 :
Trong bình điện phân với điện cực trơ có xảy ra quá trình: 2H2O → 4H+ + O2 + 4e ở cực dương (anot) khi điện phân dung dịch:
Câu 13 :
Trong quá trình điện phân dung dịch NaCl bằng điện cực trơ có màng ngăn xốp xảy ra phản ứng
Câu 14 :
lon Mg2+ bị khử trong trường hợp
Câu 15 :
Điện phân dung dịch X chứa hỗn hợp các muối sau: CaCl2, FeCl3, ZnCl2, CuCl2. Kim loại thoát ra đầu tiên ở catot là
Câu 16 :
Điện phân một dung dịch có chứa H2SO4, CuSO4. pH của dung dịch biến đối như thế nào theo thời gian điện phân?
Câu 17 :
Muốn mạ niken (mạ kền) một vật bằng sắt người ta phải dùng catot là vật bằng sắt, anôt làm bằng Ni, dung dịch điện li là dung dịch muối niken (NiSO4 chẳng hạn). Phương trình hoá học của phản ứng xảy ra ở điện cực âm là:
Câu 18 :
Có các bán phản ứng sau: (1) Cu2+(dd) + 2e → Cu(r) (2) Cu(r) → Cu2+(dd) + 2e (3) 2H2O + 2e → H2 + 2OH-(dd) (4) 2H2O→ O2 + 4H+ + 4e (5) 2Br-(dd) → Br2(dd) + 2e (6) 2H+(dd) + 2e →H2 Những bán phản ứng xảy ra ở catot trong quá trình điện phân là
Câu 19 :
Điện phân dung dịch chứa a mol CuSO4 và b mol NaCl với 2a < b (điện cực trơ). Cho vài giọt quì vào dung dịch, màu của dung dịch sẽ biến đổi thế nào trong quá trình điện phân:
Câu 20 :
Điện phân nóng chảy Al2O3 với điện cực anot than chì và hiệu suất phản ứng bằng 100%, cường độ dòng điện là 150000A trong thời gian t giờ thì thu được 252 kg Al tại catot. Giá trị t gần nhất với giá trị nào
Câu 21 :
Phát biểu nào sau đây là sai?
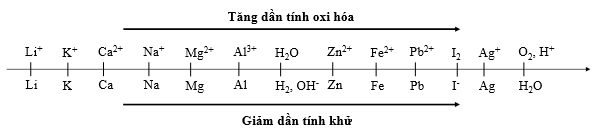
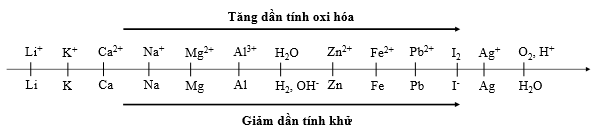
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch: * Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. + Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-,...). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e + Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O * Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. + Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước. + Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+,... Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH- Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Cu(NO3)2, Fe(NO3)2, Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì. Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuSO4. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết Cu = 64; S = 32 và O = 16. Câu 22
Trong thí nghiệm 1, thứ tự điện phân tại catot là
Câu 23
Khi bắt đầu xuất hiện khí ở catot thì dừng điện phân. Chất tan có trong dung dịch sau điện phân là
Câu 24
Trong thí nghiệm 2, thể tích khí thoát ra tại anot ở điều kiện tiêu chuẩn là
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân: - Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. - Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. Một sinh viên thực hiện thí nghiệm điện phân dung dịch CuSO4 với một điện cực bằng graphit và một điện cực bằng đồng. Thí nghiệm 1: Sinh viên nối điện cực graphit với cực (+) và điện cực đồng với cực (-) của nguồn điện. Thí nghiệm 2: Đảo lại, sinh viên nối điện cực graphit với cực (-) và điện cực đồng với cực (+) của nguồn điện. Câu 25
Trong Thí nghiệm 1, bán phản ứng xảy ra tại catot (-) là
Câu 26
Sau khi kết thúc Thí nghiệm 1, bạn sinh viên rửa sạch catot bằng nước cất sau đó sấy khô và đem cân thấy khối lượng catot tăng lên 28,80 gam so với ban đầu. Biết trong suốt quá trình điện phân không thấy khí thoát ra tại catot. Thể tích khí thoát ra ở anot (đktc) là
Câu 27
Trong Thí nghiệm 2, bán phản ứng xảy ra tại 2 cực của bình điện phân là
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch: + Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. + Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch NaCl bão hòa bằng hệ điện phân sử dụng các điện cực than chì và có màng ngăn xốp. Sau một thời gian bạn sinh viên ngắt dòng điện và thu được dung dịch X. Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên. - Bình (1) chứa 100 ml dung dịch CuSO4 1M. - Bình (2) chứa 100 ml dung dịch AgNO3 1M. Sau thời gian t giây, sinh viên quan sát thấy ở bình (2) bắt đầu xuất hiện khí. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Cu và Ag lần lượt là 64 và 108 đvC.
Câu 28
Trong thí nghiệm 1, bán phản ứng xảy ra tại catot là
Câu 29
Trong thí nghiệm 1, phát biểu nào sau đây đúng khi nói về dung dịch X?
Câu 30
Trong thí nghiệm 2, số gam kim loại Cu bám lên điện cực trong bình (1) tại thời điểm t giây là
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân: *Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. + Nếu điện phân chứa các gốc axit có chứa oxi NO3-, SO42-, PO43-, CO32-, ClO4-, … thì nước sẽ tham gia điện phân theo phương trình: 2H2O → O2 + 4H+ + 4e. + Thứ tự anion bị oxi hóa: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O. *Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. + Nếu điện phân dung dịch có các cation K+, Na+, Ca2+, Ba2+, Mg2+, Al3+ thì nước sẽ tham gia điện phân theo phương trình: 2H2O + 2e → H2 + 2OH-. + Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước. + Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag, … thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa - khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan). Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2 bằng hệ điện phân sử dụng điện cực Cu. Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2 và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và anot chỉ thoát ra 1 khí duy nhất. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5. Câu 31
Từ Thí nghiệm 1, cho biết bán phản ứng nào xảy ra ở anot?
Câu 32
Nếu trong Thí nghiệm 1, sinh viên đó thay điện cực Cu bằng điện cực than chì thì bán phản ứng xảy ra ở anot là:
Câu 33
Từ Thí nghiệm 2, khối lượng dung dịch giảm là
Lời giải và đáp án
Câu 1 :
Sản phẩm thu được khi điện phân NaOH nóng chảy là gì ?
Đáp án : A Lời giải chi tiết :
NaOH → Na + O2 + 2H2O => ở catot (-): Na và ở anot (+): O2 và H2O.
Câu 2 :
Trong quá trình điện phân dung dịch AgNO3, ở cực dương xảy ra phản ứng
Đáp án : B Lời giải chi tiết :
Cực dương (+):2H2O → O2 + 4H+ + 4e
Câu 3 :
Ở cực âm (catot) bình điện phân nào có xảy ra quá trình đầu tiên 2H2O + 2e →2OH- + H2 khi điện phân dung dịch ?
Đáp án : A Lời giải chi tiết :
- Điện phân nước xảy ra khi cation không bị điện phân => cation không bị điện phân là K+
Câu 4 :
Điện phân với điện cực trơ, màng ngăn xốp một dung dịch chứa các ion Fe2+, Fe3+, Cu2+ và Cl-. Thứ tự điện phân xảy ra ở catot (theo chiều từ trái sang phải) là
Đáp án : C Lời giải chi tiết :
Thứ tự điện phân là: Fe3+, Cu2+, Fe2+.
Câu 5 :
Phương trình điện phân dung dịch CuSO4 với điện cực trơ là
Đáp án : D Lời giải chi tiết :
Phương trình điện phân dung dịch CuSO4: 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Câu 6 :
Điện phân dung dịch NaCl điện cực trơ, không có vách ngăn. Sản phấm thu được gồm
Đáp án : D Lời giải chi tiết :
Phương trình điện phân có màng ngăn: 2NaCl + 2H2O → 2NaOH + H2 + Cl2 Nếu không có màng ngăn thì: Cl2 + 2NaOH → NaCl + NaClO + H2O => phương trình điện phân: NaCl + H2O → NaClO + H2
Câu 7 :
Cho dung dịch chứa các ion: Na+, Al3+, Cu2+, Cl-, SO42-, NO3- . Các ion không bị điện phân khi ở trạng thái dung dịch là:
Đáp án : A Lời giải chi tiết :
Các ion không bị điện phân khi ở trạng thái dung dịch là: Na+, Al3+ , SO42-, NO3-
Câu 8 :
Cho 4 dung dịch muối: CuSO4, K2SO4, NaCl, KNO3. Dung dịch nào sau điện phân cho ra một dung dịch axit ?
Đáp án : B Lời giải chi tiết :
Dung dịch điện phân cho ra axit => cation bị điện phân => dung dịch CuSO4 Phương trình điện phân : 2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
Câu 9 :
Điện phân NaCl nóng chảy bằng điện cực trơ, ở catot thu được
Đáp án : B Lời giải chi tiết :
Catot là cực (-) có ion Na+ => thu được Na
Câu 10 :
Khi điện phân dung dịch KCl và dung dịch CuCl2 bằng điện cực trơ, ở cực dương đều xảy ra quá trình đầu tiên là
Đáp án : C Lời giải chi tiết :
Cực (+) có ion Cl- đi về, xảy ra phản ứng: 2Cl- → Cl2 + 2e.
Câu 11 :
Khi điện phân điện cực trơ có màng ngăn dung dịch hỗn hợp gồm NaCl và CuSO4 đến khi NaCl và CuSO4 đều hết nếu dung dịch sau điện phân hoà tan được Fe và sinh khí thì dung dịch sau điện phân chắc chắn chứa
Đáp án : D Lời giải chi tiết :
Ta thấy khi điện phân hết NaCl và CuSO4 thì chỉ có Cu2+ và Cl- bị điện phân hết tạo Cu và Cl2 .Mà dung dịch sau điện phân hòa tan được Fe và sinh khí => dung dịch sau điện phân chứa axit => dung dịch chắc chắn chứa H2SO4 (vì SO42- không bị điện phân)
Câu 12 :
Trong bình điện phân với điện cực trơ có xảy ra quá trình: 2H2O → 4H+ + O2 + 4e ở cực dương (anot) khi điện phân dung dịch:
Đáp án : C Lời giải chi tiết :
H2O bị điện phân ở cực dương => anion của muối không bị điện phân => muối đó là Na2SO4
Câu 13 :
Trong quá trình điện phân dung dịch NaCl bằng điện cực trơ có màng ngăn xốp xảy ra phản ứng
Đáp án : B Lời giải chi tiết :
Ở catot (-) 2H2O + 2e → H2 + 2OH- Ở anot (+) 2Cl- → Cl2 + 2e => phân tử H2O bị khử ở catot.
Câu 14 :
lon Mg2+ bị khử trong trường hợp
Đáp án : B Lời giải chi tiết :
lon Mg2+ bị khử trong trường hợp : Điện phân MgCl2 nóng chảy.
Câu 15 :
Điện phân dung dịch X chứa hỗn hợp các muối sau: CaCl2, FeCl3, ZnCl2, CuCl2. Kim loại thoát ra đầu tiên ở catot là
Đáp án : D Phương pháp giải :
Xem lại lý thuyết điện phân Lời giải chi tiết :
Thứ tự điện phân: Fe3+ , Cu2+, Fe2+, Zn2+ => kim loại thu được đầu tiên là Cu
Câu 16 :
Điện phân một dung dịch có chứa H2SO4, CuSO4. pH của dung dịch biến đối như thế nào theo thời gian điện phân?
Đáp án : B Phương pháp giải :
Xem lại lí thuyết điện phân Lời giải chi tiết :
Ở catot: Cu2+ + 2e → Cu 2H+ + 2e → H2 Ở anot: 2H2O → 4H+ + O2 + 4e => Lượng H+ luôn sinh ra làm pH giảm dần
Câu 17 :
Muốn mạ niken (mạ kền) một vật bằng sắt người ta phải dùng catot là vật bằng sắt, anôt làm bằng Ni, dung dịch điện li là dung dịch muối niken (NiSO4 chẳng hạn). Phương trình hoá học của phản ứng xảy ra ở điện cực âm là:
Đáp án : D Lời giải chi tiết :
Điện cực âm (catot) xảy ra phản ứng: Ni2+ + 2e → Ni
Câu 18 :
Có các bán phản ứng sau: (1) Cu2+(dd) + 2e → Cu(r) (2) Cu(r) → Cu2+(dd) + 2e (3) 2H2O + 2e → H2 + 2OH-(dd) (4) 2H2O→ O2 + 4H+ + 4e (5) 2Br-(dd) → Br2(dd) + 2e (6) 2H+(dd) + 2e →H2 Những bán phản ứng xảy ra ở catot trong quá trình điện phân là
Đáp án : B Phương pháp giải :
Xem lại lý thuyết điện phân Lời giải chi tiết :
Những bán phản ứng xảy ra ở catot trong quá trình điện phân là điện phân cation và nước (1) Cu2+(dd) + 2e →Cu(r) (3) 2H2O + 2e → H2 + 2OH-(dd) (6) 2H+(dd) + 2e →H2
Câu 19 :
Điện phân dung dịch chứa a mol CuSO4 và b mol NaCl với 2a < b (điện cực trơ). Cho vài giọt quì vào dung dịch, màu của dung dịch sẽ biến đổi thế nào trong quá trình điện phân:
Đáp án : B Phương pháp giải :
Xem lại lý thuyết điện phân Lời giải chi tiết :
Ở catot: Cu2+ + 2e → Cu a 2a 2H2O + 2e → H2 + 2OH- Ở anot: 2Cl- + 2e → Cl2 b b Vì 2a < b => khi chưa điện phân hết Cl- ở anot thì ở catot nước đã bị điện phân tạo OH- => màu của dung dịch chuyển từ đỏ sang tím sang xanh
Câu 20 :
Điện phân nóng chảy Al2O3 với điện cực anot than chì và hiệu suất phản ứng bằng 100%, cường độ dòng điện là 150000A trong thời gian t giờ thì thu được 252 kg Al tại catot. Giá trị t gần nhất với giá trị nào
Đáp án : B Phương pháp giải :
Ta có tại A thì Al+3 +3e → Al → ne = \(\dfrac{{I.t}}{{96500}}\) ( t đo theo s) Lời giải chi tiết :
Ta có tại A thì Al+3 +3e → Al nAl = 9,33 kmol = 93333 mol → ne = 28000 = \(\dfrac{{150000.t}}{{96500}}\)→ t = 18013s = 5 giờ
Câu 21 :
Phát biểu nào sau đây là sai?
Đáp án : D Lời giải chi tiết :
Đáp án D sai, do một số dung dịch có chứa ion không điện phân được trong dung dịch như: NaCl, K2SO4, MgCl2,... (ion kim loại đứng trước Zn trong dãy hoạt động hóa học) thì khi đó catot sẽ không xuất hiện kim loại mà là khí H2 (nước bị điện phân) Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch: * Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. + Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-,...). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e + Thứ tự anion bị điện phân: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O * Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. + Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước. + Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+,... Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH- Cho dãy điện hóa sau:
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch X chứa đồng thời AgNO3, Cu(NO3)2, Fe(NO3)2, Al(NO3)3 bằng hệ điện phân sử dụng các điện cực than chì. Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch CuSO4. Sau một thời gian sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot. Biết Cu = 64; S = 32 và O = 16. Câu 22
Trong thí nghiệm 1, thứ tự điện phân tại catot là
Đáp án : A Phương pháp giải :
Khi điện phân dung dịch, ở điện cực catot: + Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước. + Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+,... Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH- Lời giải chi tiết :
Khi điện phân dung dịch, ở điện cực catot: + Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước. + Một số cation không bị điện phân như K+, Na+, Ca2+, Ba2+, Mg2+, Al3+,... Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH- - Ta thấy, ion Al3+ không bị điện phân. - Mặt khác, dựa vào dãy điện hóa ta có tính oxi hóa của các cation kim loại: Ag+ > Cu2+ > Fe2+. Vậy thứ tự điện phân tại catot là: Ag+, Cu2+, Fe2+, H2O. Câu 23
Khi bắt đầu xuất hiện khí ở catot thì dừng điện phân. Chất tan có trong dung dịch sau điện phân là
Đáp án : B Phương pháp giải :
- Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như H2O chưa bị điện phân. - Viết các bán phản ứng xảy ra tại catot và anot. Lời giải chi tiết :
- Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như H2O chưa bị điện phân. - Bán phản ứng điện phân: * Tại catot: Ag+ + 1e → Ag Cu2+ + 2e → Cu Fe2+ + 2e → Fe ⟹ Al3+ không bị điện phân nên còn nguyên trong dung dịch. * Tại anot: Ion NO3- không bị điện phân nên nước điện phân: 2H2O → 4H+ + O2 + 4e Vậy dung dịch sau phản ứng có chứa: Al3+, NO3-, H+ Vậy chất tan có trong dung dịch sau điện phân là Al(NO3)3 và HNO3. Câu 24
Trong thí nghiệm 2, thể tích khí thoát ra tại anot ở điều kiện tiêu chuẩn là
Đáp án : D Phương pháp giải :
Bước 1: Viết các bán phản ứng xảy ra ở catot và anot - Tại catot: Cu2+ + 2e → Cu - Tại anot: 2H2O → 4H+ + O2 + 4e Bước 2: Tính thể tích khí thu được - Từ khối lượng kim loại bám trên catot tính được số mol Cu. - Áp dụng định luật bảo toàn electron tính được số mol O2. Lời giải chi tiết :
Bước 1: Viết các bán phản ứng xảy ra ở catot và anot - Tại catot: Cu2+ + 2e → Cu - Tại anot: 2H2O → 4H+ + O2 + 4e Bước 2: Tính thể tích khí thu được - Ta có: \({n_{Cu}} = \dfrac{{6,4}}{{64}} = 0,1\,\,mol\) - Bảo toàn e: ne(catot) = ne(anot) ⟺ \(2{n_{Cu}} = 4{n_{{O_2}}} \to {n_{{O_2}}} = \dfrac{1}{2}{n_{Cu}} = \dfrac{1}{2}.0,1 = 0,05\left( {mol} \right)\) ⟹ \({V_{{O_2}}} = 0,05.22,4 = 1,12\) (lít) - Vậy thể tích khí thoát ra ở anot là 1,12 lít. Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân: - Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. - Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. Một sinh viên thực hiện thí nghiệm điện phân dung dịch CuSO4 với một điện cực bằng graphit và một điện cực bằng đồng. Thí nghiệm 1: Sinh viên nối điện cực graphit với cực (+) và điện cực đồng với cực (-) của nguồn điện. Thí nghiệm 2: Đảo lại, sinh viên nối điện cực graphit với cực (-) và điện cực đồng với cực (+) của nguồn điện. Câu 25
Trong Thí nghiệm 1, bán phản ứng xảy ra tại catot (-) là
Đáp án : C Phương pháp giải :
Catot của thiết bị là nơi xảy ra bán phản ứng khử. Lời giải chi tiết :
Điện phân dung dịch CuSO4 với catot (-) làm bằng graphit, anot (+) làm bằng Cu: Catot (-): Cu2+ + 2e → Cu Anot (+): 2H2O → 4H+ + O2 + 4e Câu 26
Sau khi kết thúc Thí nghiệm 1, bạn sinh viên rửa sạch catot bằng nước cất sau đó sấy khô và đem cân thấy khối lượng catot tăng lên 28,80 gam so với ban đầu. Biết trong suốt quá trình điện phân không thấy khí thoát ra tại catot. Thể tích khí thoát ra ở anot (đktc) là
Đáp án : B Phương pháp giải :
Bước 1: Tính số mol Cu Khối lượng catot tăng là khối lượng của Cu bám vào => Số mol Cu Bước 2: Tính thể tích khí thu được - Viết bán phản ứng tại các điện cực. - Áp dụng định luật bảo toàn electron để tính lượng O2 sinh ra ở anot ⟹ Thể tích khí thu được ở anot. Lời giải chi tiết :
Bước 1: Tính số mol Cu Khối lượng catot tăng là khối lượng của Cu bám vào \(\to {n_{Cu}} = \dfrac{{28,8}}{{64}} = 0,45\left({mol} \right)\) Bước 2: Tính thể tích khí thu được - Catot (-): Do trong quá trình điện phân không thấy khí thoát ra ở catot nên H2O không bị điện phân tại catot. Cu2+ + 2e → Cu - Anot (+): Ion SO42- không bị điện phân nên H2O bị điện phân. 2H2O → 4H+ + O2 + 4e - BT e: \({n_{e(cat{\rm{o}}t)}} = {n_{e(an{\rm{o}}t)}} \Leftrightarrow 2{n_{Cu}} = 4{n_{{O_2}}}\) \(\Rightarrow {n_{{O_2}}} = \dfrac{1}{2}{n_{Cu}} = \dfrac{1}{2}.0,45 = 0,225\left({mol} \right)\) \({V_{{O_2}}} = 0,225.22,4 = 5,04\left(l \right)\). Câu 27
Trong Thí nghiệm 2, bán phản ứng xảy ra tại 2 cực của bình điện phân là
Đáp án : D Phương pháp giải :
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa; catot của thiết bị là nơi xảy ra bán phản ứng khử. - Khi điện phân dung dịch sử dụng kim loại làm cực dương trùng với ion kim loại bị điện phân thì sẽ xảy ra hiện tượng dương cực tan. Lời giải chi tiết :
- Tại catot xảy ra bán phản ứng: Cu2+ + 2e → Cu. - Tại anot xảy ra bán phản ứng: Cu → Cu2+ + 2e (cực dương tan dần nên được gọi là hiện tượng dương cực tan). Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân khi điện phân dung dịch: + Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. + Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. Cho dãy điện hóa sau:
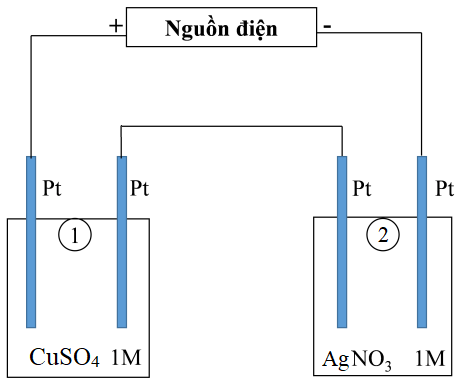
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch NaCl bão hòa bằng hệ điện phân sử dụng các điện cực than chì và có màng ngăn xốp. Sau một thời gian bạn sinh viên ngắt dòng điện và thu được dung dịch X. Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân theo sơ đồ như hình bên. - Bình (1) chứa 100 ml dung dịch CuSO4 1M. - Bình (2) chứa 100 ml dung dịch AgNO3 1M. Sau thời gian t giây, sinh viên quan sát thấy ở bình (2) bắt đầu xuất hiện khí. Biết trong hệ điện phân nối tiếp, số điện tử truyền dẫn trong các bình là như nhau. Nguyên tử khối của Cu và Ag lần lượt là 64 và 108 đvC.
Câu 28
Trong thí nghiệm 1, bán phản ứng xảy ra tại catot là
Đáp án : C Phương pháp giải :
Catot của thiết bị là nơi xảy ra bán phản ứng khử. Lời giải chi tiết :
Khi điện phân dung dịch, tại catot ion Na+ không bị điện phân nên xảy ra sự điện phân H2O. Bán phản ứng xảy ra tại catot là 2H2O + 2e → H2 + 2OH-. Câu 29
Trong thí nghiệm 1, phát biểu nào sau đây đúng khi nói về dung dịch X?
Đáp án : B Phương pháp giải :
Bước 1: Viết các quá trình điện phân ở hai cực của thiết bị. Bước 2: Đánh giá môi trường của dung dịch sau điện phân. Lời giải chi tiết :
Bước 1: Viết các quá trình điện phân ở hai cực của thiết bị. Bán phản ứng xảy ra trên mỗi điện cực: + Tại catot (-): 2H2O + 2e → 2OH- + H2 + Tại anot (+): 2Cl- → Cl2 + 2e Bước 2: Đánh giá môi trường của dung dịch sau điện phân. Do đó dung dịch thu được có môi trường kiềm nên làm phenolphtalein chuyển sang màu hồng. Câu 30
Trong thí nghiệm 2, số gam kim loại Cu bám lên điện cực trong bình (1) tại thời điểm t giây là
Đáp án : A Phương pháp giải :
Bước 1: Tính số mol e trao đổi của bình 1 - Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như Ag+ bị điện phân vừa hết và H2O chưa bị điện phân. - Viết bán phản ứng điện phân tại catot. Từ số mol Ag+ tính được số mol e trao đổi của bình (2). - Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên ⟹ ne (bình 1) = ne (bình 2). Bước 2: Tính khối lượng Cu thu được - So sánh \({n_{e(binh\,1)}} và 2{n_{C{u^{2 + }}}}\) + Nếu \({n_{e(binh\,1)}} < 2{n_{C{u^{2 + }}}}\) thì Cu2+ chưa bị điện phân hết + Nếu \({n_{e(binh\,1)}} = 2{n_{C{u^{2 + }}}}\) thì Cu2+ đã điện phân hết Lời giải chi tiết :
Bước 1: Tính số mol e trao đổi của bình 1 - Khi bắt đầu xuất hiện khí ở catot tức là H2O vừa điện phân tại catot thì ta dừng lại nên coi như Ag+ bị điện phân vừa hết và H2O chưa bị điện phân. \({n_{AgN{O_3}}} = 0,1.1 = 0,1\left( {mol} \right)\) - Tại catot (-) của bình 2: Ag+ + 1e → Ag 0,1 → 0,1 (mol) ⟹ ne (bình 2) = 0,1 mol. Do 2 bình điện phân mắc nối tiếp nên mol electron trao đổi như nhau nên ⟹ ne (bình 1) = ne (bình 2) = 0,1 mol. Bước 3: Tính khối lượng Cu thu được - Bình (1): \({n_{CuS{O_4}}} = 0,1.1 = 0,1\left( {mol} \right)\) - Ta thấy: \({n_{e(binh\,1)}} < 2{n_{C{u^{2 + }}}}\) nên Cu2+ chưa bị điện phân hết Tại catot (-): Cu2+ + 2e → Cu 0,1 → 0,05 (mol) - Khối lượng Cu bám lên điện cực trong bình (1) là mCu = 0,05.64 = 3,2 (g)
Sự điện phân là quá trình oxi hóa - khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li nhằm thúc đẩy một phản ứng hóa học mà nếu không có dòng điện, phản ứng sẽ không tự xảy ra. Trong thiết bị điện phân: *Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều. + Nếu điện phân chứa các gốc axit có chứa oxi NO3-, SO42-, PO43-, CO32-, ClO4-, … thì nước sẽ tham gia điện phân theo phương trình: 2H2O → O2 + 4H+ + 4e. + Thứ tự anion bị oxi hóa: S2- > I- > Br- > Cl- > RCOO- > OH- > H2O. *Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều. + Nếu điện phân dung dịch có các cation K+, Na+, Ca2+, Ba2+, Mg2+, Al3+ thì nước sẽ tham gia điện phân theo phương trình: 2H2O + 2e → H2 + 2OH-. + Nếu trong dung dịch có nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước. + Nếu điện phân không dùng các anot trơ (graphit, platin) mà dùng các kim loại như Ni, Cu, Ag, … thì các kim loại này dễ bị oxi hóa hơn các anion (thế oxi hóa - khử của chúng thấp hơn) và do đó chúng tan vào dung dịch (anot tan). Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch CuCl2 bằng hệ điện phân sử dụng điện cực Cu. Thí nghiệm 2: Sinh viên đó tiếp tục thực hiện điện phân dung dịch X bao gồm dung dịch Cu(NO3)2 và NaCl. Sau một thời gian, sinh viên quan sát thấy có 6,4 gam kim loại bám vào catot và anot chỉ thoát ra 1 khí duy nhất. Biết nguyên tử khối của Cu, N, O, Na và Cl lần lượt là 64, 14, 16, 23 và 35,5. Câu 31
Từ Thí nghiệm 1, cho biết bán phản ứng nào xảy ra ở anot?
Đáp án : A Phương pháp giải :
Khi điện phân không dùng các anot trơ mà dùng các kim loại thì các kim loại dễ bị oxi hóa hơn các anion và do đó chúng tan vào dung dịch (hiện tượng dương cực tan). Lời giải chi tiết :
Sử dụng điện cực là Cu nên tại anot xảy ra quá trình oxi hóa Cu chứ không phải Cl-. Bán phản ứng xảy ra tại anot (+): Cu → Cu2+ + 2e. Câu 32
Nếu trong Thí nghiệm 1, sinh viên đó thay điện cực Cu bằng điện cực than chì thì bán phản ứng xảy ra ở anot là:
Đáp án : B Lời giải chi tiết :
Sử dụng điện cực bằng than chì thì tại anot sẽ xảy ra quá trình oxi hóa Cl-. Bán phản ứng xảy ra tại anot (+): 2Cl- → Cl2 + 2e. Câu 33
Từ Thí nghiệm 2, khối lượng dung dịch giảm là
Đáp án : A Phương pháp giải :
- Từ số mol kim loại bám trên catot, tính được số mol e trao đổi. - Từ số mol e trao đổi, tính được số mol khí bên anot. Lời giải chi tiết :
- Tại catot (-) có các cation đi về: Cu2+; Na+ và H2O. - Tại anot (+) có các anion đi về: Cl-; NO3- và H2O. \({n_{Cu}} = \dfrac{{6,4}}{{64}} = 0,1\,mol\) - Các quá trình trao đổi electron: + Tại catot (-) xảy ra quá trình khử Cu2+ + 2e → Cu 0,2 ← 0,1 (mol) + Tại anot (+) xảy ra quá trình oxi hóa 2Cl- → Cl2 + 2e - Áp dụng bảo toàn e: \(2{n_{Cu}} = 2{n_{C{l_2}}} \to {n_{C{l_2}}} = {n_{Cu}} = 0,1\,mol\) Ta có: mdd giảm = mCu↓ + mCl2↑ = 6,4 + 0,1.71 = 13,5 gam.
|