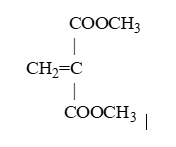Đề thi thử THPT QG môn Hóa trường THPT Chuyên Hưng YênĐề bài
Câu 1 :
Cho các cặp chất (với tỉ lệ số mol tương ứng) như sau: (a) Fe2O3 và Cu (1:1) (b) Fe và Cu (2:1) (c) Zn và Ag (1:1) (d) Fe2(SO4)3 và Cu (1:1) (e) Cu và Ag (2:1) (g) FeCl3 và Cu (1:1) Số cặp chất không tan hoàn toàn trong dung dịch HCl dư là
Câu 2 :
Trong nguyên tử kim loại kiềm ở trạng thái cơ bản có số electron lớp ngoài cùng là
Câu 3 :
Cho các polime sau: nilon 6-6; poli (vinyl clorua); poli (metyl metacrylat); teflon; tơ lapsan; polietilen; polibutadien. Số polime được điều chế bằng phản ứng trùng ngưng là
Câu 4 :
Hợp chất H2N-CH(CH3)-COOH có tên thường là
Câu 5 :
Cho các chất sau: metyl acrylat, vinyl axetat, etyl fomat, tripanmitin, phenyl benzoat. Số chất bị thủy phân trong môi trường kiềm, đun nóng không thu được ancol là
Câu 6 :
Kim loại nào dưới đây không phản ứng được với nước ở nhiệt độ thường?
Câu 7 :
Chất X có công thức phân tử là C6H8O4. Cho 1 mol X phản ứng hết với dung dịch NaOH, đun nóng thu được 1 mol chất Y và 2 mol chất Z. Đun Z với dung dịch H2SO4 đặc ở nhiệt độ thích hợp thì thu được đimetylete. Chất Y phản ứng với dung dịch H2SO4 loãng thu được chất T. Cho T phản ứng với HCl thu được hai sản phẩm là đồng phân cấu tạo của nhau. Phát biểu nào dưới đây đúng?
Câu 8 :
Cho các chất: etilen,axit metacrylic, stiren, ancol benzylic, anilin, toluen, phenol (C6H5OH), CO2, SO2 saccarozo, fructozo. Số chất có khả năng làm mất màu nước brom là
Câu 9 :
Thủy phân hoàn toàn 34,2 gam saccarozo trong môi trường axit thu được dung dịch X. Cho tác dụng với lượng dư dung dịch AgNO3 trong NH3 đun nóng thu được a gam Ag. Nếu cho X tác dụng với dung dịch nước brom dư thì có b gam brom phản ứng. Tổng giá trị (a+b) là
Câu 10 :
Cho một lượng hỗn hợp X gồm 2 chất hữu cơ no, đơn chức, mạch hở (phân tử chỉ chứa C, H, O) tác dụng vừa đủ với 20ml dung dịch NaOH 2M thu được một muối và một ancol. Đun nóng lượng ancol thu được với axit H2SO4 đặc ở 1700C thu được 0,015 mol anken. Nếu đốt cháy một lượng hỗn hợp X như trên rồi cho sản phẩm cháy qua bình CaO dư thì thấy khối lượng bình tăng 7,75 gam. Biết các phản ứng xảy ra hoàn toàn. Phát biểu nào dưới đây đúng?
Câu 11 :
Cho thí nghiệm như hình vẽ: 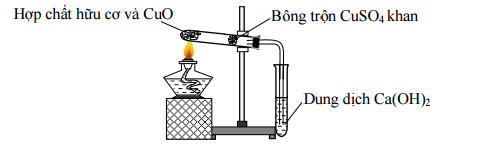 Chọn phát biểu đúng về thí nghiệm trên:
Câu 12 :
Đun nóng 5,16 gam hỗn hợp E gồm ba este X, Y, Z (đều đơn chức, mạch hở và đồng phân cấu tạo của nhau, trong đó X có số mol nhỏ nhất) với một lượng vừa đủ dung dịch NaOH. Sau phản ứng, cô cạn dung dịch thì thu được 4,36 gam chất rắn F gồm hai muối của hai axit cacboxylic kế tiếp nhau trong dãy đồng đẳng và hỗn hợp hơi M. Khi cho tác dụng với lượng dư dung dịch AgNO3 trong NH3 đun nóng đến phản ứng hoàn toàn thì F cho 8,64 gam Ag, còn M cho 6,48 gam Ag. Phần trăm khối lượng của X trong hỗn hợp E là
Câu 13 :
Loại tơ nào sau đây là tơ nhân tạo?
Câu 14 :
Nung nóng 2,13 gam hỗn hợp X gồm 3 kim loại Mg, Zn và Al ở dạng bột với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 1M vừa đủ để phản ứng hết với Y là
Câu 15 :
Khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp chứa a mol Ca(OH)2 và b mol NaOH. Kết quả thí nghiệm được biểu diễn trên đồ thị sau: 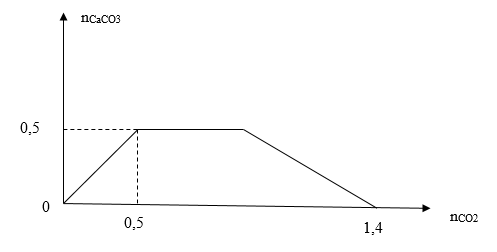 Tỉ lệ a: b là
Câu 16 :
Cho các chất: Ca(OH)2, HCl, H2SO4, CH3OH, Cu, KCl, NaOH. Số chất tác dụng được với dung dịch alanin trong điều kiện thích hợp là
Câu 17 :
Cho các chất: C6H5NH2 (1); CH3NH2 (2); CH3NHCH3 (3); C2H5NH2 (4); NH3 (5). Thứ tự tăng dần lực bazo của các chất trên là
Câu 18 :
Hỗn hợp A gồm 3 peptit mạch hở X, Y và Gly -Ala - Gly (trong đó X, Y có cùng số liên kết peptit và đều được tạo thành từ alanin và valin; MX > MY) có tỉ lệ mol tương ứng là 2:3:1. Đốt cháy hoàn toàn 76,08 gam hỗn hợp A cần 4,356 mol O2 và sinh ra 10,2144 lít N2 (đktc). Số nguyên tử hidro trong phân tử Y là
Câu 19 :
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố Fe(Z = 26) thuộc chu kì nào?
Câu 20 :
Kim loại có độ cứng cao nhất trong các kim loại là
Câu 21 :
Đốt cháy hoàn toàn 0,1 mol một axit cacboxylic cần vừa đủ V lít oxi (đktc) thu được 0,3 mol CO2 và 5,4 gam H2O. Giá trị của V là
Câu 22 :
Chất nào dưới đây là chất không điện li?
Câu 23 :
Chất nào dưới đây không là este?
Câu 24 :
Cho các phát biểu sau: (a) Dung dịch glucozo hòa tan được Cu(OH)2 ở nhiệt độ thường. (b) Axit fomic có khả năng làm mất màu nước brom. (c) Đốt cháy hoàn toàn este no mạch hở luôn thu được số mol CO2 bằng số mol H2O. (d) Dung dịch axit glutamic có pH > 7. (e) Gly-Ala là một đipeptit có phản ứng màu biure. (f) Các loại tơ nilon-6, tơ lapsan, tơ nitron đều được tổng hợp bằng phương pháp trùng ngưng. Số phát biểu đúng là
Câu 25 :
Cho Na, Zn, Fe, Cu, dung dịch Fe(NO3)3, dung dịch Cu(NO3)2, dung dịch AgNO3 lần lượt tác dụng với nhau đôi một. Số trường hợp xảy ra phản ứng ở điều kiện thường là
Câu 26 :
Cho các phát biểu sau: (a) Cấu hình electron của nguyên tử crom (Z = 24) ở trạng thái cơ bản là [Ar]3d54s1. (b) Các kim loại từ Cu về đầu dãy điện hóa đều tác dụng được với dung dịch muối sắt (III). (c) Đinh thép để lâu ngày trong không khí ẩm bị gỉ chủ yếu do xảy ra hiện tượng ăn mòn điện hóa học. (d) Khi thêm dung dịch NaOH vào dung dịch muối natriđicromat, dung dịch chuyển từ màu da cam sang màu vàng. (e) Nước cứng là nước có chứa nhiều ion Cu2+, Zn2+. (f) Nhôm, sắt, crom không tan trong HNO3 loãng, nguội. Số phát biểu đúng là
Câu 27 :
Cho các chất: Al(OH)3, Cr2O3, SO2, CrO3, Al2O3, NH4Cl, CaO, P2O5, Cr(OH)3, SiO2, ZnO, CuO. Số chất tác dụng được với dung dịch NaOH loãng là
Câu 28 :
Điện phân 1 lít dung dịch X gồm Cu(NO3)2 0,6M và FeCl3 0,4M cho đến khi anot thoát ra 17,92 lít khí (đktc) thì dừng lại. Nhấc catot ra khỏi bình điện phân, rồi khuấy đều dung dịch còn lại để phản ứng xảy ra hoàn toàn thấy có khí thoát ra và thu được dung dịch Y có khối lượng giảm m gam so với dung dịch X. Giả thiết kim loại sinh ra đều bám vào catot, sản phẩm khử duy nhất của N+5 là NO. Giá trị gần nhất của m là
Câu 29 :
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H2 và dung dịch Y có chứa 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 vào Y thu được m gam kết tủa. Biết thể tích các khí đo ở đktc. Giá trị gần nhất của m là
Câu 30 :
Chất nào dưới đây thể hiện tính khử khi cho tác dụng với dung dịch H2SO4 loãng?
Câu 31 :
Hấp thụ hết 6,72 lít khí CO2 (đktc) vào 1,25 lít dung dịch Ba(OH)2 0,2M. Khối lượng kết tủa thu được là
Câu 32 :
Kim loại Na không tác dụng được với chất nào dưới đây?
Câu 33 :
Công thức cấu tạo thu gọn của đimetyl amin là
Câu 34 :
Hòa tan hết hỗn hợp X gồm Al, Mg và Al(NO3)3 trong dung dịch chứa NaHSO4 và 0,06 mol NaNO3. Sau phản ứng thu được dung dịch Y chỉ chứa 115,28 gam các muối trung hòa và V lít (đktc) hỗn hợp khí T gồm H2 và N2O (tỉ lệ mol 1:1). Y tác dụng tối đa với 36,8 gam NaOH trong dung dịch và thu được 13,92 gam kết tủa. Giá trị của V là
Câu 35 :
Cho các phát biểu: (1) Nhôm là một kim loại lưỡng tính; (2) CrO3 là oxit lưỡng tính; (3) Al2O3 là oxit lưỡng tính; Al(OH)3 là hidroxit lưỡng tính. Số phát biểu đúng là
Câu 36 :
Thủy phân este X trong môi trường axit thu được metanol và axit etanoic. Công thức cấu tạo của X là
Câu 37 :
Cho bột sắt lần lượt phản ứng với: dung dịch HCl; dung dịch CuSO4; dung dịch HNO3 loãng dư; khí Cl2 (to). Số phản ứng tạo ra muối sắt (III) là
Câu 38 :
Đun nóng m gam hỗn hợp Cu và Fe với tỉ lệ khối lượng tương ứng là 7 : 3 với một lượng dung dịch HNO3. Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít (đktc) hỗn hợp sản phẩm khử gồm NO và NO2. Biết lưọng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là
Câu 39 :
Chất tác dụng với H2 (Ni, to) tạo thành sobitol là
Câu 40 :
Trộn 21,6 gam bột Al với m gam hỗn hợp X gồm (FeO, Fe2O3 và Fe3O4) được hỗn hợp Y. Nung Y ở nhiệt độ cao trong điều kiện không có không khí đến phản ứng hoàn toàn thu được chất rắn Z. Cho Z tác dụng vớii dung dịch NaOH dư thu được 6,72 lít khí. Nếu cho Z tác dụng với HNO3, loãng dư thì thu được 19,04 lít khí NO là sản phẩm khử duy nhất. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
Lời giải và đáp án
Câu 1 :
Cho các cặp chất (với tỉ lệ số mol tương ứng) như sau: (a) Fe2O3 và Cu (1:1) (b) Fe và Cu (2:1) (c) Zn và Ag (1:1) (d) Fe2(SO4)3 và Cu (1:1) (e) Cu và Ag (2:1) (g) FeCl3 và Cu (1:1) Số cặp chất không tan hoàn toàn trong dung dịch HCl dư là
Đáp án : D Phương pháp giải :
Viết các phản ứng xảy ra, chú ý đến tỉ lệ phản ứng, các kim loại có thể không tan trong dd HCl nhưng tan được trong dd muối theo quy tắc anpha Lời giải chi tiết :
(a) Fe2O3 + 6HCl → FeCl2 + 2FeCl3 + 3H2O Cu + 2FeCl3 → CuCl2 + 2FeCl2 → tan hết trong HCl (b) không tan hết vì Cu không tan được trong HCl (c) Ag không tan trong dd HCl (d) Fe2(SO4)3 + Cu → CuSO4 + 2FeSO4 → tan hết trong HCl (e) Cu và Ag không tan được trong dd HCl (g) 2FeCl3 + Cu → CuCl2 + 2FeCl2 → Cu vẫn còn dư không tan hết Vậy các thí nghiệm không tan hoàn toàn được trong dd HCl là: (b); (c); (e); (g) → có 4 thí nghiệm
Câu 2 :
Trong nguyên tử kim loại kiềm ở trạng thái cơ bản có số electron lớp ngoài cùng là
Đáp án : C Lời giải chi tiết :
Các kim loại kiềm có 1 electron lớp ngoài cùng
Câu 3 :
Cho các polime sau: nilon 6-6; poli (vinyl clorua); poli (metyl metacrylat); teflon; tơ lapsan; polietilen; polibutadien. Số polime được điều chế bằng phản ứng trùng ngưng là
Đáp án : A Lời giải chi tiết :
Các polime được điều chế bằng phản ứng trùng ngưng là: nilon 6-6; tơ lapsan → có 2 polime
Câu 4 :
Hợp chất H2N-CH(CH3)-COOH có tên thường là
Đáp án : B Lời giải chi tiết :
H2N-CH(CH3)-COOH có tên thường là alanin.
Câu 5 :
Cho các chất sau: metyl acrylat, vinyl axetat, etyl fomat, tripanmitin, phenyl benzoat. Số chất bị thủy phân trong môi trường kiềm, đun nóng không thu được ancol là
Đáp án : C Phương pháp giải :
các este có dạng: RCOOCH2=CR' ; RCOOCH(R')=CHR'' hoặc RCOOC6H4R' thủy phân trong môi trường kiềm sẽ không thu được ancol với R,R',R'' là các gốc hidrocacbon. Lời giải chi tiết :
metyl acrylat: CH2=CH-COOCH3 thủy phân cho ancol CH3OH vinyl axetat: CH3COOCH=CH2 thủy phân cho andehit CH3CHO etyl fomat: HCOOC2H5 thủy phân cho ancol C2H5OH tripanmitin: (C15H31COO)3C3H5 thủy phân cho ancol C3H5(OH)3 phenyl benzoat: C6H5COOC6H5 thủy phân cho muối C6H5CH2ONa ; C6H5ONa và H2O → có 2 chất thủy phân trong môi trường kiềm không thu được ancol
Câu 6 :
Kim loại nào dưới đây không phản ứng được với nước ở nhiệt độ thường?
Đáp án : B Phương pháp giải :
Các kim loại kiềm và kiềm thổ (trừ Be và Mg) mới có phản ứng với nước ở đk thường. Còn các kim loại khác đều không có pư. Lời giải chi tiết :
Ag không phản ứng với nước ở nhiệt độ thường
Câu 7 :
Chất X có công thức phân tử là C6H8O4. Cho 1 mol X phản ứng hết với dung dịch NaOH, đun nóng thu được 1 mol chất Y và 2 mol chất Z. Đun Z với dung dịch H2SO4 đặc ở nhiệt độ thích hợp thì thu được đimetylete. Chất Y phản ứng với dung dịch H2SO4 loãng thu được chất T. Cho T phản ứng với HCl thu được hai sản phẩm là đồng phân cấu tạo của nhau. Phát biểu nào dưới đây đúng?
Đáp án : C Phương pháp giải :
suy luận, Z là ancol CH3OH; T chứa liên kết đôi C=C và không đối xứng Từ đó suy ra X, Y tương ứng, sau đó xét nhận xét đúng hay sai Lời giải chi tiết :
Z \(\xrightarrow{{{H_2}S{O_4}\,dac,{t^0}}}\) CH3OCH3 → Z là CH3OH → Z không có khả năng làm mất màu dung dịch nước brom → A sai Chất T phản ứng với HBr, thu được hai sản phẩm là đồng phân cấu tạo của nhau → T chứa liên kết đôi C=C và không đối xứng X: C6H8O4 có độ bất bão hòa \(k = \dfrac{{6.2 + 2 - 8}}{2} = 3 = 2{\pi _{COO}} + {\pi _{C = C}}\) Thủy phân 1 mol X trong NaOH thu được Y nối đôi và 2 mol CH3OH → X phải có cấu tạo
→ X phản ứng tối đa với H2(Ni, t0) theo tỉ lệ mol 1:1 → D sai Y là CH2=C(COONa)2 có CTPT là C4H2O2Na2 → B sai T có công thức CH2=CH(COOH)2 không có đồng phân hình học → C đúng
Câu 8 :
Cho các chất: etilen,axit metacrylic, stiren, ancol benzylic, anilin, toluen, phenol (C6H5OH), CO2, SO2 saccarozo, fructozo. Số chất có khả năng làm mất màu nước brom là
Đáp án : C Phương pháp giải :
các chất có liên kết bội kém bền (nối đôi hoặc ba), anlinin, phenol, có gốc -CHO trong phân tử, SO2 thì làm mất màu dd nước brom Lời giải chi tiết :
Các chất có khả năng làm mất màu dd nước Br2 là: etilen (CH2=CH2); axit metacrylic (CH2=CH-COOH);anilin (C6H5NH2); stiren (C6H5CH=CH2); phenol (C6H5OH), SO2 → có 6 chất
Câu 9 :
Thủy phân hoàn toàn 34,2 gam saccarozo trong môi trường axit thu được dung dịch X. Cho tác dụng với lượng dư dung dịch AgNO3 trong NH3 đun nóng thu được a gam Ag. Nếu cho X tác dụng với dung dịch nước brom dư thì có b gam brom phản ứng. Tổng giá trị (a+b) là
Đáp án : D Phương pháp giải :
C12H22O11 \(\xrightarrow{{{H^ + },{t^0}}}\) C6H12O6 (glucozo) + C6H12O6 (fructzo) 0,1 → 0,1 → 0,1 (mol) nAg = 2nGlu + 2nfruc = ? nBr2 = nglu =? Từ đó suy ra được (a+b) = ? Lời giải chi tiết :
nC12H22O11 = 34,2 : 342 = 0,1 (mol) C12H22O11 \(\xrightarrow{{{H^ + },{t^0}}}\) C6H12O6 (glucozo) + C6H12O6 (fructzo) 0,1 → 0,1 → 0,1 (mol) Vì cả glucozo và fructozo đều có phản ứng tráng bạc nên: nAg = 2nGlu + 2nfruc = 4nsac = 0,4 (mol) → mAg = 0,4.108 = 43,2 (g) = a Khi cho X tác dụng với dd Br2 chỉ có glucozo tham gia phản ứng CH2[CH2OH]4CHO + Br2 + H2O → CH2[CH2OH]COOH + 2HBr 0,1 → 0,1 (mol) nBr2 = 0,1 (mol) → mBr2 = 0,1.160 = 16 (g) = b → (a + b) = (43,2 + 16) = 59,2 (g)
Câu 10 :
Cho một lượng hỗn hợp X gồm 2 chất hữu cơ no, đơn chức, mạch hở (phân tử chỉ chứa C, H, O) tác dụng vừa đủ với 20ml dung dịch NaOH 2M thu được một muối và một ancol. Đun nóng lượng ancol thu được với axit H2SO4 đặc ở 1700C thu được 0,015 mol anken. Nếu đốt cháy một lượng hỗn hợp X như trên rồi cho sản phẩm cháy qua bình CaO dư thì thấy khối lượng bình tăng 7,75 gam. Biết các phản ứng xảy ra hoàn toàn. Phát biểu nào dưới đây đúng?
Đáp án : C Phương pháp giải :
Hỗn hợp X ban đầu gồm 1 este no, đơn chức, mạch hở và một axit no, đơn chức, mạch hở Đặt CTPT este: CnH2nO2: 0,015 (mol) (Suy ra từ mol ancol) CTPT axit: CmH2mO2: 0,04 - 0,015 = 0,025 (mol) (Suy ra từ mol NaOH) mbình tăng = mCO2 + mH2O → (0,015n + 0,025m).44 + (0,015n+ 0,025m).18 = 7,75 → 3n + 5m = 25 Do n ≥ 3 và m ≥ 1 và m, n nguyên dương nên kẻ bảng, chạy được giá trị n, m thỏa mãn Từ đó suy ra các chất trong X và nhận xét được nhận định đúng hay sai Lời giải chi tiết :
nNaOH = 0,02.2 = 0,04 (mol) nancol = nanken = 0,015 (mol) → Hỗn hợp X ban đầu gồm 1 este no, đơn chức, mạch hở và một axit no, đơn chức, mạch hở Đặt CTPT este: CnH2nO2: 0,015 (mol) (Suy ra từ mol ancol) CTPT axit: CmH2mO2: 0,04 - 0,015 = 0,025 (mol) (Suy ra từ mol NaOH) BTNT "C": nCO2 = 0,015n + 0,025m BTNT"H": nH2O = 0,015n + 0,025m mbình tăng = mCO2 + mH2O → (0,015n + 0,025m).44 + (0,015n+ 0,025m).18 = 7,75 → 3n + 5m = 25 Do n ≥ 3 và m ≥ 1 và m, n nguyên dương nên ta có n = 5 và m =2 là nghiệm duy nhất Vậy X gồm CH3COOC3H7: 0,015 (mol) và CH3COOH: 0,025 (mol) A. sai, tổng phân tử khối của X bằng 162. B. sai, chất X ứng với CTPT CH3COOC3H7 chỉ có 2 CTCT thỏa mãn là CH3COOCH2CH2CH3 và CH3COOCH(CH3)2 C. đúng, %CH3COOC3H7 = 50,5% và %CH3COOH = 49,50% D. sai, khối lượng của CH3COOC3H7 = 0,015.102 = 1,53 (g)
Câu 11 :
Cho thí nghiệm như hình vẽ:  Chọn phát biểu đúng về thí nghiệm trên:
Đáp án : C Phương pháp giải :
Phân tích hình vẽ: -CuO có tác dụng oxi hóa hợp chất hữu cơ thay cho O2 - CuSO4 khan(màu trắng) sẽ hóa xanh khi gặp H2O (tạo CuSO4.5H2O màu xanh) - Dung dịch Ca(OH)2 sẽ tạo ↓ trắng CaCO3 với khí CO2 Từ đó đưa ra được kết luận đúng Lời giải chi tiết :
Phân tích hình vẽ: -CuO có tác dụng oxi hóa hợp chất hữu cơ thay cho O2 - CuSO4 khan(màu trắng) dùng để định tính nguyên tố hidro (sản phẩm là H2O) vì sẽ hóa xanh khi gặp H2O (tạo CuSO4.5H2O màu xanh) - Dung dịch Ca(OH)2 dùng để định tính nguyên tố cacbon (sản phẩm là CO2) vì sẽ tạo ↓ trắng CaCO3 với khí CO2. → thí nghiệm trên dùng để định tính cacbon và hidro
Câu 12 :
Đun nóng 5,16 gam hỗn hợp E gồm ba este X, Y, Z (đều đơn chức, mạch hở và đồng phân cấu tạo của nhau, trong đó X có số mol nhỏ nhất) với một lượng vừa đủ dung dịch NaOH. Sau phản ứng, cô cạn dung dịch thì thu được 4,36 gam chất rắn F gồm hai muối của hai axit cacboxylic kế tiếp nhau trong dãy đồng đẳng và hỗn hợp hơi M. Khi cho tác dụng với lượng dư dung dịch AgNO3 trong NH3 đun nóng đến phản ứng hoàn toàn thì F cho 8,64 gam Ag, còn M cho 6,48 gam Ag. Phần trăm khối lượng của X trong hỗn hợp E là
Đáp án : D Phương pháp giải :
F tham gia phản ứng tráng bạc → F chứa HCOONa Vì 2 muối đồng đẳng kế tiếp → Muối còn lại trong F là CH3COONa Có neste = nM = ∑nmuối = ? suy ra được CTPT của M Lập luận tiếp tìm ra được CTCT của các chất X,Y,Z Lời giải chi tiết :
F tham gia phản ứng tráng bạc → F chứa HCOONa → nHCOONa = 0,5nAg = 0,04 (mol) Vì 2 muối đồng đẳng kế tiếp → Muối còn lại trong F là CH3COONa \(\dfrac{{4,36 - 0,04.68}}{{82}} = 0,02\,mol\) Có neste = nM = ∑nmuối = 0,04 + 0,02 = 0,06 (mol) → M = 5,16 : 0,06 = 86 → M là C4H6O2 → E chứa: CH3COOCH=CH2: 0,02 (mol); HCOOR: a (mol); HCOOR': b (mol) với a + b = 0,04 M tham gia phản ứng tráng bạc → M chứa andehit. Mặt khác có: nAg = 0,06 mol > 2nCH3COOCH=CH2 = 0,04 (mol) → E chứa 1 este có cấu tạo HCOOCH=CH-CH3 Este còn lại có cấu tạo HCOOCH2-CH=CH2: 0,03 hoặc HCOOC(CH3)=CH2: 0,03 (mol) Vì X có phân tử khối nhỏ nhất nên X là: HCOOCH=CH=CH3 \(\to \% X = \dfrac{{0,01.86}}{{5,16}}.100\% = 16,67\% \)
Câu 13 :
Loại tơ nào sau đây là tơ nhân tạo?
Đáp án : B Phương pháp giải :
Tơ nhân tạo được sản xuất từ polime thiên nhiên nhưng được chế biến thêm bằng con đường hóa học. Lời giải chi tiết :
Tơ nhân tạo là tơ axetat. Các tơ còn lại đều là tơ tổng hợp
Câu 14 :
Nung nóng 2,13 gam hỗn hợp X gồm 3 kim loại Mg, Zn và Al ở dạng bột với oxi thu được hỗn hợp Y gồm các oxit có khối lượng 3,33 gam. Thể tích dung dịch HCl 1M vừa đủ để phản ứng hết với Y là
Đáp án : A Phương pháp giải :
BTKL ta có: mX + mO2 = mOXIT → nO(oxit)=? nHCl = nH+ = 2nO(oxit) = ? Lời giải chi tiết :
BTKL ta có: mX + mO2 = mOXIT → 2,13 + mO2 = 3,33 → mO2 = 1,2 (g) → nO = 1,2 : 16 = 0,075 (mol) Cho Y phản ứng với HCl bản chất xảy ra phản ứng: O2- + 2H+ → H2O 0,075 →0,15 (mol) → nHCl = nH+ = 0,15 (mol) → VHCl = n : V = 0,15 : 1 = 0,15 (lít) = 150 (ml)
Câu 15 :
Khi sục từ từ đến dư khí CO2 vào dung dịch hỗn hợp chứa a mol Ca(OH)2 và b mol NaOH. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:  Tỉ lệ a: b là
Đáp án : A Phương pháp giải :
Chia đồ thị ra làm 3 giai đoạn: + giai đoạn 1: đồ thị đi lên xảy ra phản ứng CO2 + Ca(OH)2 → CaCO3↓ + H2O + giai đoạn 2: đồ thị đi ngang do xảy ra phản ứng CO2 + 2NaOH → Na2CO3 + H2O CO2 + Na2CO3 + H2O → 2NaHCO3 + giai đoạn 3: đồ thị đi xuống do xảy ra phản ứng CO2 + CaCO3 + H2O → Ca(HCO3)2 Lời giải chi tiết :
+ Tại giai đoạn 1: đồ thị đi lên do xảy ra phản ứng: CO2 + Ca(OH)2 → CaCO3↓ + H2O → nCaCO3 max = 0,5 (mol). BTNT "Ca": nCa(OH)2 bđ = 0,5 (mol) = a + Tại giai đoạn 3: đồ thị đi xuống khi hòa tan hoàn toàn kết tủa → Muối thu được gồm: NaHCO3 và Ca(HCO3)2 BTNT "Ca": nCa(HCO3)2 = nCa(OH)2 = 0,5 (mol) BTNT "C": nCO2 = nNaHCO3 + 2nCa(HCO3)2 → 1,4 = b + 2.0,5 → b = 0,4 (mol) Vậy a : b = 0,5 : 0,4 = 5 : 4
Câu 16 :
Cho các chất: Ca(OH)2, HCl, H2SO4, CH3OH, Cu, KCl, NaOH. Số chất tác dụng được với dung dịch alanin trong điều kiện thích hợp là
Đáp án : A Phương pháp giải :
CTCT của alanin là H2N-CH2(CH3) -COOH → chọn các chất có khả năng phản ứng được với nhóm -NH2 hoặc -COOH Lời giải chi tiết :
Các chất tác dụng được với dd alanin (H2N-CH2-COOH) là: Ca(OH)2, HCl, H2SO4, CH3OH, NaOH → có 5 chất
Câu 17 :
Cho các chất: C6H5NH2 (1); CH3NH2 (2); CH3NHCH3 (3); C2H5NH2 (4); NH3 (5). Thứ tự tăng dần lực bazo của các chất trên là
Đáp án : A Phương pháp giải :
Lấy NH3 làm chuẩn, khi thay thế nguyên tử H trong NH3 bằng các nhóm đẩy e thì tính bazo tăng, khi thay bằng nhóm hút e thì tính bazo giảm Các amin no tính bazo: amin bậc 2 > amin bậc 1 ≈ amin bậc 3 Lời giải chi tiết :
Tính bazo tăng theo thứ tự: C6H5NH2 (1) < NH3 (5) < CH3NH2 (2) < C2H5NH2 (4) < CH3NHCH3 (3)
Câu 18 :
Hỗn hợp A gồm 3 peptit mạch hở X, Y và Gly -Ala - Gly (trong đó X, Y có cùng số liên kết peptit và đều được tạo thành từ alanin và valin; MX > MY) có tỉ lệ mol tương ứng là 2:3:1. Đốt cháy hoàn toàn 76,08 gam hỗn hợp A cần 4,356 mol O2 và sinh ra 10,2144 lít N2 (đktc). Số nguyên tử hidro trong phân tử Y là
Đáp án : C Phương pháp giải :
Quy đổi hỗn hợp peptit A thành: \(\left\{ \begin{gathered}CONH:0,912\,(mol)\,(Do\,BTNT\,N) \hfill \\ C{H_2}:\,\,b\,\,(mol) \hfill \\ {H_2}O:c(mol) \hfill \\ \end{gathered} \right.\) Lời giải chi tiết :
nN2(đktc) = 10,2144:22,4 = 0,456 (mol) Quy đổi hỗn hợp peptit A thành: \(\left\{ \begin{gathered}CONH:0,912\,(mol)\,(Do\,BTNT\,N) \hfill \\ C{H_2}:\,\,b\,\,(mol) \hfill \\ {H_2}O:c(mol) \hfill \\ \end{gathered} \right.\) Đốt A chỉ có CONH và CH2 cháy \(\begin{gathered} CONH\, + \frac{3}{4}{O_2}\xrightarrow{{{t^0}}}C{O_2} + \frac{1}{2}{H_2}O + \frac{1}{2}{N_2} \hfill \\ 0,912 \to 0,684\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(mol) \hfill \\ \,\,\,\,\,C{H_2}\,\,\,\,\,\, + \,\,\,\,\,\,1,5{O_2}\,\,\,\,\xrightarrow{{{t^0}}}C{O_2} + {H_2}O \hfill \\ 2,448 \leftarrow (4,356 - 0,684)\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(mol) \hfill \\\end{gathered} \) → nCH2 = 2,448 (mol) = b (mol) BTKL ta có: mA = 0,912.43 + 2,448.14 + 18c = 76,08 → c= 0,144 (mol) Vậy \(\left\{ \begin{gathered}{n_X} = 0,048\,(mol) \hfill \\ {n_Y} = 0,072\,(mol) \hfill \\ {n_Z} = 0,024\,\,(mol) \hfill \\ \end{gathered} \right.\) Đặt số nguyên tử nito có trong X và Y là n BTNT "N" ta có: 0,048n + 0,072n +0,024.3 = 2nN2 = 0,912 → n =7 → X, Y là heptappetit Số mol C trong X, Y là: nC(X,Y) = 0,912 + 2,448 - 0,024.7 = 3,192 (mol) Đặt CTPT \(\begin{gathered} \left\{ \begin{gathered} X:{(Ala)_x}{(Val)_{7 - x}}:0,048 \hfill \\ Y:{(Ala)_y}{(Val)_{7 - y}}:0,072 \hfill \\ \end{gathered} \right. \hfill \\\xrightarrow{{BTNT\,C}}0,048.{\text{[}}(3x + 5(7 - x){\text{]}} + 0,072.{\text{[}}(3y + 5(7 - y){\text{]}} = 3,192 \hfill \\ \xrightarrow{{}}\,0,096x + 0,144y = 1,008 \hfill \\ \xrightarrow{{}}2x + 3y = 21 \hfill \\ do\,x,y\, < 7 \to \left\{ \begin{gathered} x = 6 \hfill \\ y = 3 \hfill \\ \end{gathered} \right.hoac\left\{ \begin{gathered} x = 3 \hfill \\ y = 5 \hfill \\ \end{gathered} \right.\,thoa\,man \hfill \\ \to \left\{ \begin{gathered} X:{(Ala)_6}Val \hfill \\ Y:{(Ala)_3}{(Val)_4} \hfill \\ \end{gathered} \right.hoac\,\left\{ \begin{gathered} X:{(Ala)_3}{(Val)_4} \hfill \\ Y:{(Ala)_5}{(Val)_2} \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} \) Vì đề bài cho MX > MY nên chọn cặp nghiệm \(\,\left\{ \begin{gathered} X:{(Ala)_3}{(Val)_4} \hfill \\Y:{(Ala)_5}{(Val)_2} \hfill \\ \end{gathered} \right.\) → CTPT của Y là: 5C3H7NO2 + 2C5H11NO2 - 6H2O = C25H45O8N7 → Số nguyên tử H có trong Y là 45
Câu 19 :
Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố Fe(Z = 26) thuộc chu kì nào?
Đáp án : D Phương pháp giải :
Viết cấu hình e của Fe sau đó có bao nhiêu lớp e thì Fe thuộc chu kì đó Lời giải chi tiết :
Fe (Z = 26) có cấu hình: [Ar]3d64s2 → Có 4 lớp => thuộc chu kì 4 trong bảng hệ thống tuần hoàn.
Câu 20 :
Kim loại có độ cứng cao nhất trong các kim loại là
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về đại cương kim loại Lời giải chi tiết :
Kim loại có độ cứng cao nhất trong các kim loại là Cr (cứng có thể rạch được cả thủy tinh)
Câu 21 :
Đốt cháy hoàn toàn 0,1 mol một axit cacboxylic cần vừa đủ V lít oxi (đktc) thu được 0,3 mol CO2 và 5,4 gam H2O. Giá trị của V là
Đáp án : C Phương pháp giải :
Ta thấy: nCO2 = nH2O => Axit là axit no, đơn chức, mạch hở => nO(axit) = 2naxit = ? CnH2nO2 + (3n-2)/2 O2 → nCO2 + nH2O BTNT "O": nO(axit) + 2nO2 = 2nCO2 + nH2O Thay số tính được số mol của O2. Lời giải chi tiết :
nH2O = 5,4 : 18 = 0,3 mol Ta thấy: nCO2 = nH2O => Axit là axit no, đơn chức, mạch hở => nO(axit) = 2naxit = 0,2 mol CnH2nO2 + (3n-2)/2 O2 → nCO2 + nH2O BTNT "O": nO(axit) + 2nO2 = 2nCO2 + nH2O => 0,2 + 2nO2 = 2.0,3 + 0,3 => nO2 = 0,35 mol => VO2 = 0,35.22,4 = 7,84 lít
Câu 22 :
Chất nào dưới đây là chất không điện li?
Đáp án : D Lời giải chi tiết :
C2H5OH là chất không điện li.
Câu 23 :
Chất nào dưới đây không là este?
Đáp án : B Lời giải chi tiết :
Dựa vào định nghĩa về este: Este là chất hữu cơ có dạng RCOOR' với R' là gốc hidrocacbon và R là H hoặc gốc hidrocacbon. CH3COCH3 là hợp chất xeton, không phải là este.
Câu 24 :
Cho các phát biểu sau: (a) Dung dịch glucozo hòa tan được Cu(OH)2 ở nhiệt độ thường. (b) Axit fomic có khả năng làm mất màu nước brom. (c) Đốt cháy hoàn toàn este no mạch hở luôn thu được số mol CO2 bằng số mol H2O. (d) Dung dịch axit glutamic có pH > 7. (e) Gly-Ala là một đipeptit có phản ứng màu biure. (f) Các loại tơ nilon-6, tơ lapsan, tơ nitron đều được tổng hợp bằng phương pháp trùng ngưng. Số phát biểu đúng là
Đáp án : C Lời giải chi tiết :
(a) đúng (b) đúng do axit fomic có CTCT là HCOOH chứa nhóm -CHO (c) sai vì đốt cháy este no, đơn chức, mạch hở thu được nCO2 = nH2O (d) sai vì dung dịch axit glutamic có môi trường axit làm cho quỳ tím chuyển đỏ (e) sai vì đipeptit không có phản ứng màu biure (f) sai vì tơ nitron được tổng hợp bằng phương pháp trùng hợp Vậy có 2 phát biểu đúng
Câu 25 :
Cho Na, Zn, Fe, Cu, dung dịch Fe(NO3)3, dung dịch Cu(NO3)2, dung dịch AgNO3 lần lượt tác dụng với nhau đôi một. Số trường hợp xảy ra phản ứng ở điều kiện thường là
Đáp án : C Phương pháp giải :
Dựa vào tính chất hóa học của các chất để xác định các phản ứng có thể xảy ra. Lời giải chi tiết :
Các trường hợp xảy ra phản ứng ở điều kiện thường: - Na + dd Fe(NO3)3 - Na + dd Cu(NO3)2 - Na + dd AgNO3 -Zn + dd Fe(NO3)3 - Zn + dd Cu(NO3)2 - Zn + dd AgNO3 - Fe + dd Fe(NO3)3 - Fe + dd Cu(NO3)2 - Fe + dd AgNO3 - Cu + dd Fe(NO3)3 - Cu + dd AgNO3 Vậy có tất cả 11 trường hợp có thể xảy ra phản ứng
Câu 26 :
Cho các phát biểu sau: (a) Cấu hình electron của nguyên tử crom (Z = 24) ở trạng thái cơ bản là [Ar]3d54s1. (b) Các kim loại từ Cu về đầu dãy điện hóa đều tác dụng được với dung dịch muối sắt (III). (c) Đinh thép để lâu ngày trong không khí ẩm bị gỉ chủ yếu do xảy ra hiện tượng ăn mòn điện hóa học. (d) Khi thêm dung dịch NaOH vào dung dịch muối natriđicromat, dung dịch chuyển từ màu da cam sang màu vàng. (e) Nước cứng là nước có chứa nhiều ion Cu2+, Zn2+. (f) Nhôm, sắt, crom không tan trong HNO3 loãng, nguội. Số phát biểu đúng là
Đáp án : C Phương pháp giải :
Xem lại lý thuyết về crom và hợp chất của crom, ăn mòn kim loại, nước cứng Lời giải chi tiết :
(a) (b) (c) (d) đúng (e) sai. Nước cứng là nước chứa nhiều ion Ca2+ và Mg2+ (f) sai, vì Al, Fe, Cr không tan trong dung dịch HNO3 đặc, nguội Vậy có 4 phát biểu đúng
Câu 27 :
Cho các chất: Al(OH)3, Cr2O3, SO2, CrO3, Al2O3, NH4Cl, CaO, P2O5, Cr(OH)3, SiO2, ZnO, CuO. Số chất tác dụng được với dung dịch NaOH loãng là
Đáp án : D Lời giải chi tiết :
Các chất tác dụng được với NaOH loãng: Al(OH)3; SO2; CrO3; Al2O3; NH4Cl; CaO; P2O5; Cr(OH)3; ZnO Chú ý: Cr2O3, SiO2 phản ứng với NaOH đặc. Vậy có tất cả 9 chất
Câu 28 :
Điện phân 1 lít dung dịch X gồm Cu(NO3)2 0,6M và FeCl3 0,4M cho đến khi anot thoát ra 17,92 lít khí (đktc) thì dừng lại. Nhấc catot ra khỏi bình điện phân, rồi khuấy đều dung dịch còn lại để phản ứng xảy ra hoàn toàn thấy có khí thoát ra và thu được dung dịch Y có khối lượng giảm m gam so với dung dịch X. Giả thiết kim loại sinh ra đều bám vào catot, sản phẩm khử duy nhất của N+5 là NO. Giá trị gần nhất của m là
Đáp án : A Phương pháp giải :
Viết các bán phản ứng tại 2 điện cực; bảo toàn electron; bảo toàn điện tích CT e trao đổi: ne = It/F. Lời giải chi tiết :
Catot : Fe3+ + 1e → Fe2+ Cu2+ + 2e → Cu Fe2+ + 2e → Fe Anot : 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e nkhí = 0,8 mol gồm : 0,6 mol Cl2 ; 0,2 mol O2 => ne trao đổi = 2 mol Catot thoát ra : nCu= 0,6 ; nFe = 0,2 mol Phần dung dịch còn lại chứa : 0,2 mol Fe2+ ; 1,2 mol NO3- => H+ có 0,8 mol (Bảo toàn điện tích) 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O 0,2 → 0,2/3 (mol) => mX – mY = mCu + mFe + mO2 + mCl2 + mNO = 100,6g
Câu 29 :
Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hòa tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H2 và dung dịch Y có chứa 20,52 gam Ba(OH)2. Hấp thụ hoàn toàn 6,72 lít khí CO2 vào Y thu được m gam kết tủa. Biết thể tích các khí đo ở đktc. Giá trị gần nhất của m là
Đáp án : B Phương pháp giải :
Quy đổi hỗn hợp thành: Na (x mol); Ba (0,12 mol) và O (y mol) + mX => (1) + BT electron: nNa + 2nBa = 2nO + 2nH2 => (2) Giải hệ (1) và (2) được x và y Xác định thành phần dung dịch Y. Áp dụng bảo toàn điện tích để tính số mol của OH- *Hấp thụ 0,3 mol CO2 vào dung dịch Y: Tính tỉ lệ nOH-/nCO2 => Xác định các muối tạo thành Lời giải chi tiết :
nBa(OH)2 = 20,52 : 171 = 0,12 mol; nH2 = 1,12 : 22,4 = 0,05 mol Quy đổi hỗn hợp thành: Na (x mol); Ba (0,12 mol) và O (y mol) + mX = 23x + 137.0,12 + 16y = 21,9 (1) + BT electron: nNa + 2nBa = 2nO + 2nH2 => x + 2.0,12 = 2y + 2.0,05 (2) Giải hệ (1) và (2) được x = y = 0,14 mol Dung dịch Y gồm: Na+ (0,14 mol); Ba2+ (0,12 mol) và OH- BTĐT => nOH- = nNa+ + 2nBa2+ = 0,14 + 2.0,12 = 0,38 mol *Hấp thụ 0,3 mol CO2 vào dung dịch Y: Tỉ lệ: 1 < nOH- : nCO2 = 0,38 : 0,3 = 1,27 < 2 => Tạo CO32- và HCO3- CO2 + 2OH- → CO32- + H2O a 2a a CO2 + OH- → HCO3- b b b + nCO2 = a + b = 0,3 + nOH- = 2a + b = 0,38 Giải hệ được a = 0,08 và b = 0,22 So sánh thấy: \({n_{B{a^{2 + }}}} > {n_{CO_3^{2 - }}}\) nên Ba2+ dư so với CO32- => nBaCO3 = \({n_{CO_3^{2 - }}}\) = 0,08 mol => m kết tủa = 0,08.197 = 15,76 gam gần nhất với 15,5 gam
Câu 30 :
Chất nào dưới đây thể hiện tính khử khi cho tác dụng với dung dịch H2SO4 loãng?
Đáp án : A Phương pháp giải :
Chất khử là chất nhường e để lên mức oxi hóa cao hơn. Lời giải chi tiết :
Chất khử là chất nhường e để lên mức oxi hóa cao hơn. Fe + H2SO4 → FeSO4 + H2 => Fe thể hiện tính khử
Câu 31 :
Hấp thụ hết 6,72 lít khí CO2 (đktc) vào 1,25 lít dung dịch Ba(OH)2 0,2M. Khối lượng kết tủa thu được là
Đáp án : C Phương pháp giải :
Tính tỉ lệ nOH-/nCO2 = (*) + Nếu (*) ≥ 2 => Tạo muối CO32- + nếu 1 < (*) < 2 => Tạo muối CO32-và HCO3- + Nếu (*) ≤ 1 => Tạo muối HCO3- Lời giải chi tiết :
nCO2 = 0,3 mol; nBa(OH)2 = 1,25.0,2 = 0,25 mol => nBa2+ = nBa(OH)2 = 0,25 mol; nOH- = 2nBa(OH)2 = 0,5 mol Tỉ lệ: 1 < nOH- : nCO2 = 0,5 : 0,3 = 1,67 < 2 => Tạo muối CO32- và HCO3- CO2 + 2OH- → CO32- + H2O x 2x x CO2 + OH- → HCO3- y y y nCO2 = x + y = 0,3 nOH- = 2x + y = 0,5 Giải hệ được x = 0,2; y = 0,1 So sánh: \({n_{B{a^{2 + }}}} > {n_{CO_3^{2 - }}}\) => Ba2+ dư so với CO32- => nBaCO3 = \({n_{CO_3^{2 - }}}\) = 0,2mol => m kết tủa = 0,2.197 = 39,4 gam
Câu 32 :
Kim loại Na không tác dụng được với chất nào dưới đây?
Đáp án : D Lời giải chi tiết :
Na không phản ứng với dầu hỏa do đó người ta bảo quản Na bằng cách ngâm trong dầu hỏa.
Câu 33 :
Công thức cấu tạo thu gọn của đimetyl amin là
Đáp án : D Lời giải chi tiết :
Công thức cấu tạo thu gọn của đimetyl amin là (CH3)2NH.
Câu 34 :
Hòa tan hết hỗn hợp X gồm Al, Mg và Al(NO3)3 trong dung dịch chứa NaHSO4 và 0,06 mol NaNO3. Sau phản ứng thu được dung dịch Y chỉ chứa 115,28 gam các muối trung hòa và V lít (đktc) hỗn hợp khí T gồm H2 và N2O (tỉ lệ mol 1:1). Y tác dụng tối đa với 36,8 gam NaOH trong dung dịch và thu được 13,92 gam kết tủa. Giá trị của V là
Đáp án : D Phương pháp giải :
+ Bảo toàn electron + Bảo toàn nguyên tố N, Al Lời giải chi tiết :
Đặt nN2O = nH2 = a (mol) nNH4+ = b (mol) => nH+ = 10nN2O + 2nH2 + 10 nNH4+ = 12a + 10b => nNa+ = 12a + 10b + 0,06 ; nSO42- = 12a + 10b nMg = nMg(OH)2 = 0,24 (mol) Bảo toàn electron: 2nMg + 3nAl = 8nN2O + 2nH2 + 8nNH4+ => nAl = (10a + 8b – 0,48)/3 BTNT N => 3nAl(NO3)3 + nNaNO3 = 2n N2O + nNH4+ => nAl(NO3)3 = (2a + b – 0,06)/3 BTNT Al => nAl3+ trong X = nAl + nAl(NO3) = 4a + 3b – 0,18 Khối lượng muối trong X (Na+ ; Al3+; Mg2+; NH4+ ; SO42-): 23( 12a + 10b + 0,06) + 27 (4a + 3b – 0,18) + 0,24.24 + 18b + 96 (12a + 10b) = 115, 28 (1) nNaOH = 4nAl3+ + 2nMg2+ + nNH4+ => 0,92 = 4 (4a + 3b – 0,18) + 2.024 + b (2) Từ (1) và (2) => a = b = 0,04 (mol) => nT = 2a = 0,08 (mol) => V= 1,792 (lít)
Câu 35 :
Cho các phát biểu: (1) Nhôm là một kim loại lưỡng tính; (2) CrO3 là oxit lưỡng tính; (3) Al2O3 là oxit lưỡng tính; Al(OH)3 là hidroxit lưỡng tính. Số phát biểu đúng là
Đáp án : B Lời giải chi tiết :
(1) sai, không có khái niệm kim loại lưỡng tính (2) sai, CrO3 là oxit axit (3) (4) đúng Vậy có 2 phát biểu đúng
Câu 36 :
Thủy phân este X trong môi trường axit thu được metanol và axit etanoic. Công thức cấu tạo của X là
Đáp án : C Lời giải chi tiết :
CH3COOCH3 + H2O \(\overset {{H^ + },{t^o}} \leftrightarrows \) CH3COOH (axit etanoic) + CH3OH (metanol)
Câu 37 :
Cho bột sắt lần lượt phản ứng với: dung dịch HCl; dung dịch CuSO4; dung dịch HNO3 loãng dư; khí Cl2 (to). Số phản ứng tạo ra muối sắt (III) là
Đáp án : A Phương pháp giải :
Khi Fe phản ứng với những chất có tính oxi hóa mạnh (HNO3, H2SO4 đặc nóng, Cl2, ...) sẽ tạo muối Fe3+ Lời giải chi tiết :
PTHH: Fe + 2HCl → FeCl2 + H2 Fe + CuSO4 → FeSO4 + Cu Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O 2Fe + 3Cl2 \(\xrightarrow{{{t^o}}}\) 2FeCl3 Vậy có 2 phản ứng tạo ra muối sắt (III)
Câu 38 :
Đun nóng m gam hỗn hợp Cu và Fe với tỉ lệ khối lượng tương ứng là 7 : 3 với một lượng dung dịch HNO3. Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít (đktc) hỗn hợp sản phẩm khử gồm NO và NO2. Biết lưọng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là
Đáp án : A Phương pháp giải :
Ta có: mCu = 0,7m và mFe = 0,3m Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m Ta có: nNO + nNO2 = 0,25 mol (1) Quá trình nhận electron: NO3-+ 1e + 2H+ → NO2 + H2O NO3-+ 3e + 4H+ → NO + 2H2O Ta có: nH+ = 2.nNO2+ 4.nNO = 0, 7 mol (2) Giải hệ (1) và (2) ta có: nNO và nNO2 Quá trình cho electron là: Fe → Fe2+ + 2e Áp dụng định luật bảo toàn electron ta có: 2.nFe = nNO2 + 3.nNO → nFe pứ = 0,25m/56 → Tính được giá trị m. Lời giải chi tiết :
Ta có: nHNO3 = 44,1: 63 = 0,7 mol Ta có: mCu = 0,7m và mFe = 0,3m Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m Ta có: nNO + nNO2 = 0,25 mol (1) Quá trình nhận electron: NO3-+ 1e + 2H+ → NO2 + H2O NO3-+ 3e + 4H+ → NO + 2H2O Ta có: nH+ = 2.nNO2 + 4.nNO = 0, 7 mol (2) Giải hệ (1) và (2) ta có: nNO = 0,1 mol và nNO2 = 0,15 mol Do sau phản ứng vẫn còn Fe dư và Cu nên quá trình cho electron là: Fe → Fe2+ + 2e Áp dụng định luật bảo toàn electron ta có: 2.nFe = nNO2 + 3.nNO = 0,15 + 3.0,1 = 0,45 mol → nFe pứ = 0,225 mol = 0,25m/56 (mol) → m = 50,4 gam
Câu 39 :
Chất tác dụng với H2 (Ni, to) tạo thành sobitol là
Đáp án : B Lời giải chi tiết :
Glucozo cộng với H2 thu được sobitol
Câu 40 :
Trộn 21,6 gam bột Al với m gam hỗn hợp X gồm (FeO, Fe2O3 và Fe3O4) được hỗn hợp Y. Nung Y ở nhiệt độ cao trong điều kiện không có không khí đến phản ứng hoàn toàn thu được chất rắn Z. Cho Z tác dụng vớii dung dịch NaOH dư thu được 6,72 lít khí. Nếu cho Z tác dụng với HNO3, loãng dư thì thu được 19,04 lít khí NO là sản phẩm khử duy nhất. Biết thể tích các khí đo ở điều kiện tiêu chuẩn. Giá trị của m là
Đáp án : A Phương pháp giải :
- Do Z tác dụng với NaOH thu được khí H2 => Z có chứa Al => Al dư, các oxit sắt hết Từ số mol khí H2 ta tính được số mol Al dư. - Khi cho Z tác dụng với HNO3: Bảo toàn electron: 3nAl + 3nFe = 3nNO => nFe = ? BTNT "Al": nAl2O3 = (nAl bđ - nAl dư)/2 = ? BTNT "O": nO(X) = 3nAl2O3 = ? => m = mFe + mO = ? Lời giải chi tiết :
nAl bđ = 21,6 : 27 = 0,8 mol - Do Z tác dụng với NaOH thu được khí H2 => Z có chứa Al => Al dư, các oxit sắt hết 2Al + 3FexOy \(\xrightarrow{{{t^o}}}\) yAl2O3 + 3xFe (1) Chất rắn Y: Fe, Al2O3, Al dư Aldư + NaOH + H2O → NaAlO2 + 1,5H2↑ (2) 0,2 ← 0,3 - Khi cho Z tác dụng với HNO3: Bảo toàn electron: 3nAl + 3nFe = 3nNO => nAl + nFe = nNO hay 0,2 + nFe = 0,85 => nFe = 0,65 (mol) BTNT "Al": nAl2O3 = (nAl bđ - nAl dư)/2 = (0,8 - 0,2)/2 = 0,3 mol BTNT "O": nO(X) = 3nAl2O3 = 0,9 mol => m = mFe + mO = 0,65.56 + 0,9.16 = 50,8(gam) |