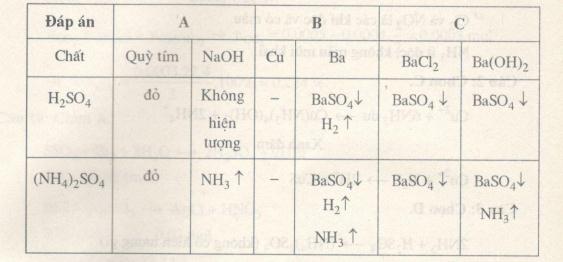
Đề kiểm tra 15 phút – Đề số 1 – Chương 8 – Hóa học 12Đáp án và lời giải chi tiết đề thi kiểm tra 15 phút – Đề số 1 – Chương 8 – Hóa học 12 Đề bài Câu 1. Phương pháp nhận biết các ion kim loại kiềm: 1. Thử màu ngọn lửa. 2. Tạo muối màu đặc trưng cho từng ion. C. Tạo kết tủa đặc trưng cho từng ion. Các phương pháp đúng là A. 1 B. 1, 2. C. 3. D. 2, 3. Câu 2. Để nhận biết ra sự có mặt của ion X trong dung dịch, người ta thêm kiềm vào dung dịch cần phân tích, đặt mẩu giấy quỳ ẩm trên miệng ống nghiệm chứa dung dịch rồi đun nóng nhẹ. X là ion nào trong số các ion sau đây? A.SO2−3.B.Al3+.C.NH+4.D.NO−3. Câu 3. Dung dịch A tạo kết tủa màu trắng với dung dịch BaCl2 và tạo kết tủa màu nâu đen với dung dịch NaOH. Dung dịch A là A.FeSO4.B.AgNO3.C.Na2CO3.D.CuSO4. Câu 4. Dung dịch Y chứa Na+ và một anion. Y tác dụng với BaCl2 thu được kêt tủa trắng tan trong axit. Thêm nước brom vào Y rồi mới cho tác dụng với BaCl2 thì được kết tủa không tan trong axit. Y chứa anion nào trong số các anion sau đây? A.CO2−3B.HCO−3C.SO2−3D.SO2−4 Câu 5. Dùng thêm 1 thuốc thử nào dưới đây có thể phân biệt được các dung dịch không nhãn bằng phương pháp hóa học: AlCl3,ZnCl2,CuCl2,Fe(NO3)2,NaCl đựng trong các lọ mất nhãn? A. Dung dịch NaOH. B. Dung dịch Na3PO4 C. Dung dịch Ba(OH)2 D. Dung dịch NH3 Câu 6. Có 3 dung dịch NaOH,HCl,H2SO4 loãng. Thuốc thử duy nhất để phân biệt 3 dung dịch là A. bột Zn. B. bột AgNO3 C. bột BaCO3 D. Quỳ tím. Câu 7. Nhóm nào sau đây chứa các hóa chất mà mỗi chất đều có thể phân biệt được dung dịch H2SO4 loãng và dung dịch (NH4)2SO4 bão hòa? A. Quỳ tím; NaOH. B. Cu, Ba. C. BaCl2;Ba(OH)2 D. NaHCO3;KOH Câu 8. Để kết tủa hoàn toàn Fe2+ từ dung dịch FeSO4 dưới dạng FeS cần cho cần cho dung dịch FeSO4 tác dụng với A. H2S B. Na2S C. ZnS. D. B hoặc C Câu 9. Kết quả một thí nghiệm cho biết, trong một dung dịch co chứa bốn ion gồm 0,03 mol Na+;0,02molCa2+;0,05molHCO−3;0,02molCl−. Kết luận nào sau đây đúng? A. Kết quả đo bị sai. B. Nước có thể mất độ cứng sau khi đun nóng. C. Dùng Ca(OH)2 không làm giảm độ cứng của nước D. Chỉ có thể loại bỏ độ cứng bằng các muối như: Na2CO3,Na3PO4... Câu 10. Phân biệt trực tiếp dung dịch FeSO4 và dung dịch SO2 cùng nồng độ có thể dùng thuốc thử nào sau đây? A. Dung dịch (KMnO4+H2SO4) loãng. B. Dung dịch Ba(OH)2. C. Giấy quỳ tím. D. Dung dịch NH4Cl. Lời giải chi tiết Câu 1. Chọn A. Các ion kim loại kiềm đều không màu, không tạo kết tủa. Câu 2. Chọn C. NH+4+OH−→NH3↑+H2O Khí làm xanh quỳ ẩm. Câu 3. Chọn B. Ag++Cl−→AgClAg++OH−→Ag2O+H2O Câu 4. Chọn C. SO2−3+Ba2+→BaSO3SO2−3+Br2+H2O→SO2−4+2Br−+2H+SO2−4+Ba2+→BaSO4 Câu 5. Chọn D. AlCl3 tạo kết tủa trắng; ZnCl2 tạo kết tủa trắng tan trong NH3 dư. CuCl2 tạo kết tủa xanh lam tan trong NH3 dư được dung dịch xanh đậm. Fe(NO3)3 tạo kết tủa nâu đỏ. Câu 6. Chọn C. NaOH không xảy ra, HCl cho bọt khí, H2SO4 cho bọt khí và kết tủa. Câu 7. Chọn D.
NaHCO3 sủi bọt khí với H2SO4, KOH tạo khí với (NH4)2SO4 bão hòa. Câu 8. Chọn B. Câu 9. Chọn D. A sai: vì dung dịch hòa điện. B sai: đun nóng dung dịch vẫn dư Ca2+ sau phản ứng: Ca2++HCO−3→CaCO3+H2O+CO2 C sai: Ca(OH)2+Ca(HCO3)2→CaCO3+H2O Câu 10. Chọn A. 5SO2+2KMnO4+2H2O→ K2SO4+2MnSO4+2H2SO4 10FeSO4+2MnO4+8H2SO4→ Fe2(SO4)3+K2SO4+2MnSO4+8H2O Dùng dung dịch KMnO4 nhỏ từ từ vào hai dung dịch với tốc độ như nhau. Trường hợp FeSO4 cần ít KMnO4 hơn → dung dịch FeSO4 màu tím trước dung dịch SO2. HocTot.Nam.Name.Vn
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+ TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM, 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, luyện thi theo 3 giai đoạn: Nền tảng lớp 12, Luyện thi chuyên sâu, Luyện đề đủ dạng đáp ứng mọi kì thi.
|