Đề số 5 - Đề kiểm tra học kì 2 - Hóa học 12Đáp án và lời giải chi tiết Đề số 5 - Đề kiểm tra học kì 2 (Đề thi học kì 2) - Hóa học 12 Đề bài Câu 1 : Để tách lấy Ag ra khỏi hỗn hợp gồm Fe, Cu, Ag ta dùng lượng dư dung dịch A. HCl. B. NaOH C. HNO3. D. Fe2(SO4)3. Câu 2 : Các kim loại bị thụ động hoá với HNO3 đặc, nguội hoặc H2SO4 đặc, nguội là A. Cr, Fe, Al. B. Al, Fe, Cu C. Cr, Al, Mg. D. Cr, Fe, Zn. Câu 3 : Dãy gồm các hợp chất chỉ có tính oxi hoá là A. FeO, Fe2O3. B. Fe(OH)2, FeO C. Fe(NO3)2, FeCl3. D. Fe2O3, Fe2(SO4)3. Câu 4 : Ở một số địa phương sử dụng nước giếng khoan, khi mới bơm lên nước trong nhưng để lâu thì có mùi tanh và bị ngả màu vàng. Ion làm cho nước có màu vàng là A. Na+. B. K+. C. Cu2+. D. Fe3+. Câu 5 : Cấu hình electron lớp ngoài cùng của nguyên tử kim loại Mg (Z = 12) là A. 3s23p1. B. 3s2 C. 4s2. D. 2s22p4. Câu 6 : Cho hỗn hợp gồm Mg và Al (tỉ lệ mol 1:1) tan vừa đủ trong dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m gần nhất với giá trị nào sau đây? A. 50,0. B. 48,6 C. 35,4. D. 47,3. Câu 7 : Cho 30 gam hỗn hợp X gồm Fe3O4 và Cu vào dung dịch HCl, sau phản ứng hoàn toàn thu được dung dịch Y chứa hai chất tan và còn lại 6,32 gam chất rắn. Cho dung dịch AgNO3 dư vào dung dịch Y thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây? A. 25,9. B. 91,8 C. 86,2. D. 117,8. Câu 8 : Cho 5,4 gam Al tác dụng hết với khí Cl2 (dư), thu được m gam muối. Giá trị của m là A. 26,7. B. 19,6 C. 25,0. D. 12,5. Câu 9 : Để phân biệt dung dịch CaCl2 với dung dịch NaCl, người ta dùng dung dịch A. NaNO3. B. KNO3 C. Na2CO3. D. HNO3. Câu 10 : Dãy các kim loại được xếp theo chiều tính khử tăng dần là A. Mg, Fe, Al. B. Fe, Al, Mg C. Al, Mg, Fe. D. Fe, Mg, Al. Câu 11 : Khi nhỏ từ từ đến dư dung dịch HCl vào dung dịch hỗn hợp gồm a mol NaOH và b mol NaAlO2, kết quả thí nghiệm được biểu diễn bằng đồ thị sau:
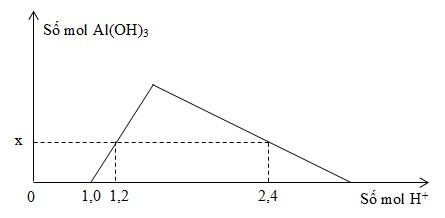
Tổng giá trị (a + b) là A. 0,5. B. 1,5 C. 0,7. D. 1,7. Câu 12 : Dung dịch NaOH không tác dụng với A. AlCl3. B. NaHCO3 C. FeO. D. Al2O3. Câu 13 : Chất không có tính lưỡng tính là A. Al(OH)3. B. Al2O3 C. NaHCO3. D. AlCl3. Câu 14 : Sắt tây là sắt tráng thiếc. Nếu lớp thiếc bị xước sâu tới lớp sắt thì A. cả hai đều bị ăn mòn như nhau B. kim loại bị ăn mòn trước là sắt. C. kim loại bị ăn mòn trước là thiếc D. không kim loại nào bị ăn mòn. Câu 15 : Chất có thể làm mềm nước cứng toàn phần là A. Na2CO3. B. CaCO3 C. NaCl. D. CaSO4. Câu 16 : Hai dung dịch đều phản ứng được với kim loại Fe là A. ZnCl2 và FeCl3. B. CuSO4 và ZnCl2 C. HCl và AlCl3. D. CuSO4 và HCl. Câu 17 : Cho H2 dư qua m gam hỗn hợp chất rắn X gồm Fe, CuO, Fe3O4 nung nóng, phản ứng kết thúc thấy khối lượng chất rắn giảm 0,48 gam. Nếu hòa tan hoàn toàn m gam X vào V(ml) dung dịch HNO3 0,5M vừa đủ thì thu được tối đa 1,344 lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là A. 500. B. 720 C. 600. D. 480. Câu 18 : Cho dãy các ion kim loại: K+, Ag+, Fe2+, Cu2+. Ion kim loại có tính oxi hóa mạnh nhất trong dãy là A. K+. B. Fe2 C. Ag+. D. Cu2+. Câu 19 : Ở nhiệt độ cao, khí H2 khử được oxit nào sau đây? A. Al2O3. B. MgO C. CuO. D. CaO. Câu 20 : Nung hỗn hợp gồm Mg(OH)2 và Fe(OH)2 ngoài không khí cho đến khi khối lượng không đổi thu được chất rắn có thành phần là A. Mg và FeO. B. MgO và Fe2O3 C. MgO và FeO. D. Mg và Fe. Câu 21 : Phát biểu nào sau đây sai? A. Quặng hematit có thành phần chính là Fe3O4. B. Nguyên tắc sản xuất gang là khử quặng sắt oxit bằng than cốc trong lò cao. C. Thành phần % khối lượng cacbon trong gang là từ 2 – 5%. D. Thép không gỉ có chứa Cr và Ni. Câu 22 : Hòa tan hoàn toàn 18 gam hỗn hợp gồm Al và Al2O3 trong dung dịch NaOH giải phóng 3,36 lít khí H2 (đktc). Khối lượng của Al2O3 trong hỗn hợp là A. 11,93 gam. B. 10,20 gam C. 15,30 gam. D. 13,95 gam. Câu 23 : Phản ứng của cặp chất nào sau đây sản phẩm có muối Fe(II)? A. Fe3O4 + HCl. B. FeCO3 + HNO3 C. FeO + HNO3. D. Fe(OH)3 + H2SO4. Câu 24 : Chất X là một bazơ mạnh, được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất clorua vôi (CaOCl2), vật liệu xây dựng. Ngoài ra chất X còn dùng để xử lí chất thải. Công thức của X là A. Ca(OH)2. B. NaOH C. Ba(OH)2. D. KOH. Câu 25 : Để bảo vệ ống thép (dẫn nước, dẫn dầu, dẫn khí đốt) bằng phương pháp điện hóa, người ta gắn vào mặt ngoài của ống thép những khối kim loại bằng A. Pb. B. Ag C. Zn. D. Cu. Câu 26 : Cho dãy các kim loại: Li, Na, Al, Ca . Số kim loại kiềm trong dãy là A. 3. B. 2 C. 1. D. 4. Câu 27 : Nhỏ từ từ cho đến dư dung dịch NaOH vào dung dịch AlCl3. Hiện tượng xảy ra là A. chỉ có kết tủa keo trắng B. không có kết tủa, có khí bay lên. C. có kết tủa keo trắng, sau đó kết tủa tan D. có kết tủa keo trắng và có khí bay lên. Câu 28 : Trong công nghiệp người ta thường điều chế kim loại K bằng cách? A. Điện phân dung dịch KCl không có màng ngăn B. Điện phân dung dịch KCl có màng ngăn. C. Dùng CO khử K+ trong K2O ở nhiệt độ cao. D. Điện phân KCl nóng chảy. Câu 29 : Phát biểu nào sau đây sai? A. Hợp chất KAl(SO4)2.12H2O dùng làm trong nước được gọi là phèn chua. B. Ruby và saphia có thành phần hóa học chủ yếu là Al2O3. C. Nước cứng là nước có chứa các cation Ca2+ và Mg2+. D. Thạch cao nung dùng để đúc tượng, bó bột... có công thức là CaSO4.H2O. Câu 30 : Điện phân dung dịch chứa hỗn hợp gồm HCl, FeCl3, CuCl2. Thứ tự điện phân ở catot là A. Fe3+, Cu2+, H+, Fe2+, H2O B. Cu2+, H+, Fe3+, H2O. C. Fe3+, Cu2+, H+, H2O D. Fe3+, Fe2+, Cu2+, H+, H2O. Câu 31 : Cho một lá kẽm có khối lượng 8,5 gam vào dung dịch FeSO4, sau phản ứng lấy lá kẽm ra làm khô, cân được 7,6 gam (giả thiết toàn bộ sắt sinh ra bám hết vào lá kẽm). Lượng Zn đã phản ứng là A. 13gam. B. 3,25gam C. 6,5gam. D. 8,7gam. Câu 32 : Sục khí nào sau đây vào dung dịch Ca(OH)2 dư thấy xuất hiện kết tủa màu trắng? A. CO2. B. H2 C. HCl. D. O2. Câu 33 : Ở điều kiện thường, kim loại nào sau đây không phản ứng với nước? A. Na . B. Be C. K. D. Ba . Câu 34 : Cho hình vẽ mô tả thí nghiệm điều chế kim loại bằng phương pháp nhiệt luyện: Trong hình vẽ trên, oxit X là A. CuO. B. Na2O C. MgO. D. Al2O3. Câu 35 : Chất nào sau đây không tạo kết tủa khi tác dụng với dung dịch Ca(HCO3)2? A. HCl. B. NaOH C. Na2CO3. D. Ca(OH)2. Câu 36 : Khử hoàn toàn hỗn hợp gồm m gam FeO, Fe2O3, Fe3O4 bằng CO dư ở nhiệt độ cao, sau phản ứng thu được 33,6 gam chất rắn và 17,92 lít CO2 (đktc). Giá trị của m là A. 36,16. B. 46,40 C. 34,88. D. 59,20. Câu 37 : Cho dãy các kim loại kiềm: Na, Li, Cs, Rb . Kim loại có nhiệt độ nóng chảy thấp nhất là A. Rb . B. Cs C. Na . D. Li. Câu 38 : Hòa tan hoàn toàn 8,4 gam Fe bằng dung dịch HNO3 loãng dư, thu được V lít NO (đktc, sản phẩm khử duy nhất). Giá trị của V là A. 1,12. B. 2,24 C. 4,48. D. 3,36. Câu 39 : Chất tác dụng với dung dịch HNO3 loãng có thể giải phóng khí NO là A. CuO. B. Fe(OH)2 C. CaCO3. D. Fe2O3. Câu 40 : Kim loại nào sau đây có độ cứng lớn nhất trong tất cả các kim loại? A. Vonfam. B. Đồng C. Sắt. D. Crom. Lời giải chi tiết ĐÁP ÁN HƯỚNG DẪN GIẢI CHI TIẾT Câu 1: Phương pháp: Để tách Ag ra khỏi hỗn hợp thì ta chọn chất phản ứng được với các chất khác nhưng không phản ứng với Ag và sau phản ứng không sinh thêm chất rắn nào khác. Hướng dẫn giải:
Chọn dung dịch chỉ có Fe và Cu phản ứng, Ag không thể phản ứng => Fe3+ là dung dịch cần tìm Fe + 2Fe3+ → 3Fe2+ Cu + 2Fe3+ → 2Fe2+ + Cu2+ Đáp án D Câu 2: Phương pháp: Tính chất hóa học chung của kim loại Hướng dẫn giải: Al, Fe, Cr bị thụ động hoá với HNO3 đặc, nguội hoặc H2SO4 đặc, nguội Đáp án A Câu 3: Phương pháp: Chất oxi hóa là chất chỉ có thể nhận e (đang ở trạng thái có số oxi hóa cao nhất) Hướng dẫn giải: Fe có số oxi hóa cao nhất là +3 => Các hợp chất sắt III chỉ có tính oxi hóa Đáp án D Câu 4: Hướng dẫn giải: Khi mới bơm lên trong nước có sắt hóa trị 2, nhưng sau một thời gian tiếp xúc với không khí, sắt sẽ chuyển sang hóa trị 3, có màu vàng và nổi váng. Đáp án D Câu 5: Phương pháp: Dựa vào cách viết cấu hình electron nguyên tử Hướng dẫn giải: 12Mg: 1s22s22p63s2 Đáp án B Câu 6: Phương pháp: - Biện luận các chất khí trong hỗn hợp khí sản phẩm => số mol các khí => Biện luận chất nào dư, chất nào hết sau phản ứng => Các chất trong dung dịch X (Chú ý kiểm tra xem có NH4+ trong dung dịch hay không) - Dựa vào định luật bảo toàn điện tích để tích số mol các ion trong dung dịch => Khối lượng chất tan trong X Hướng dẫn giải: Vì hỗn hợp khí thu được có dY/H2 = 12,2 => Mkhí = 12,2.2 = 24,4 Có 1 khí hóa nâu ngoài không khí (NO có M = 30 > 24,4) => khí còn lại có M < 24,4 => Chỉ có thể là H2 => NO3- hết trước H+. Ta có: nNO + nH2 = 0,125 mol (1) Và: mkhí = 30nNO + 2nH2 = 0,125.24,4 = 3,05g (2) Từ (1,2) => nNO = 0,1 ; nH2 = 0,025 mol Bảo toàn N: nNaNO3 + nKNO3 = nNO + nNH4 (nếu có) => nNH4 = 0,05 mol Bảo toàn electron: 3nAl + 2nMg = 3nNO + 8nNH4 + 2nH2 = 3.0,1 + 8.0,05 + 0,025.2 = 0,75 mol Và: nMg = nAl (Đề bài) => nMg = nAl = 0,15 mol Vậy dung dịch X chứa: 0,15 mol Mg2+ ; 0,15 mol Al3+ ; 0,05 mol Na+ ; 0,1 mol K+ ; 0,05 mol NH4+ ; Cl- Bảo toàn điện tích: nCl = 2nMg + 3nAl + nNa + nK + nNH4 = 0,95 mol => m = åmion = 0,15.24 + 0,15.27 + 0,05.23 + 0,1.39 + 0,05.18 + 0,95.35,5 = 47,235g (Gần nhất với giá trị 47,3g) Đáp án D Câu 7: Phương pháp: Biện luận các chất có trong dung dịch và chất rắn sau phản ứng => Tìm xem trong X chất nào dư, chất nào hết => Tính được số mol các chất phản ứng Chú ý khi cho muối sắt vào dung dịch AgNO3 có phản ứng: Fe2+ + Ag+ → Fe3+ + Ag↓ Hướng dẫn giải: X + HCl: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O Mol x → x → 2x Cu + 2FeCl3 → CuCl2 + 2FeCl2 Mol x ¬ 2x → x → 2x Vì sau phản ứng có 2 muối trong dung dịch => Chỉ có Cu2+ và Fe2+ Chất rắn sau phản ứng chỉ gồm Cu dư. mchất phản ứng = 232.x + 64.x = mX – mCu dư = 30 – 6,32 => x = 0,08 mol => Trong dung dịch có: 0,08mol CuCl2 và 0,24 mol FeCl2 Ag+ + Cl- → AgCl Ag+ + Fe2+ → Fe3+ + Ag => Chất kết tủa gồm: 0,24 mol Ag và 0,64 mol AgCl => m = 117,76g (Gần nhất với giá trị 117,8g) Đáp án D Câu 8: Phương pháp: Bảo toàn nguyên tố Hướng dẫn giải: Al + 1,5Cl2 → AlCl3 Bảo toàn nguyên tố: nAl = nAlCl3 = 5,4 : 27 = 0,2 mol => mAlCl3 = 0,2.133,5 = 26,7g Đáp án A Câu 9: Phương pháp: Phân biệt các chất vô cơ bằng phương pháp hóa học Hướng dẫn giải: Chỉ có CaCl2 có phản ứng với muối cacbonat tạo kết tủa trắng: CaCl2 + Na2CO3 → CaCO3↓ + 2NaCl Đáp án C Câu 10: Phương pháp: Dựa vào dãy điện hóa kim loại Hướng dẫn giải: Tính khử: Fe < Al < Mg Đáp án B Câu 11: Phương pháp: Nếu cho H+ tác dụng với dung dịch [Al(OH)4]- thì xảy ra 1 hoặc 2 phản ứng sau: [Al(OH)4]- + H+→ Al(OH)3 + H2O (1) Al(OH)3 + 3H+→ Al3+ + 3H2O (2) *Phương pháp: Nếu đặt: n[Al(OH)4]- = a mol; nH+ = b mol thì: + Nếu b/a 1 thì: nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và: nAl(OH)3 = (4a – b)/3 + Nếu b/a 4 thì không có kết tủa Hướng dẫn giải: Thứ tự phản ứng: H+ + OH- → H2O H+ + AlO2- + H2O → Al(OH)3 3H+ + Al(OH)3 → Al3+ + 3H2O - Tại: nH+ = 1,0 mol => bắt đầu có kết tủa => Phản ứng trung hòa hoàn toàn => nOH = 1 mol = a - Tại nH+ = 1,2 mol => chưa có hiện tượng hòa tan kết tủa => nAl(OH)3 = nH+ pứ = 1,2 – 1 = 0,2 mol - Tại nH+ = 2,4 mol => có hiện tượng hòa tan 1 phần kết tủa => nAl(OH)3 = 1/3.(4nAlO2 – nH+ pứ) => 0,2 = 1/3.[4b – (2,4 – 1,0)] => b = 0,5 mol => (a + b) = 1,5 mol Đáp án B Câu 12: Phương pháp: Tính chất hóa học của NaOH Hướng dẫn giải: NaOH không phản ứng được với FeO. Các PTHH xảy ra: AlCl3 + 3NaOH → Al(OH)3 + 3NaCl NaHCO3 + NaOH → Na2CO3 + H2O Al2O3 + 2NaOH → 2NaAlO2 + H2O Đáp án C Câu 13: Phương pháp: Chất lưỡng tính vừa có thể cho proton và nhận proton (H+) Hướng dẫn giải: AlCl3 không thể nhận proton (H+) nên không phải là chât lưỡng tính Đáp án D Câu 14: Phương pháp: - Là sự oxi hoá kim loại có phát sinh dòng điện. (*) Điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau.(KL-KL, KL-PK,…) Chú ý: Trong một pin điện thì kim loại nào có tính khử mạnh hơn sẽ bị ăn mòn trước. Hướng dẫn giải: Ở đây xuất hiện pin điện Fe-Sn trong đó Fe có tính khử mạnh hơn nên bị ăn mòn trước Sn Đáp án B Câu 15: Phương pháp: Làm mềm nước cứng bằng phương pháp loại bỏ ion Ca2+ và Mg2+ dưới dạng kết tủa. Hướng dẫn giải: Chất thỏa mãn là Na2CO3 PT ion: Ca2+ + CO32- → CaCO3↓ Mg2+ + CO32- → MgCO3↓ Đáp án A Câu 16: Phương pháp: Tính chất hóa học của Fe Hướng dẫn giải: Fe + CuSO4 → FeSO4 + Cu Fe + 2HCl → FeCl2 + H2 Đáp án D Câu 17: Phương pháp: Bài toán hỗn hợp kim loại, oxit tan hết trong HNO3 - Qui hỗn hợp về dạng: KL, O => Công thức giải nhanh: ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 + 2nO nHNO3 = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 + 2nO Hướng dẫn giải: - Quy hỗn hợp X về: Fe, Cu, O - Khi X + H2 nghĩa là: [O] + H2 → H2O => mrắn giảm = mO pứ = 0,48g => nO(X) = ,48: 16 = 0,03 mol -Khi X + HNO3: nNO = 1,344: 22,4 = 0,06 mol => Ta có: nHNO3 = 4nNO + 2nO = 4.0,06 + 2.0,03 = 0,3 mol => VHNO3 = 0,3: 0,5 = 0,6 lít = 600 ml Đáp án C Câu 18: Phương pháp: Dựa vào dãy điện hóa của kim loại Hướng dẫn giải: Tính oxi hóa: Ag+ > Cu2+ > Fe2+ > K+ Đáp án C Câu 19: Phương pháp: Chất khử trung bình (C, CO, H2) chỉ khử được những oxit của những kim loại đứng sau Al trong dãy điện hóa. Hướng dẫn giải: Chất khử trung bình (C, CO, H2) chỉ khử được những oxit của những kim loại đứng sau Al trong dãy điện hóa. Do đó H2 chỉ có thể khử được oxit CuO Đáp án C Câu 20: Phương pháp: Tính chất hóa học của các chất vô cơ Hướng dẫn giải: Mg(OH)2 \(\xrightarrow{{{t}^{0}}}\)MgO + H2O 2Fe(OH)2 + ½ O2 \(\xrightarrow{{{t}^{0}}}\) Fe2O3 + 2H2O Vậy chất rắn gồm: MgO, Fe2O3 Đáp án B Câu 21: Phương pháp: Lý thuyết về sắt và hợp kim của sắt Ghi nhớ một số quặng thường gặp chứa Fe: - Hematit đỏ: Fe2O3 - Hematit nâu: Fe2O3.nH2O - Manhetit: Fe3O4 - Pirit: FeS2 - Xiderit: FeCO3 Hướng dẫn giải: A sai vì quặng hematit có thành phần chính là là Fe2O3. B, C, D là các phát biểu đúng Đáp án A Câu 22: Phương pháp: Tính toán theo phương trình phản ứng Hướng dẫn giải: nH2 = 3,36: 22,4 = 0,15 mol Al + NaOH + H2O → NaAlO2 + 1,5H2 Mol 0,1 ¬ 0,15 => mAl2O3 = 18 – mAl =18 – 0,1.27 = 15,3g Đáp án C Câu 23: Phương pháp: Tính chất hóa học của Fe và hợp chất của Fe Chú ý: Khi tác dụng với các chất có tính oxi hóa mạnh thì Fe sẽ lên mức oxi hóa cao nhất +3. Hướng dẫn giải: Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O FeCO3, FeO + HNO3 → Fe3+ + sản phẩm khử Đáp án A Câu 24: Phương pháp: Ứng dụng các hợp chất của canxi Hướng dẫn giải: Ca(OH)2 là một bazơ mạnh, được sử dụng rộng rãi trong nhiều ngành công nghiệp như sản xuất clorua vôi (CaOCl2), vật liệu xây dựng. Ngoài ra chất X còn dùng để xử lí chất thải. Đáp án A Câu 25: Phương pháp: Ăn mòn điện hóa (*) Định nghĩa: - Là sự oxi hoá kim loại có phát sinh dòng điện. (*) Điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau.(KL-KL, KL-PK,…) Chú ý: Trong một pin điện hóa thì KL nào có tính khử mạnh hơn sẽ bị ăn mòn trước. Hướng dẫn giải: (*) Ứng dụng pin điện: Khi gắn tấm kẽm lên ống thép tức là ta tạo ra 1 pin điện Zn-Fe trong đó Zn là cực âm là Zn và cực dương là Fe(trong thép). Trong pin điện hóa, cực dương diễn ra quá trình oxi hóa => Zn sẽ bị oxi hóa trước Fe Đáp án C Câu 26: Phương pháp: Định nghĩa kim loại kiềm: Các kim loại kiềm là một dãy các nguyên tố trong nhóm IA của bảng tuần hoàn các nguyên tố, ngoại trừ hiđrô. Đó là líti, natri, kali, rubiđi, xêsi và franxi. Hướng dẫn giải: Có 2 kim loại kiềm là Li, Na Đáp án B Câu 27: Phương pháp: Tính chất hóa học hợp chất của nhôm Hướng dẫn giải: AlCl3 + 3NaOH → Al(OH)3↓(keo trắng) + 3NaCl Al(OH)3 + NaOH → NaAlO2(tan) + 2H2O Như vậy hiện tượng xảy ra là: Ban đầu có kết tủa keo trắng, sau đó kết tủa tan dần. Đáp án C Câu 28: Phương pháp: Điều chế kim loại Hướng dẫn giải: Trong công nghiệp, để điều chế các kim loại kiềm người ta tiến hành điện phân nóng chảy muối clorua của chúng. KCl \(\xrightarrow{{{t}^{0}}}\)K + ½ Cl2 Đáp án D Câu 29: Phương pháp: Lý thuyết về các chất vô cơ Hướng dẫn giải: - Nước cứng là nước chứa nhiều Ca2+ ; Mg2+. (Nếu chứa ít 2 cation trên thì vẫn chưa gọi là nước cứng) Đáp án C Câu 30: Phương pháp: Trong quá trình điện phân , ở catot những ion nào có tính oxi hóa mạnh hơn bị khử trước. Hướng dẫn giải: Tính oxi hóa: Fe3+ > Cu2+ > H+ > Fe2+ > H2O (Fe2+ do Fe3+ bị điện phân sinh ra) => Thứ tự điện phân ở catot là: Fe3+ > Cu2+ > H+ > Fe2+ > H2O Đáp án A Câu 31: Phương pháp: Bài toán tăng giảm khối lượng: Dmthanh kim loại = |mKL pứ - mKl tạo ra| Hướng dẫn giải: Zn + Fe2+ → Zn2+ + Fe Mol x → x => Dmgiảm = mZn pứ - mFe tạo ra => 8,5 – 7,6 = 65x – 56x => x = 0,1 mol => mZn pứ = 65.0,1 = 6,5g Đáp án C Câu 32: Phương pháp: Tính chất hóa học của Ca(OH)2 Hướng dẫn giải: Sục khí CO2 vào dd Ca(OH)2 dư thu được kết tủa trắng CaCO3: Ca(OH)2 + CO2 → CaCO3↓(trắng) + H2O Đáp án A Câu 33: Phương pháp: Tính chất hóa học của kim loại Hướng dẫn giải: Kim loại kiềm, kiềm thổ (trừ Be, Mg) có thể phản ứng với nước ở điều kiện thường. Vậy Be không phản ứng được với nước ở điều kiện thường. Đáp án B Câu 34: Phương pháp: Chất khử trung bình (C, CO, H2) chỉ khử được những oxit của KL đứng sau Al trong dãy điện hóa. Hướng dẫn giải: - Khi cho Zn phản ứng với HCl sinh ra H2: Zn + 2HCl → ZnCl2 + H2 - H2 sinh ra chỉ khử được CuO Đáp án A Câu 35: Phương pháp: Tính chất hóa học của muối canxi Hướng dẫn giải: PTHH: - Phương án A: Ca(HCO3)2 + 2HCl → CaCl2 + 2CO2 + 2H2O - Phương án B: Ca(HCO3)2 + NaOH → CaCO3↓ + NaHCO3 + H2O hoặc Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O - Phương án C: Ca(HCO3)2 + Na2CO3 → CaCO3 + 2NaHCO3 - Phương án D: Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O Vậy phản ứng câu A không tạo ra kết tủa. Đáp án A Câu 36: Phương pháp: Bảo toàn khối lượng Hướng dẫn giải: Ta có: Oxit + CO → Chất rắn + CO2 nCO2 = 17,92 : 22,4 = 0,8 mol Bảo toàn nguyên tố: nCO = nCO2 = 0,8 mol Bảo toàn khối lượng: m + mCO = mrắn + mCO2 => m = 33,6 + 0,8.44 – 0,8.28 = 46,4g Đáp án B Câu 37: Phương pháp: Dựa vào tính chất vật lý của kim loại kiềm. Hướng dẫn giải: Cs là kim loại có nhiệt độ nóng chảy thấp nhất trong các kim loại kiềm. Đáp án B Câu 38: Phương pháp: Bảo toàn electron Hướng dẫn giải: Fe → Fe3+ + 3e N5+ + 3e → N2+ =>Bảo toàn e: nFe = nNO = 8,4 : 56 = 0,15 mol => VNO = 0,15.22,4 = 3,36 lít Đáp án D Câu 39: Phương pháp: Tính chất hóa học của các chất vô cơ Hướng dẫn giải: Một chất tác dụng với HNO3 sinh ra NO => Phản ứng oxi hóa khử Chỉ có phản ứng giữa Fe(OH)2 và HNO3 là phản ứng oxi hóa khử. PTHH: 3Fe(OH)2 + 10HNO3 → 3Fe(NO3)3 + NO + 8H2O Đáp án B Câu 40: Phương pháp: Tính chất vật lý của kim loại Hướng dẫn giải: Crom có độ cứng lớn nhất trong tất cả các kim loại Đáp án D Nguồn: Sưu tầm HocTot.Nam.Name.Vn
|