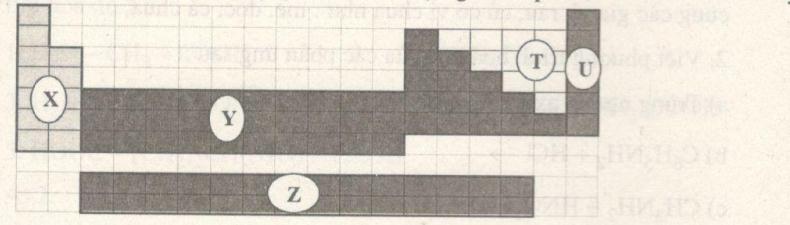
Đề kiểm tra 15 phút - Đề 1- Chương 5 – Hóa học 12Đáp án và lời giải chi tiết đề thi kiểm tra 15 phút - Đề 1- Chương 5 – Hóa học 12 Đề bài Câu 1. Bảng tuần hoàn các nguyên tố hóa học gồm 5 phần, như hình dưới đây.
Các nguyên tố kim loại nằm ở phần A. T, U. B. X, Y, Z. C. X, Y. D. Z, T. Câu 2. Cho 4 nguyên tử với cấu hình phân mức năng lượng cao nhất là: \(1{s^2},3{s^2},3{p^1},3{p^5}.\) Số nguyên tử kim loại trong số 4 nguyên tử trên là A. 1. B. 2. C. 3. D. 4. Câu 3. Chu kỳ 3 của bảng tuần hoàn gồm các nguyên tố sắp xếp như sau:
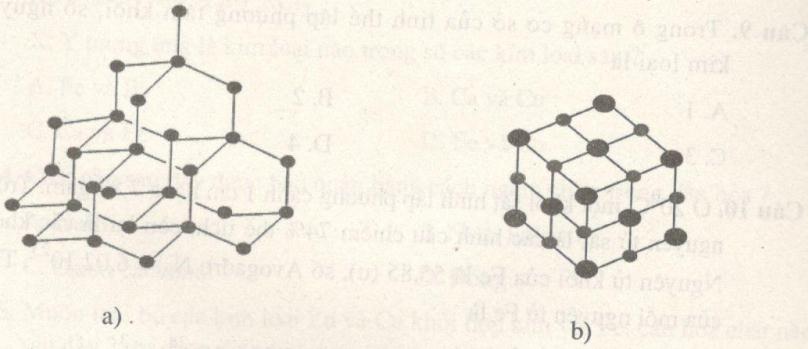
So sánh nào sau đây đúng? A. Bán kính nguyên tử: Na < Cl. B. Điện tích hạt nhân nguyên tử: Mg > P. C. Số lớp electron: Al < Ar. D. Bán kính ion: \(N{a^ + } < {S^{2 - }}\) Câu 4. Cation của \({M^{2 + }}\) có cấu hình electron là \(\left[ {Ne} \right]3{s^2}3{p^6}.\) M là nguyên tố nào sau đây? \( A.{\,_{20}}Ca. \) \( C.{\,_{17}}Cl. \) \( B.{\,_{19}}K. \) \(D.{\,_{20}}Ca. \) Câu 5. Tinh thể được phân loại thành tinh thể nguyên tử, phân tử, ion, kim loại,... dựa trên đặc điểm nào sau đây? A. Dựa vào bản chất hạt vi mô cấu tạo nên tinh thể. B. Dựa vào bản chất liên kết trong mạng tinh thể. C. Dựa vào cách bố trí các hạt vi mô trong tinh thể. D. Dựa vào tính chất chung của tinh thể. Câu 6. Mạng tinh thể nào sau đây thuộc loại mạng tinh thể kim loại?
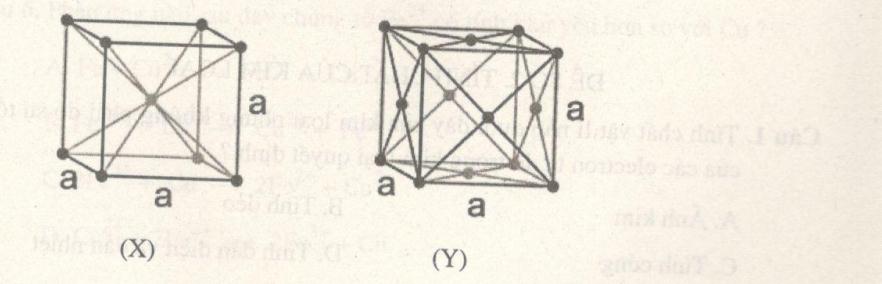
A. a. B. b. C. a, b. D. Không có. Câu 7. Cho hai kiểu loại mạng tinh thể kim loại như sau: Nhận xét nào sau đây đúng? A. X là mạng lập phương tâm diện. B. Các cấu tử trong Y sắp xếp đặc khít hơn X. C. Kim loại Cu, Ag, Al, Hg có mạng tinh thể kiểu Y. D. Trong Y, không gian trống chiếm 68%. Câu 8. Liên kết kim loại mang bản chất A. sự góp chung các electron tự do giữa hai nguyên tử kim loại liền nhau. B. lực hút tĩnh điện giữa các ion kim loại. C. lực hút giữa ion kim loại và các electron tự do. D. sự sắp xếp chặt chẽ của các nguyên tử kim loại tại các nút mạng. Câu 9. Trong ô mạng cơ sở của tinh thể lập phương tâm khối, số nguyên tử kim loại là A. 1. B. 2. C. 3. D. 4. Câu 10. Ở \(20^\circ C\), một khối sắt hình lập phương cạnh 1 cm nặng 7,87 gam. Trong đó, nguyên tử sắt là các hình cầu chiếm 74% thể tích, còn lại là các khe rỗng. Nguyên tử khối của Fe là 55,85 (u), số Avogađro \({N_A} = 6,{02.10^{23}}.\)Thể tích của mỗi nguyên tử Fe là A. 7,422.10-24 cm3. B. 5,585.10-24 cm3. C. 6,584.10-24 cm3. D. 8,723.10-24 cm 3.
Lời giải chi tiết Câu 1. Chọn B. X là các kim loại kiềm, Z là các kim loại họ Lantan và Actini, Y gồm các kim loại chuyển tiếp và các kim loại p. T là các kim loại, U là khí hiếm. Câu 2. Chọn B. Kim loại thường có 1, 2, 3 electron ở lớp ngoài cùng, trừ H (\(1{s^1}\)) và He (\(1{s^1}\)). Câu 3. Chọn D. Trong chu kỳ số lớp electron không đổi, điện tích hạt nhân tăng dần \( \to \) bán kính nguyên tử giảm dần. Bán kính \(N{a^ + }\) nhỏ hơn \({S^{2 - }}\) vì nguyên nhân chính là \(N{a^ + }\) chỉ có 2 lớp electron, \({S^{2 - }}\) có 3 lớp electron. Câu 4. Chọn A. \({M^{2 + }}\)có cấu hình đầy đủ: \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}\) có 18 electron \( \to \) M có 20 electron. Câu 5. Chọn A. Tinh thể được phân loại thành tinh thể nguyên tử, phân tử, ion, kim loại dựa vào bản chất hạt vi mô cấu tạo nên tinh thể. Câu 6. Chọn D. (a) là mạng tinh thể kim cương (b) mạng tinh thể muối Câu 7. Chọn B. X là mạng lập phương tâm khối. Hg là chất lỏng. Không gian trống không thể chiếm nhiều hơn không gian chiếm của nguyên tử và ion kim loại. Câu 8. Chọn C. A sai: các electron tự do là electron chung của tất cả các nguyên tử. B sai: các ion kim loại cùng dấu chỉ co lực đẩy. D sai: sự sắp xếp chặt chẽ là kết quả của liên kết kim loại. Câu 9. Chọn B. Trong một ô cơ sở có 1 nguyên tử ở tâm, ở mỗi góc có \(\dfrac{1 }{ 8}\) nguyên tử. Có 8 đỉnh (8 góc) \( \to \) tổng số nguyên tử là \(8.\dfrac{1 }{8} + 1 = 2.\) Câu 10. Chọn D. 1 \(c{m^3}\) Fe có tổng thể tích các nguyên tử Fe là \(0,74c{m^3}\) Số nguyên tử Fe trong 1 \(c{m^3}\) Fe (hay 7,87 gam) là: \(N = \dfrac{7,87} {55,85}.6,{02.10^{23}} = 8,{483.10^{22}}\) (nguyên tử) Thể tích 1 nguyên tử: \(\dfrac{0,74}{8,{{483.10}^{22}}} = 8,{723.10^{ - 24}}c{m^3}.\) HocTot.Nam.Name.Vn
|