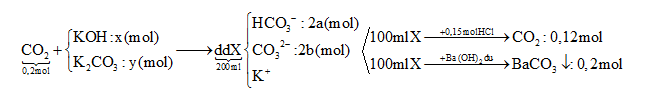Đề thi thử THPT QG môn Hóa trường THPT chuyên Hải Phòng lần 1Đề bài
Câu 1 :
Thạch cao nung có công thức hóa học là:
Câu 2 :
Ở trạng thái cơ bản, số electron hóa trị của Al (Z = 13) là:
Câu 3 :
Chất nào sau đây không phải là chất lưỡng tính:
Câu 4 :
Kim loại nào tan hoàn toàn trong nước dư ở điều kiện thường:
Câu 5 :
Trong các chất dưới đây, chất nào là amin bậc 2:
Câu 6 :
Khi làm lạnh đột ngột chất X được Nước đá khô. Chất X là:
Câu 7 :
Kim loài sắt tác dụng với chất nào dưới đây (dư) tạo muối sắt (III):
Câu 8 :
Hợp chất hữu cơ luôn chứa nguyên tố nào sau đây:
Câu 9 :
Công thức hóa học của sắt (III) oxit là:
Câu 10 :
Z là chất rắn, dạng sợi màu trắng không tan trong nước. Tên gọi của X là:
Câu 11 :
Một vật làm bằng sắt tráng thiếc (sắt tây), trên bề mặt vết sây sát tới lớp sắt. Khi vật này tiếp xúc với không khí ẩm thì:
Câu 12 :
Este nào sau đây có công thức phân tử là C4H8O2:
Câu 13 :
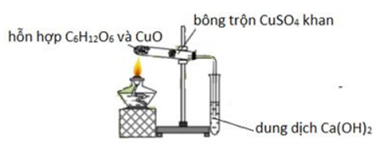
Tiến hành thí nghiệm theo mô hình sau: Bông trộn CuSO4 khan chuyển sang màu:
Câu 14 :
Trong các chất sau, chất có nhiệt độ nóng chảy cao nhất là:
Câu 15 :
Phát biểu nào sau đây là sai ?
Câu 16 :
Cho các kim loại: Fe, Cu, Ag, Zn. Số kim loại tan được trong dung dịch Fe(NO3)3 dư là:
Câu 17 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng dư thu được dung dịch X. Dung dịch tác dụng được với chất nào sau đây không xảy ra phản ứng oxi hóa khử:
Câu 18 :
Trong số các loại tơ sau: tơ tằm, tơ visco, tơ nilon-6,6 , tơ capron, tơ axetat, tơ olon. Những loại tơ nào là tơ nhân tạo:
Câu 19 :
Cho 0,1 mol Ala-Gly tác dụng hết với 300 ml dung dịch KOH 1M. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn. Giá trị của m là:
Câu 20 :
Khử hoàn toàn 1 lượng Fe3O4 bằng H2 dư thu được chất rắn X và m gam H2O. Hòa tan hết X trong dung dịch HCl dư thu được 1,008 lít khí H2 (đktc). Giá trị của m là:
Câu 21 :
Hòa tan hết a mol Al vào dung dịch chứa 2a mol NaOH thu được dung dịch X. Kết luận nào sau đây đúng ?
Câu 22 :
Cho các chất sau: CuO, O2, dung dịch Ca(OH)2, FeO. Số chất tác dụng được với CO (đun nóng) là:
Câu 23 :
Lên men m gam glucozo để tạo thành ancol etylic (hiệu suất phản ứng là 50%). Hấp thụ hoàn toàn khí CO2 sinh ra vào dung dịch Ca(OH)2 dư thu được 15g kết tủa. Giá trị của m là:
Câu 24 :
Chất X(C4H8O2) tác dụng với dung dịch NaOH thu được chất hữu cơ Y và Z. Oxi hóa Z bằng CuO thu được axeton. Công thức cấu tạo của X là:
Câu 25 :
Đốt cháy hoàn toàn m gam một triglixerit X cần vừa đủ 1,54 mol O2 thu được CO2 và 1 mol H2O. Nếu thủy phân hoàn toàn m gam X trong dung dịch KOH đun nóng thu được dung dịch chứa 18,64g muối. Để chuyển hóa a mol X thành chất béo no cần vừa đủ 0,06 mol H2 (Ni, t0). Giá trị của
Câu 26 :
Cho các sơ đồ phản ứng sau: X (C8H14O4) + 2NaOH \(\xrightarrow{{{t^0}}}\) X1 + X2 + H2O X1 + H2SO4 → X3 + Na2SO4 nX5 + nX3 \(\xrightarrow{{{t^0},xt}}\) poli(hexametylen adipamit) + 2nH2O 2X2 + X3 \(\overset {{H_2}S{O_4}(đặc),{t^0}} \leftrightarrows \) X6 + 2H2O Phân tử khối của X6 là:
Câu 27 :
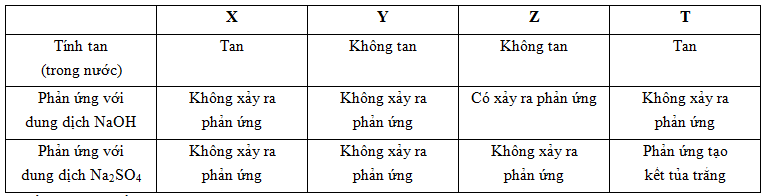
Các hidroxit: Ba(OH)2, NaOH, Al(OH)3, Fe(OH)3 được kí hiệu ngẫu nhiên là X, Y, Z, T. Kết quả thí nghiệm của X, Y, Z, T được ghi ở bảng sau:
Câu 28 :
Cho các phát biểu sau: (a) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat (b) Thủy tinh hữu cơ được ứng dụng làm cửa kính phương tiện giao thông (c) Glucozo có vị ngọt thấy đầu lưỡi mát lạnh vì xảy ra phản ứng lên men rượu (d) Nhỏ dung dịch I2 vào lát cắt của củ khoai lang thì xuất hiện màu xanh tím (e) Nicotin là 1 amin độc, có trong thuốc lá (f) Sau khi lưu hóa, cao su chịu nhiệt và đàn hồi tốt hơn Số phát biểu đúng là:
Câu 29 :
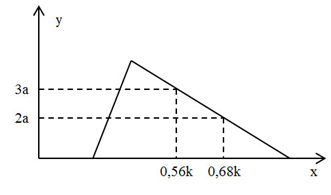
Hòa tan hoàn toàn hỗn hợp gồm 0,25 mol Al2O3 và 0,4 mol BaO vào nước dư thu được dung dịch E. Nhỏ từ từ dung dịch HCl k (M) vào E, số mol kết tủa (y mol) thu được phụ thuộc vào số mol HCl phản ứng (x mol) được biểu diễn theo sơ đồ sau:
Giá trị của k là:
Câu 30 :
Hỗn hợp X gồm C2H4, C2H2, C3H8, C4H10. Lấy 6,32g X cho qua bình đựng dung dịch nước Br2 (dư) thấy có 0,12 mol Br2 tham gia phản ứng. Mặt khác, đốt cháy hết 2,24 lít khí X (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được 9,68g CO2. Biết các phản ứng hoàn toàn. Giá trị của V là:
Câu 31 :
Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, cho 100 ml dung dịch X tác dụng với đung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
Câu 32 :
Cho các phát biểu sau: (a) Thép là hợp kim của sắt chứa 2-5% khối lượng Cacbon (b) Bột nhôm trộn với bột sắt (III) oxit dùng để hàn đường ray bằng phản ứng nhiệt nhôm (c) Dùng Na2CO3 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước. (d) Dùng bột lưu huỳnh để xử lý thủy ngân rơi vãi khi nhiệt kế vỡ (e) Khi làm thí nghiệm kim loại đồng tác dung với dung dịch HNO3, người ta nút ống nghiệm bằng bông tẩm dung dịch kiềm. Số phát biểu đúng là:
Câu 33 :
Đốt cháy hoàn toàn 0,33 mol hỗn hợp X gồm metyl propionat, metyl axetat và 2 hidrocacbon mạch hở cần vừa đủ 1,27 mol O2 tạo ra 14,4g H2O. Nếu cho 0,33 mol X vào dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là:
Câu 34 :
Hợp chất X (CnH10O5) có vòng benzen và nhóm chức este. Trong phân tử X, phần trăm khối lượng của oxi lớn hơn 29%. Lấy 1 mol X tác dụng hết với dung dịch NaOH dư, sản phẩm hữu cơ thu được chỉ là 2 mol chất Y. Cho các phát biểu sau: (a) Chất X có 3 loại nhóm chức (b) Chất X làm quì tím ẩm chuyển sang màu đỏ (c) Số mol NaOH đã tham gia phản ứng là 4 mol (d) Khi cho 1 mol X tác dụng hết với NaHCO3 (trong dung dịch) hoặc Na đều thu được 1 mol khí (e) 1 mol chất Y tác dụng với vừa đủ 2 mol HCl (g) Khối lượng chất Y thu được là 364g Số phát biểu đúng là:
Câu 35 :
Tiến hành điện phân V lít dung dịch chứa Cu(NO3)2 1M và NaCl 0,5M (điện cực trơ) đến khi khối lượng dung dịch giảm m gam thì dừng điện phân. Cho 9,5g Fe vào dung dịch sau điện phân, kết thúc phản ứng thu được 1,12 lít khí NO thoát ra(sản phẩm khử duy nhất) và còn lại 5,7 gam hỗn hợp rắn không tan. Giá trị của m gần nhất với giá trị nào sau đây:
Câu 36 :
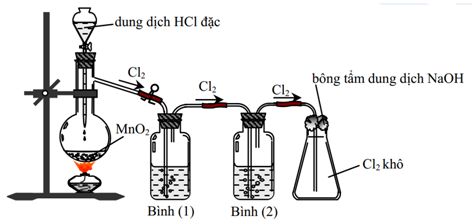
Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
Cho các phát biểu sau: (a) Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước (b) Có thể đổi vị trí bình (1) và bình (2) cho nhau (c) Sử dụng bông tẩm kiềm để tránh khí Cl2 thoát ra môi trường (d) Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất (e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn là NaCl và KMnO4 (f) Bình (2) đựng dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO (viên) Số phát biểu không đúng là:
Câu 37 :
Cho X, Y là 2 axit cacboxylic đơn chức mạch hở (MX < MY) ; T là este 2 chức tạo bởi X, Y và 1 ancol no mạch hở. Đốt cháy hoàn toàn 12,38g hỗn hợp E gồm X, Y, T bằng một lượng vừa đủ O2 thu được 0,47 mol CO2 và 0,33 mol H2O. mặt khác 12,38g E tác dụng với dung dịch AgNO3/NH3 dư, thu được 17,28g Ag. Phần trăm khối lượng của X trong E gần nhất với:
Câu 38 :
Hòa tan hoàn toàn a gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (trong đó oxi chiếm 7,99% về khối lượng) vào nước dư. Sau phản ứng, thu được dung dịch Y gồm NaOH, KOH và Ba(OH)2 có tỉ lệ mol tương ứng là 3: 2: 7 và 0,784 lít khí H2(đktc). Cho Y tác dụng với dung dịch gồm 0,02 mol Al2(SO4)3, 0,01 mol H2SO4 và 0,04 mol KHSO4 thu được m gam kết tủa. Giá trị của m là:
Câu 39 :
Hỗn hợp E gồm 0,15 mol chất hữu cơ mạch hở X (C6H13O4N) và 0,2 mol este 2 chức Y (C4H6O4) tác dụng hết với dung dịch NaOH vừa đủ, đun nóng. Kết thúc phản ứng, cô cạn dung dịch, thu được hỗn hợp Z gồm 2 ancol đơn chức kết tiếp nhau trong dãy đồng đẳng và a gam hỗn hợp 3 muối khan (đều cùng có số cacbon trong phân tử, trong đó có 2 muối cacboxylic). Giá trị của a là:
Câu 40 :
Cho m gam hỗn hợp Cu, Fe3O4 vào 200 ml dung dịch chứa NaNO3 1M và H2SO4 2M thu được dung dịch Y và thấy 1,12 lít khí NO (đktc). Thêm dung dịch HCl dư vào dung dịch Y lại thấy thoát ra 0,336 lít khí NO (đktc), NO là sản phẩm khử duy nhất của NO3-. Giá trị của m là:
Lời giải và đáp án
Câu 1 :
Thạch cao nung có công thức hóa học là:
Đáp án : B Phương pháp giải :
Một số chất đặc biệt cần nhớ: Thạch cao sống: CaSO4.2H2O Thạch cao nung: CaSO4.H2O hoặc CaSO4.0,5H2O Thạch cao khan: CaSO4 Lời giải chi tiết :
Thạch cao nung có công thức hóa học là CaSO4.H2O hoặc CaSO4.0,5H2O
Câu 2 :
Ở trạng thái cơ bản, số electron hóa trị của Al (Z = 13) là:
Đáp án : D Phương pháp giải :
Định nghĩa số e hóa trị: Là tổng số e lớp ngoài cùng hoặc tổng số e lớp ngoài cùng và phân lớp sát ngoài cùng (nếu như phân lớp này chưa bão hòa). Lời giải chi tiết :
Câu hình e của Al: 1s22s22p63s23p1 => Ở trạng thái cơ bản, số electron hóa trị của Al là 3
Câu 3 :
Chất nào sau đây không phải là chất lưỡng tính:
Đáp án : C Phương pháp giải :
Chất lưỡng tính có thể cho và nhận proton (H+) Lời giải chi tiết :
Al là kim loại, không phải là chất lưỡng tính
Câu 4 :
Kim loại nào tan hoàn toàn trong nước dư ở điều kiện thường:
Đáp án : B Phương pháp giải :
Các kim loại kiềm, kiềm thổ (trừ Be, Mg) đều tan hoàn toàn trong nước ở điều kiện thường Lời giải chi tiết :
K tan hoàn toàn trong nước ở điều kiện thường
Câu 5 :
Trong các chất dưới đây, chất nào là amin bậc 2:
Đáp án : A Phương pháp giải :
Bậc của amin = số nhóm hidrocacbon gắn bới nguyên tử Nito Lời giải chi tiết :
Amin bậc 2 là CH3NHCH3
Câu 6 :
Khi làm lạnh đột ngột chất X được Nước đá khô. Chất X là:
Đáp án : B Lời giải chi tiết :
Nước đá khô chính là CO2 dạng rắn
Câu 7 :
Kim loài sắt tác dụng với chất nào dưới đây (dư) tạo muối sắt (III):
Đáp án : D Phương pháp giải :
Tính chất hóa học của Fe Lời giải chi tiết :
Các PTHH: Fe + H2SO4(loãng) → FeSO4 + H2 Fe + S \(\buildrel {{t^0}} \over\longrightarrow \) FeS Fe + 2HCl → FeCl2 + H2 Fe + 1,5Cl2 \(\buildrel {{t^0}} \over\longrightarrow \) FeCl3 Vậy khi Fe tác dụng với Cl2 (to) thu được muối sắt (III)
Câu 8 :
Hợp chất hữu cơ luôn chứa nguyên tố nào sau đây:
Đáp án : B Lời giải chi tiết :
Hợp chất hữu cơ luôn chứa nguyên tố Cacbon
Câu 9 :
Công thức hóa học của sắt (III) oxit là:
Đáp án : A Lời giải chi tiết :
Công thức hóa học của sắt (III) oxit là Fe2O3
Câu 10 :
Z là chất rắn, dạng sợi màu trắng không tan trong nước. Tên gọi của X là:
Đáp án : C Lời giải chi tiết :
Xenlulozo là chất rắn, dạng sợi màu trắng không tan trong nước
Câu 11 :
Một vật làm bằng sắt tráng thiếc (sắt tây), trên bề mặt vết sây sát tới lớp sắt. Khi vật này tiếp xúc với không khí ẩm thì:
Đáp án : A Phương pháp giải :
Ăn mòn điện hóa là sự oxi hoá kim loại có phát sinh dòng điện. (*) Điều kiện để xảy ra ăn mòn điện hóa: - Bản chất hai điện cực phải khác nhau (KL-KL, KL-PK,…) Lời giải chi tiết :
Khi gắn tấm sắt và thiếc (Sn) tức là ta tạo ra 1 pin điện Fe-Sn trong đó Fe và Sn là 2 điện cực. Trong pin điện hóa, kim loại mạnh hơn sẽ bị ăn mòn (bị oxi hóa) trước. => Fe sẽ bị oxi hóa
Câu 12 :
Este nào sau đây có công thức phân tử là C4H8O2:
Đáp án : D Lời giải chi tiết :
Vinyl axetat: CH3COOCH=CH2 (C4H6O2) Propyl axetat: CH3COOC3H7 (C5H10O2) Phenyl axetat: CH3COOC6H5 (C8H8O2) Etyl axetat: CH3COOC2H5 (C4H8O2)
Câu 13 :
Tiến hành thí nghiệm theo mô hình sau: Bông trộn CuSO4 khan chuyển sang màu:
Đáp án : D Phương pháp giải :
Tính chất hóa học của cacbohidrat Lời giải chi tiết :
C6H12O6 + 12CuO \(\buildrel {{t^0}} \over\longrightarrow \) 12Cu + 6CO2 + 6H2O CuSO4 + 5H2O → CuSO4.5H2O (trắng) (xanh) Đáp án D
Câu 14 :
Trong các chất sau, chất có nhiệt độ nóng chảy cao nhất là:
Đáp án : C Phương pháp giải :
Nhiệt độ nóng chảy phụ thuộc vào: - Khả năng tạo liên kết liên phân tử (liên kết ion > liên kết cộng hóa trị > liên kết hidro) - Khối lượng mol phân tử Lời giải chi tiết :
Trong 4 chất thì H2NCH2COOH có liên kết ion ( +H3NCH2COO-) và có khối lượng phân tử lớn nhất nên có nhiệt độ nóng chảy cao nhất
Câu 15 :
Phát biểu nào sau đây là sai ?
Đáp án : A Lời giải chi tiết :
A sai. Vì khi cho Cu(OH)2 vào dung dịch lòng trắng trứng (polipeptit) thì sẽ xảy ra phản ứng biure => tạo sản phẩm có màu tím đặc trưng B, C, D đúng.
Câu 16 :
Cho các kim loại: Fe, Cu, Ag, Zn. Số kim loại tan được trong dung dịch Fe(NO3)3 dư là:
Đáp án : A Phương pháp giải :
Lý thuyết về dãy hoạt động hóa học của kim loại - Kim loại đứng trước sẽ phản ứng được với muối của kim loại (ion) đứng sau Lời giải chi tiết :
Các kim loại đứng trước Fe3+ đều có thể phản ứng với Fe3+ gồm: Fe, Cu, Zn
Câu 17 :
Hòa tan hoàn toàn Fe3O4 trong dung dịch H2SO4 loãng dư thu được dung dịch X. Dung dịch tác dụng được với chất nào sau đây không xảy ra phản ứng oxi hóa khử:
Đáp án : B Phương pháp giải :
Định nghĩa phản ứng oxi hóa – khử: Phản ứng oxi hóa khử xảy ra khi có sự thay đổi số oxi hóa của các nguyên tố. Lời giải chi tiết :
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O Dung dịch X gồm Fe2+, Fe3+, H+, SO42-. Phản ứng oxi hóa - khử là phản ứng có sự thay đổi số oxi hóa của các nguyên tố. Khi NaOH phản ứng với Fe2+, Fe3+ và H+ đều là phản ứng trao đổi (không có sự thay đổi số oxi hóa của các nguyên tố)
Câu 18 :
Trong số các loại tơ sau: tơ tằm, tơ visco, tơ nilon-6,6 , tơ capron, tơ axetat, tơ olon. Những loại tơ nào là tơ nhân tạo:
Đáp án : D Phương pháp giải :
Tơ nhân tạo (tơ bán tổng hợp) là tơ có nguồn gốc thiên nhiên nhưng được con người chế biến lại. Lời giải chi tiết :
- Tơ nhân tạo (tơ bán tổng hợp): tơ visco, tơ axetat (đều có nguồn gốc từ xenlulozo và được con người chế biến) - Tơ tổng hợp: nilon -6,6, tơ olon, tơ capron - Tơ thiên nhiên: tơ tằm
Câu 19 :
Cho 0,1 mol Ala-Gly tác dụng hết với 300 ml dung dịch KOH 1M. Cô cạn dung dịch sau phản ứng thu được m gam chất rắn. Giá trị của m là:
Đáp án : A Phương pháp giải :
Tính chất hóa học của peptit Lời giải chi tiết :
Ala – Gly + 2KOH → Ala-K + Gly-K + H2O Mol 0,1 → 0,2 → 0,1 → 0,1 => nKOH dư = 0,3 – 0,2 = 0,1 mol mrắn = mAla-K + mGly-K + mKOH dư = 127.0,1 + 113.0,1 + 56.0,1 = 29,6g
Câu 20 :
Khử hoàn toàn 1 lượng Fe3O4 bằng H2 dư thu được chất rắn X và m gam H2O. Hòa tan hết X trong dung dịch HCl dư thu được 1,008 lít khí H2 (đktc). Giá trị của m là:
Đáp án : D Phương pháp giải :
Tính toán theo phương trình phản ứng Lời giải chi tiết :
(1) Fe3O4 + 4H2 \(\buildrel {{t^0}} \over\longrightarrow \) 3Fe + 4H2O (2) Fe + 2HCl → FeCl2 + H2 Từ PTHH (2) => nH2 = nFe = 0,045 mol Từ PTHH (1) => nH2O = 4/3.nFe = 0,06 mol => m = mH2O = 0,06.18 = 1,08g
Câu 21 :
Hòa tan hết a mol Al vào dung dịch chứa 2a mol NaOH thu được dung dịch X. Kết luận nào sau đây đúng ?
Đáp án : B Lời giải chi tiết :
Al + NaOH + H2O → NaAlO2 + 1,5H2 Mol a → a → a → 1,5a + NaOH còn dư => X có pH > 7 => A sai + VH2 = 22,4.1,5a = 33,6a (lít) => C sai + X phản ứng được với dung dịch CuSO4: 2NaOH + CuSO4 → Cu(OH)2 + Na2SO4 => D sai => B đúng
Câu 22 :
Cho các chất sau: CuO, O2, dung dịch Ca(OH)2, FeO. Số chất tác dụng được với CO (đun nóng) là:
Đáp án : C Lời giải chi tiết :
CuO + CO \(\buildrel {{t^0}} \over\longrightarrow \) Cu + CO2 2CO + O2 \(\buildrel {{t^0}} \over\longrightarrow \) 2CO2 CO + FeO \(\buildrel {{t^0}} \over\longrightarrow \) Fe + CO2 => Có 3 chất phản ứng được với CO (đun nóng)
Câu 23 :
Lên men m gam glucozo để tạo thành ancol etylic (hiệu suất phản ứng là 50%). Hấp thụ hoàn toàn khí CO2 sinh ra vào dung dịch Ca(OH)2 dư thu được 15g kết tủa. Giá trị của m là:
Đáp án : A Phương pháp giải :
1) A → B (Hlà hiệu suất phản ứng) nB = nA. H% 2) A → B → C (H1, H2 là hiệu suất phản ứng A → B và B → C) nC = nB. H2% = nA.H1%.H2% Lời giải chi tiết :
C6H12O6 → 2C2H5OH + 2CO2 CO2 + Ca(OH)2 → CaCO3 + H2O Ta có: nCaCO3 = nCO2 = 15 : 100 = 0,15 mol => nGlucozo (LT) = ½ nCO2 = 0,075 mol => nGlucozo (TT) = 0,075.(100/50) = 0,15 mol => m = 0,15.180 = 27g Đáp án A
Câu 24 :
Chất X(C4H8O2) tác dụng với dung dịch NaOH thu được chất hữu cơ Y và Z. Oxi hóa Z bằng CuO thu được axeton. Công thức cấu tạo của X là:
Đáp án : C Phương pháp giải :
Tính chất hóa học các chất hữu cơ Lời giải chi tiết :
Dựa vào 4 đáp án ta thấy X là este: Este + NaOH → muối và ancol Z bị oxi hóa tạo axeton (CH3COCH3) => Z là ancol bậc 2 (CH3CH2(OH)CH3 ) => este phải có công thức là: HCOOCH(CH3)2
Câu 25 :
Đốt cháy hoàn toàn m gam một triglixerit X cần vừa đủ 1,54 mol O2 thu được CO2 và 1 mol H2O. Nếu thủy phân hoàn toàn m gam X trong dung dịch KOH đun nóng thu được dung dịch chứa 18,64g muối. Để chuyển hóa a mol X thành chất béo no cần vừa đủ 0,06 mol H2 (Ni, t0). Giá trị của
Đáp án : B Phương pháp giải :
- Gọi số mol X trong m gam là x Bảo toàn nguyên tố => số mol CO2 sản phẩm cháy => khối lượng X tính theo x. - Bảo toàn khối lượng phản ứng thủy phân X => Tính được x => Số liên kết π trong X => số liê kết π có thể phản ứng được với H2 => tỉ lệ mol X + H2 => a Lời giải chi tiết :
- Công thức của X có dạng: (RCOO)3C3H5 - Gọi số mol X trong m gam là x => nO(X) = 6x mol - Phản ứng cháy: BTNT "O": nO(X) + 2nO2 = 2nCO2 + nH2O => nCO2 = ½ (6x + 2.1,54 – 1) = 3x + 1,04 => mX = mC + mH + mO = 12(3x + 1,04) + 1.2 + 16.6x = 132x + 14,48 - Thủy phân X với NaOH: (RCOO)3C3H5 + 3KOH → 3RCOOK + C3H5(OH)3 Mol x → 3x → 3x → x Bảo toàn khối lượng: mX + mNaOH = mmuối + mancol => (132x + 14,48) + 3x.56 = 18,64 + 92x => x = 0,02 mol => nCO2 (cháy) = 3x + 1,04 = 1,1 mol Số nguyên tử C = nC : nX = nCO2 : nX = 1,1 : 0,02 = 55 Số nguyên tử H = nH : nX = 2nH2O : nX = 2 : 0,02 = 100 Vậy CTPT của X là C55H100O6 => Độ bất bão hòa: k = (2C + 2 - H)/2 = (2.55 + 2 - 100)/2 = 6 Vì X có sẵn 3 liên kết π trong 3 nhóm COO => 3 liên kết π còn lại nằm trong gốc hidrocacbon => Khi X + H2 dư thì: nH2 = 3nX => a = nX = 0,06 : 3 = 0,02 mol
Câu 26 :
Cho các sơ đồ phản ứng sau: X (C8H14O4) + 2NaOH \(\xrightarrow{{{t^0}}}\) X1 + X2 + H2O X1 + H2SO4 → X3 + Na2SO4 nX5 + nX3 \(\xrightarrow{{{t^0},xt}}\) poli(hexametylen adipamit) + 2nH2O 2X2 + X3 \(\overset {{H_2}S{O_4}(đặc),{t^0}} \leftrightarrows \) X6 + 2H2O Phân tử khối của X6 là:
Đáp án : C Phương pháp giải :
Lý thuyết tổng hợp hóa học hữu cơ Lời giải chi tiết :
nX5 + nX3 poli(hexametylen adipamit) + 2nH2O => X5, X3 là: H2N-[CH2]6-NH2 ; HOOC-[CH2]4-COOH Vì X không chứa N => X1, X2 không chứa N => X3 không chứa N => X3 là HOOC-[CH2]4-COOH ; X5 là H2N-[CH2]6-NH2 X1 + H2SO4 → X3 + Na2SO4 => X1 là NaOOC-[CH2]4-COONa X(C8H14O4) + 2NaOH X1 + X2 + H2O Sản phẩm có H2O => X còn 1 gốc axit => X là: HOOC-[CH2]4-COOC2H5 => X2 là C2H5OH 2X2 + X3 X6 + 2H2O => X6 là: C2H5OOC-[CH2]4-COOC2H5 => MX6 = 202 g/mol
Câu 27 :
Các hidroxit: Ba(OH)2, NaOH, Al(OH)3, Fe(OH)3 được kí hiệu ngẫu nhiên là X, Y, Z, T. Kết quả thí nghiệm của X, Y, Z, T được ghi ở bảng sau:
Đáp án : C Phương pháp giải :
Lý thuyết về các hidroxit kim loại Lời giải chi tiết :
- Y, Z không tan trong nước => Al(OH)3 và Fe(OH)3 + Z tan trong NaOH => Z là Al(OH)3 (PTHH: Al(OH)3 + NaOH → NaAlO2 + 2H2O) + Y là Fe(OH)3 - Z, T tan trong nước => Ba(OH)2, NaOH + T + H2SO4 tạo kết tủa trắng => T là Ba(OH)2 (PTHH: Ba(OH)2 + H2SO4 → BaSO4 + 2H2O) + X là NaOH
Câu 28 :
Cho các phát biểu sau: (a) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat (b) Thủy tinh hữu cơ được ứng dụng làm cửa kính phương tiện giao thông (c) Glucozo có vị ngọt thấy đầu lưỡi mát lạnh vì xảy ra phản ứng lên men rượu (d) Nhỏ dung dịch I2 vào lát cắt của củ khoai lang thì xuất hiện màu xanh tím (e) Nicotin là 1 amin độc, có trong thuốc lá (f) Sau khi lưu hóa, cao su chịu nhiệt và đàn hồi tốt hơn Số phát biểu đúng là:
Đáp án : B Phương pháp giải :
Xem lại lý thuyết về este, cacbohidrat, polime Lời giải chi tiết :
(a) Dầu chuối (chất tạo hương liệu mùi chuối chín) có chứa isoamyl axetat => Đúng (b) Thủy tinh hữu cơ được ứng dụng làm cửa kính phương tiện giao thông => Đúng (c) Glucozo có vị ngọt thấy đầu lưỡi mát lạnh vì xảy ra phản ứng lên men rượu => Sai. Vì quá trình hòa tan Glucozo trong nước là quá trình thu nhiệt => tạo cảm giác mát lạnh nơi tiếp xúc với Glucozo ở đầu lưỡi. (d) Nhỏ dung dịch I2 vào lát cắt của củ khoai lang thì xuất hiện màu xanh tím => Đúng. (vì khoai lang có chứa tinh bột nên tạo thành hợp chất xanh tím với I2) (e) Nicotin là 1 amin độc, có trong thuốc lá => Đúng (f) Sau khi lưu hóa, cao su chịu nhiệt vào đàn hồi tốt hơn => Đúng => Có 5 ý đúng
Câu 29 :
Hòa tan hoàn toàn hỗn hợp gồm 0,25 mol Al2O3 và 0,4 mol BaO vào nước dư thu được dung dịch E. Nhỏ từ từ dung dịch HCl k (M) vào E, số mol kết tủa (y mol) thu được phụ thuộc vào số mol HCl phản ứng (x mol) được biểu diễn theo sơ đồ sau:
Giá trị của k là:
Đáp án : C Phương pháp giải :
Nếu cho H+ tác dụng với dung dịch [Al(OH)4]- thì xảy ra 1 hoặc 2 phản ứng sau: [Al(OH)4]- + H+ → Al(OH)3 + H2O (1) Al(OH)3 + 3H+ → Al3+ + 3H2O (2) *Phương pháp: Nếu đặt: n[Al(OH)4]- = a mol; nH+ = b mol thì: + Nếu b/a 1 thì: nAl(OH)3 = b + Nếu 1 < b/a < 4 thì kết tủa bị hoà tan 1 phần và: nAl(OH)3 = (4a – b)/3 + Nếu b/a 4 thì không có kết tủa Lời giải chi tiết :
BaO + H2O → Ba(OH)2 Mol 0,4 → 0,4 Al2O3 + Ba(OH)2 → Ba(AlO2)2 + H2O Mol 0,25 → 0,25 → 0,25 => số mol Ba(OH)2 dư = 0,4 – 0,25 = 0,15 mol Vậy dung dịch E gồm: 0,3 mol OH- ; 0,5 mol AlO22- và Ba2+ Các phản ứng có thể xảy ra: OH- + H+ → H2O H+ + AlO2- + H2O → Al(OH)3 Al(OH)3 + 3H+ → Al3+ + 3H2O Tại nHCl = 0,56k (mol) và 0,68k (mol) đều ở bên phải của đỉnh kết tủa (kết tủa max) => Lúc này, có sự hòa tan kết tủa bởi HCl nên ta sử dụng công thức: nH+ = nOH- + 4nAlO2- - 3nAl(OH)3 => nAl(OH)3 = 1/3.[4nAlO2 - (nH+ - nOH)] + Tại nHCl = 0,56k (mol) => nAl(OH)3 = 3a (mol) = 1/3.[4nAlO2 - (nH+ - nOH)] => 3a.3 = 4.0,5 – (0,56k – 0,3) (1) + Tại nHCl = 0,68k (mol) => nAl(OH)3 = 2a (mol) = 1/3.[4nAlO2 - (nH+ - nOH)] => 2a.3 = 4.0,5 – (0,68k – 0,3) (2) Giải hệ (1) và (2) => k = 2,5 (M)
Câu 30 :
Hỗn hợp X gồm C2H4, C2H2, C3H8, C4H10. Lấy 6,32g X cho qua bình đựng dung dịch nước Br2 (dư) thấy có 0,12 mol Br2 tham gia phản ứng. Mặt khác, đốt cháy hết 2,24 lít khí X (đktc) cần dùng V lít khí O2 (đktc), sau phản ứng thu được 9,68g CO2. Biết các phản ứng hoàn toàn. Giá trị của V là:
Đáp án : C Phương pháp giải :
*Đốt cháy 0,1 mol X thu được 0,22 mol CO2: Từ số mol CO2 và số mol hỗn hợp X tính được số C trung bình là 2,2. Giả sử công thức trung bình của hỗn hợp là C2,2H2.2,2+2-2k hay C2,2H6,4-2k (k là độ bất bão hòa) *Xét phản ứng 6,32 gam X cho qua dung dịch Br2 dư: C2,2H6,4-2k + k Br2 → Sản phẩm 0,12/k ← k (mol) mX = nX.MX => Tìm được công thức trung bình của hỗn hợp X. Viết PTHH phản ứng cháy từ đó tính được lượng O2 phản ứng Lời giải chi tiết :
*Đốt cháy 0,1 mol X thu được 0,22 mol CO2: => Số C trung bình = nCO2 : nX = 0,22 : 0,1 = 2,2 Giả sử công thức trung bình của hỗn hợp là C2,2H2.2,2+2-2k hay C2,2H6,4-2k (k là độ bất bão hòa) *Xét phản ứng 6,32 gam X cho qua dung dịch Br2 dư: C2,2H6,4-2k + k Br2 → Sản phẩm 0,12/k ← k (mol) mX = nX.MX => Vậy X có công thức trung bình là C2,2H5,2 Phản ứng đốt cháy 0,1 mol X: C2,2H5,2 + 3,5 O2 → 2,2 CO2 + 2,6 H2O 0,1 → 0,35 mol => VO2 = 0,35.22,4 = 7,84 lít
Câu 31 :
Hấp thụ hết 4,48 lít khí CO2 (đktc) vào dung dịch chứa x mol KOH và y mol K2CO3 thu được 200 ml dung dịch X. Cho từ từ đến hết 100 ml dung dịch X vào 300 ml dung dịch HCl 0,5M, thu được 2,688 lít khí (đktc). Mặt khác, cho 100 ml dung dịch X tác dụng với đung dịch Ba(OH)2 dư, thu được 39,4 gam kết tủa. Giá trị của x là
Đáp án : B Phương pháp giải :
Khi cho từ từ dd chứa HCO3- và CO32- vào dd HCl sẽ xảy ra phản ứng: HCO3- + H+ → CO2 + H2O CO32- + 2H+ → CO2 + H2O Gọi x và y là số mol khi tham gia phản ứng với HCl với tỉ lệ này trùng với tỉ lệ HCO3- và CO32- ban đầu. Bảo toàn nguyên tố C Bảo toàn điện tích Bảo toàn nguyên tố K Lời giải chi tiết :
TH1: Nếu trong dd X có OH- dư => dd X chứa OH- dư, CO32-, K+ Khi cho từ từ 100 ml dd X vào 0,15 mol HCl OH- + H+ → H2O CO32- + 2H+ → CO2 ↑+ H2O => ${{n}_{{{H}^{+}}}}~={{n}_{O{{H}^{-}}}}+2{{n}_{C{{O}_{2}}}}~>0,12.2=0,24\text{ }\left( mol \right)$ => loại vì ${{n}_{{{H}^{+}}}}=0,15\left( mol \right)$ Vậy dd X không chứa OH- dư TH2: dd X không chứa OH- dư ta có sơ đồ bài toán như trên Khi cho từ từ 100ml dd X vào 0,15 mol HCl có phản ứng: HCO3- + H+ → CO2 + H2O x → x → x (mol) CO32- + 2H+ → CO2 + H2O y → 2y → y (mol) Gọi x và y là số mol khi tham gia phản ứng với HCl với tỉ lệ $\frac{x}{y}=\frac{a}{b}$ Ta có: $\left\{ {\begin{array}{*{20}{l}}{\sum {{n_{C{O_2}}} = x + y = 0,12} }\\{\sum {{n_{HCl}} = x + 2y = 0,15} }\end{array}} \right. \Rightarrow \left\{ {\begin{array}{*{20}{l}}{x = 0,09\left( {mol} \right)}\\{y = 0,03\left( {mol} \right)}\end{array}} \right. \Rightarrow \frac{a}{b} = \frac{x}{y} = \frac{3}{1} = > a = 3b{\mkern 1mu} {\mkern 1mu} (1)$ BTNT C: ${{n}_{BaC{{O}_{3}}}}$ = a + b = 0,2 (2) Từ (1) và (2) => a = 0,15 và b = 0,05 (mol) Trong 200 ml dd X: ${{n}_{HCO_{3}^{-}}}~=0,3\left( mol \right);\,{{n}_{CO_{3}^{2-}}}~=0,1\left( mol \right)$ Bảo toàn điện tích đối với dd X : nK+ = 0,3 + 0,1.2 = 0,5 (mol) BTNT C: ${{n}_{CO2(b)}}+{{n}_{{{K}_{2}}C{{O}_{3}}}}={{n}_{HCO_{3}^{-}}}+{{n}_{CO_{3}^{2-}}}~$=> 0,2 + y = 0,3 + 0,1 => y = 0,2 (mol) BTNT K: ${{n}_{K+}}={{n}_{KOH}}+2{{n}_{{{K}_{2}}C{{O}_{3}}}}=>{{n}_{KOH}}=0,52.0,2=0,1\left( mol \right)$ => x = 0,1 (mol)
Câu 32 :
Cho các phát biểu sau: (a) Thép là hợp kim của sắt chứa 2-5% khối lượng Cacbon (b) Bột nhôm trộn với bột sắt (III) oxit dùng để hàn đường ray bằng phản ứng nhiệt nhôm (c) Dùng Na2CO3 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước. (d) Dùng bột lưu huỳnh để xử lý thủy ngân rơi vãi khi nhiệt kế vỡ (e) Khi làm thí nghiệm kim loại đồng tác dung với dung dịch HNO3, người ta nút ống nghiệm bằng bông tẩm dung dịch kiềm. Số phát biểu đúng là:
Đáp án : D Phương pháp giải :
Lý thuyết tổng hợp hóa học vô cơ Lời giải chi tiết :
(a) Thép là hợp kim của sắt chứa 2-5% khối lượng Cacbon => Sai. Thép chỉ chứa 0,01 – 2% Cacbon. Gang có Cacbon chiếm 2 – 5% (b) Bột nhôm trộn với bột sắt (III) oxit dùng để hàn đường ray bằng phản ứng nhiệt nhôm => Đúng (c) Dùng Na2CO3 để làm mất tính cứng tạm thời và tính cứng vĩnh cửu của nước. => Đúng. Vì ion CO32- sẽ làm kết tủa Mg2+ và Ca2+ làm mất tính cứng của nước (d) Dùng bột lưu huỳnh để xử lý thủy ngân rơi vãi khi nhiệt kế vỡ => Đúng. Vì: Hg + S → HgS ↓ để dễ thu gom. (e) Khi làm thí nghiệm khim loại đồng tác dụng với dung dịch HNO3, người ta nút ống nghiệm bằng bông tẩm dung dịch kiềm. => Đúng. Vì sản phẩm phản ứng tạo ra NO2 là khí độc sẽ phản ứng với NaOH 2NaOH + 2NO2 → NaNO3 + NaNO2 + H2O => Có 4 ý đúng
Câu 33 :
Đốt cháy hoàn toàn 0,33 mol hỗn hợp X gồm metyl propionat, metyl axetat và 2 hidrocacbon mạch hở cần vừa đủ 1,27 mol O2 tạo ra 14,4g H2O. Nếu cho 0,33 mol X vào dung dịch Br2 dư thì số mol Br2 phản ứng tối đa là:
Đáp án : A Phương pháp giải :
Qui hỗn hợp về một dạng chung chỉ có C, H, O Tính số mol liên kết π trong X, trong nhóm COO => số mol π trong gốc hidrocacbon = nπ (X) – nπ (COO) = nBr2 (Dựa vào định luật bảo toàn nguyên tố phản ứng cháy) Lời giải chi tiết :
Gọi k là số liên kết π trong X => nCO2 – nH2O = (k – 1).nX => nπ(X) – nX = nCO2 – nH2O Đặt x là số mol gốc COO có trong X => nO(X) = 2x mol và nπ (COO) = x mol - Khi đốt cháy X: Bảo toàn Oxi: nO(X) + 2nO2 = 2nCO2 + nH2O => 2x + 2.1,27 = 2nCO2 + 0,8 => nCO2 = (0,87 + x) mol => nπ (X) = nCO2 – nH2O + nX = (0,87 + x) – 0,8 + 0,33 = 0,4 + x Vì chỉ có liên kết π ngoài COO mới phản ứng được với Br2 => nπ (gốc hidrocacbon) = nπ (X) – nπ (COO) = (0,4 + x) – x = 0,4 mol => nBr2 = 0,4 mol
Câu 34 :
Hợp chất X (CnH10O5) có vòng benzen và nhóm chức este. Trong phân tử X, phần trăm khối lượng của oxi lớn hơn 29%. Lấy 1 mol X tác dụng hết với dung dịch NaOH dư, sản phẩm hữu cơ thu được chỉ là 2 mol chất Y. Cho các phát biểu sau: (a) Chất X có 3 loại nhóm chức (b) Chất X làm quì tím ẩm chuyển sang màu đỏ (c) Số mol NaOH đã tham gia phản ứng là 4 mol (d) Khi cho 1 mol X tác dụng hết với NaHCO3 (trong dung dịch) hoặc Na đều thu được 1 mol khí (e) 1 mol chất Y tác dụng với vừa đủ 2 mol HCl (g) Khối lượng chất Y thu được là 364g Số phát biểu đúng là:
Đáp án : A Phương pháp giải :
Dựa vào dữ kiện %mO > 29% suy ra n < 15,5 Do 1 mol X phản ứng với NaOH thu được 2 mol Y => Y có chứa 1 vòng benzen => X có chứa 2 vòng benzen Mặt khác số C của X nhỏ hơn 15,5 nên suy ra CTCT của X và Y là: X: HO-C6H4-COO-C6H4-COOH Y: NaO-C6H4-COONa Xét các phát biểu để chọn ra phát biểu đúng. Lời giải chi tiết :
%mO > 29% => => 12n + 10 + 16.5 < 275,86 => n < 15,5 Do 1 mol X phản ứng với NaOH thu được 2 mol Y => Y có chứa 1 vòng benzen => X có chứa 2 vòng benzen Mặt khác số C của X nhỏ hơn 15,5 nên suy ra CTCT của X và Y là: X: HO-C6H4-COO-C6H4-COOH Y: NaO-C6H4-COONa Xét các phát biểu: (a) đúng vì X có các nhóm chức của phenol, este, axit (b) đúng vì X có chứa nhóm chức COOH nên làm quỳ tím ẩm chuyển đỏ (c) đúng vì 1 mol X phản ứng được với tối đa 4 mol NaOH HO-C6H4-COO-C6H4-COOH (X) + 4NaOH → 2NaO-C6H4-COONa + 3H2O (d) đúng vì: HO-C6H4-COO-C6H4-COOH (X) + NaHCO3 → HO-C6H4-COO-C6H4-COONa + H2O + CO2 (e) đúng, vì: NaO-C6H4-COONa (Y) + 2HCl → HO-C6H4-COOH + 2NaCl (g) đúng, mY = 2.182 = 364 gam Vậy có 6 phát biểu đúng
Câu 35 :
Tiến hành điện phân V lít dung dịch chứa Cu(NO3)2 1M và NaCl 0,5M (điện cực trơ) đến khi khối lượng dung dịch giảm m gam thì dừng điện phân. Cho 9,5g Fe vào dung dịch sau điện phân, kết thúc phản ứng thu được 1,12 lít khí NO thoát ra(sản phẩm khử duy nhất) và còn lại 5,7 gam hỗn hợp rắn không tan. Giá trị của m gần nhất với giá trị nào sau đây:
Đáp án : A Phương pháp giải :
Quá trình điện phân: Catot: Cu2+ + 2e → Cu Anot: 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e => Biện luận quá trình phản ứng dựa vào chất rắn sau phản ứng với Fe(chất nào còn dư) => Số mol các chất tham gia phản ứng Fe + dung dịch sau điện phân => Bảo toàn nguyên tố => số mol các chất trong V lít dung dịch ban đầu => số mol các chất điện phân => m Lời giải chi tiết :
Quá trình điện phân: Catot: Cu2+ + 2e → Cu Anot: 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e (Vì dung dịch sau điện phân + Fe tạo NO => sản phẩm điện phân có H+, không còn Cl-) - Sau phản ứng thu được hỗn hợp kim loại => Fe và Cu (nNO = 1,12: 22,4 = 0,05 mol) 3Fe + 8H+ + 2NO3- → Fe2+ + 2NO + 4H2O (Vì Fe dư nên chỉ tạo được Fe2+) Mol 0,075 0,2 ¬ 0,05 Vì sau phản ứng không còn Cl- => dung dịch chỉ gồm Cu(NO3)2 , NaNO3 và HNO3 Fe + Cu2+ → Fe2+ + Cu Mol x → x => mFe bđ - mrắn = mFe pứ - mCu => 9,5 – 5,7 = 56.(0,075 + x) – 64x => x = 0,05 mol => Bảo toàn N: 2nCu(NO3)2 bđ = 2nCu(NO3)2 sau + nHNO3 + nNaNO3 (mà nNaNO3 = nNaCl = ½ nCu(NO3)2 bđ) => 1,5nCu(NO3)2 bđ = ½ (2.0,05 + 0,2) = 0,2 mol => nCu2+ bị đp = 0,2 – 0,05 = 0,15 mol Bảo toàn electron: 2nCu = nH+ + 2nCl2 => nCl2 = ½ (0,15.2 – 0,2) = 0,05 mol => mgiảm = mCu + mCl2 + mO2 = 64.0,15 + 71.0,05 + 32.0,05 = 14,75g (gần nhất với giá trị 14,7g)
Câu 36 :
Cho hình vẽ mô tả thí nghiệm điều chế khí Cl2 từ MnO2 và dung dịch HCl:
Cho các phát biểu sau: (a) Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước (b) Có thể đổi vị trí bình (1) và bình (2) cho nhau (c) Sử dụng bông tẩm kiềm để tránh khí Cl2 thoát ra môi trường (d) Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất (e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn là NaCl và KMnO4 (f) Bình (2) đựng dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO (viên) Số phát biểu không đúng là:
Đáp án : A Lời giải chi tiết :
(a) Bình (1) để hấp thụ khí HCl, bình (2) để hấp thụ hơi nước => Đúng (b) Có thể đổi vị trí bình (1) và bình (2) cho nhau => Sai. Bình hấp thu nước luôn để sau cùng vì các quá trình khác luôn có hơi nước lẫn vào (c) Sử dụng bông tẩm kiềm để tránh khí Cl2 thoát ra môi trường => Đúng (d) Chất lỏng sử dụng trong bình (1) lúc đầu là nước cất => Sai. Dùng dung dịch MCl bão hòa (NaCl) vì NaCl hấp thụ tốt HCl Giải thích: Cl2 phản ứng với H2O theo cân bằng: Cl2 + H2O ↔ HCl + HClO. Trong dung dịch NaCl bão hòa thì nồng độ của ion Cl- rất lớn => cân bằng dịch chuyển theo chiều nghịch => giảm độ tan của Cl2 (e) Có thể thay thế HCl đặc bằng H2SO4 đặc, khi đó chất rắn là NaCl và KMnO4 => Đúng. [KMnO4 + HCl (H2SO4 + NaCl) ] (f) Bình (2) đựng dung dịch H2SO4 đặc, có thể thay thế bằng bình đựng CaO (viên) => Sai. Vì CaO + H2O tạo ra Ca(OH)2 có thể phản ứng với Cl2 Vậy có 3 phát biểu không đúng
Câu 37 :
Cho X, Y là 2 axit cacboxylic đơn chức mạch hở (MX < MY) ; T là este 2 chức tạo bởi X, Y và 1 ancol no mạch hở. Đốt cháy hoàn toàn 12,38g hỗn hợp E gồm X, Y, T bằng một lượng vừa đủ O2 thu được 0,47 mol CO2 và 0,33 mol H2O. mặt khác 12,38g E tác dụng với dung dịch AgNO3/NH3 dư, thu được 17,28g Ag. Phần trăm khối lượng của X trong E gần nhất với:
Đáp án : C Phương pháp giải :
Giả sử X gồm: HCOOH (x mol) ; CnH2n+2-2kO2 (y mol); HCOO-CmH2m-CnH2n+1-2k (z mol) => bảo toàn nguyên tố, khối lượng trong phản ứng cháy => số mol các chất => số mol nguyên tố trong E => Thiết lập biểu thức x, y, z, n, m, k theo số mol các chất trên - Dựa vào phản ứng tráng bạc => biện luận công thức các chất trong E và lập biểu thức theo số mol Ag => Giải hệ phương trình => x, y ,z => %m Lời giải chi tiết :
Giả sử X gồm: HCOOH (x mol) ; CnH2n+2-2kO2 (y mol); HCOO-CmH2m-CnH2n+1-2k (z mol) - Khi E + O2: bảo toàn khối lượng: mE + mO2 = mCO2 + mH2O => mO2 = 0,47.44 + 0,33.18 – 12,38 = 14,24g => nO2 = 0,445 mol Bảo toàn nguyên tố O: nO(E) = 2nCOO(E) = 2nCO2 + nH2O – 2nO2 = 0,38 mol => nCOO(E) = 0,19 mol = nE = x + y + 2z (1) - Khi E + AgNO3/NH3 tạo Ag => X phải là HCOOH => T là este của HCOOH => nAgNO3 = 2x + 2z = 17,28: 108 = 0,16 mol => x + z = 0,08 mol (2) => y + z = 0,11 mol Giả sử X gồm: HCOOH ; CnH2n+2-2kO2 ; HCOO-CmH2m-CnH2n+1-2k Bảo toàn nguyên tố: nCO2 = 0,47 = x + ny + (m + n + 1)z nH2O = 0,33 = x + (n + 1 – k)y + (m + n + 1 – k)z => nCO2 – nH2O = (k – 1)y + kz = 0,14 => k(y + z) – y = 0,14 => y = 0,11k – 0,14 < 0,11 => k < 2,3 +) k = 1 => y < 0 => Loại => k = 2 => y + 2z = 0,14 mol (3) Từ (1,2,3) => y = 0,08 ; z = 0,03 ; x = 0,05 mol => %mX(HCOOH)/E = 0,05.46: 12,38 = 18,58% (Gần nhất với giá trị 18,6%)
Câu 38 :
Hòa tan hoàn toàn a gam hỗn hợp X gồm Na, Na2O, K, K2O, Ba và BaO (trong đó oxi chiếm 7,99% về khối lượng) vào nước dư. Sau phản ứng, thu được dung dịch Y gồm NaOH, KOH và Ba(OH)2 có tỉ lệ mol tương ứng là 3: 2: 7 và 0,784 lít khí H2(đktc). Cho Y tác dụng với dung dịch gồm 0,02 mol Al2(SO4)3, 0,01 mol H2SO4 và 0,04 mol KHSO4 thu được m gam kết tủa. Giá trị của m là:
Đáp án : D Phương pháp giải :
Cho biết nAl3+ = a và nOH- = b, tính số mol kết tủa: + Với muối nhôm Các phản ứng xảy ra: Al3+ + 3OH- → Al(OH)3 (1) Al(OH)3 + OH- → [Al(OH)4]- (2) Phương pháp: Từ (1) và (2) ta rút ra kết luận: + Nếu b/a ≤ 3 thì kết tủa chưa bị hoà tan và nAl(OH)3= b/3 + Nếu 3 < b/a < 4 thì kết tủa bị hoà tan 1 phần Al3+ + 3OH- → Al(OH)3 (1) mol a → 3a → a Al(OH)3 + OH- → [Al(OH)4]- (2) Mol b-3a b-3a nAl(OH)3= 4a-b + Nếu b/a ≥ 4 thì kết tủa bị hoà tan hoàn toàn Lời giải chi tiết :
Qui đổi hỗn hơp thành Na (3u mol) ; K (2u mol) ; Ba (7u mol) và O (v mol) (Vì sau khi cho vào nước thu được nNaOH: nKOH: nBa(OH)2 = 3: 2: 7 = 3u: 2u: 7u) Bảo toàn electron: nNa + nK + 2nBa = 2nO + 2nH2 => 3u + 2u + 2.7u = 2v + 0,035.2 Lại có: %mO = 7,99% => 16v = 7,99%.(23.3u + 39.2u + 137.7u + 16v) Giải hệ PT => u = 0,01 ; v = 0,06 mol => nOH = 2v + 0,035.2 = 0,19 mol nH+ = 2nH2SO4 + nKHSO4 = 2.0,01 + 0,04 = 0,06 mol nAl3+ = 2nAl2(SO4)3 = 0,04 mol => nAl(OH)3 = 4nAl3+ - (nOH – nH+) => nAl(OH)3 = 0,03 mol nBa2+ = 0,07 mol và nSO4 = 0,11 mol => nBaSO4 = nBa = 0,07 mol => mrắn = mBaSO4 + mAl(OH)3 = 18,65g
Câu 39 :
Hỗn hợp E gồm 0,15 mol chất hữu cơ mạch hở X (C6H13O4N) và 0,2 mol este 2 chức Y (C4H6O4) tác dụng hết với dung dịch NaOH vừa đủ, đun nóng. Kết thúc phản ứng, cô cạn dung dịch, thu được hỗn hợp Z gồm 2 ancol đơn chức kết tiếp nhau trong dãy đồng đẳng và a gam hỗn hợp 3 muối khan (đều cùng có số cacbon trong phân tử, trong đó có 2 muối cacboxylic). Giá trị của a là:
Đáp án : D Phương pháp giải :
Biện luận công thức của Y => công thức của 2 ancol đồng đẳng kế tiếp => công thức cấu tạo của Y => thành phần của 3 muối trong a gam => a Lời giải chi tiết :
X, Y) + NaOH → Z(2 ancol đơn chức) + 3 muối khan (2 muối cacboxylic) => Este 2 chức Y phải là (COOCH3)2 => 2 ancol là CH3OH và C2H5OH => Y là CH3COONH3CH2COOC2H5 thỏa mãn 3 muối là: 0,2 mol (COONa)2 ; 0,15 mol CH3COONa và 0,15 mol NH2CH2COONa => a = 0,2.134 + 0,15.82 + 0,15.97 = 53,65g
Câu 40 :
Cho m gam hỗn hợp Cu, Fe3O4 vào 200 ml dung dịch chứa NaNO3 1M và H2SO4 2M thu được dung dịch Y và thấy 1,12 lít khí NO (đktc). Thêm dung dịch HCl dư vào dung dịch Y lại thấy thoát ra 0,336 lít khí NO (đktc), NO là sản phẩm khử duy nhất của NO3-. Giá trị của m là:
Đáp án : D Phương pháp giải :
- Qui hỗn hợp về dạng: KL, O => Công thức giải nhanh: ne = ne KL = nNO2 + 3nNO + 8nN2O + 10nN2 + 8nNH4NO3 + 2nO nH+ = 2nNO2 + 4nNO + 10nN2O + 12nN2 + 10nNH4NO3 + 2nO Lời giải chi tiết :
Ta có: nNO3 = nNaNO3 = 0,2 mol ; nSO4 = nH2SO4 = 0,4 mol Thêm HCl vào Y vẫn tạo NO chứng tỏ Y không còn H+, còn NO3- và Fe2+ => nH+ = 2nH2SO4 = 0,4.2 = 4nNO + 2nO => nO = 0,3 mol Bảo toàn nguyên tố Oxi => nFe3O4 = 0,075 mol nNO tổng = 0,065 mol < nNO3 => sau khi kết thúc tất cả quá trình thì NO3- vẫn dư Bảo toàn e: 2nCu + nFe3O4 = 3nNO tổng => nCu = 0,06 mol Vậy m = mCu + mFe2O3 = 0,06.64 + 0,075.232 = 21,24g |