Đề thi thử THPT QG môn Hóa trường THPT chuyên Đại học Vinh lần 1Đề bài
Câu 1 :
Chất nào sau đây có tính lưỡng tính?
Câu 2 :
Al2O3 không tan được trong dung dịch chứa chất nào sau đây?
Câu 3 :
Kim loại nào sau đây là kim loại kiềm thổ?
Câu 4 :
Polime nào sau đây được tổng hợp bằng phản ứng trùng ngưng
Câu 5 :
Cho các chất: tinh bột, xenlulozo, glucozo, fructozo, saccarozo. Số chất trong dãy thuộc loại polisaccarit là
Câu 6 :
Dãy gồm các kim loại đều có thể điều chế được bằng phương pháp nhiệt luyện là
Câu 7 :
Dung dịch chất X làm quỳ tím chuyển thành màu hồng. Chất X có thể là
Câu 8 :
Dung dịch của chất X làm quỳ tím hóa đỏ, dung dịch của chất Y làm quỳ tím hóa xanh. Trộn lẫn dung dịch X của hai chất lại thì xuất hiện kết tủa. Vậy X và Y có thể lần lượt là
Câu 9 :
Khí X được dùng nhiều trong ngành sản xuất nước giải khát và bia rượu. Tuy nhiên, việc gia tăng nồng độ khí X trong không khí là nguyên nhân làm trái đất nóng lên. Khí X là
Câu 10 :
Etyl axetat chủ yếu được dùng làm dung môi cho các phản ứng hóa học, cũng như để thực hiện công việc chiết các hóa chất khác. Công thức của etyl axetat là
Câu 11 :
Hóa chất nào sau đây có thể dùng để làm mềm nước có tính cứng tạm thời?
Câu 12 :
Cho dung dịch Na2S vào dung dịch chất X, thu được kết tủa đen. Chất X là.
Câu 13 :
Ở điều kiện thường, kim loại nào sau đây không tác dụng với nước?
Câu 14 :
Cho 34,9 gam hỗn hợp gồm CaCO3, KHCO3 và KCl tác dụng hết với 400 ml dung dịch HCl 1M, thu được dung dịch Y và 4,48 lít khí Z (đktc). Cho Y tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thu được m gam kết tủa. giá trị của m là
Câu 15 :
Cho các phản ứng sau: (a) NH4Cl + NaOH → NaCl + NH3 + H2O (b) NH4HCO3 + 2KOH → K2CO3 + NH3 + 2H2O (c) NaHCO3 + NaOH → Na2CO3 + H2O (d) Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O (e) Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH Số phản ứng có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O là
Câu 16 :
Cho từ từ đến hết dung dịch chứa 0,48 mol HCl vào dung dịch chứa đồng thời x mol Na2CO3 và 0,2 mol NaHCO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,032 lít CO2 (đktc). giá trị của x là
Câu 17 :
Amin X có công thức phân tử trùng với công thức đơn giản nhất. Đốt cháy hoàn toàn 1 lượng X cần dùng vừa đủ 0,475 mol O2, thu được 0,05 mol N2 và 19,5 gam hỗn hợp gồm CO2 và H2O. Công thức phân tử của X là
Câu 18 :
Từ các sơ đồ phản ứng sau: 2X1 + 2X2 → 2X3 + H2↑ X3 + CO2 → X4 X3 + X4 → X5 + X2 2X6 + 3X5 + 3X2 → 2Fe(OH)3↓ + 3CO2↑ + 6KCl Các chất thích hợp tương ứng với X3, X5, X6 lần lượt là
Câu 19 :
Trường hợp nào sau đây, kim loại bị ăn mòn điện hóa học?
Câu 20 :
Cho sơ đồ chuyển hóa: Xenlulozo \(\xrightarrow[{{t^0}}]{{ + {H_2}O/{H^ + }}}X\xrightarrow[{{t^0}}]{{ + Dung\,dich\,AgN{O_3}/N{H_3}(du)}}Y\xrightarrow{{ + Dung\,dich\,HCl}}Z\) Trong sơ đồ trên, các chất X, Y, Z lần lượt là
Câu 21 :
Ba dung dịch: Metylamin (CH3NH2), glyxin (Gly) và alanylglyxin (Ala - Gly) đều phản ứng được với
Câu 22 :
Este X mạch hở, có công thức phân tử C6H10O2. Cho X tác dụng với dung dịch NaOH, thu được hai hợp chất hữu cơ Y và Z. Cho Y tác dụng với dung dịch HCl hoặc cho Z tác dụng với nước brom đều thu được chất hữu cơ T. Công thức cấu tạo thu gọn của X là
Câu 23 :
Hình vẽ sau đây mô tả thí nghiệm điều chế khí Y từ hỗn hợp rắn gồm CaC2 và Al4C3: 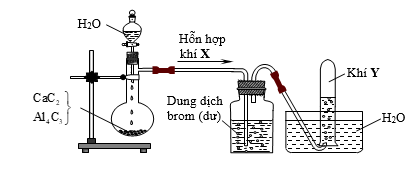 Khí Y là
Câu 24 :
Cho 51,75 gam bột kim loại M hóa trị II vào 200 ml dung dịch CuCl2 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được 51,55 gam hỗn hợp kim loại. Kim loại M là
Câu 25 :
Cho dãy các tơ sau: xenlulozo axetat, capron, nitron, visco, nilon -6, nilon -6,6. Số tơ trong dãy thuộc loại tơ poliamit là
Câu 26 :
Cho 250 ml dung dịch glucozơ phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 5,4 gam Ag. Nồng độ mol của dung dịch glucozơ đã dùng là
Câu 27 :
Cho các phát biểu sau: (a) Để loại bỏ lớp cặn CaCO3 trong ấm đun nước, phích đựng nước nóng người ta có thể dùng giấm ăn. (b) Để hàn gắn đường ray bị nứt, gãy người ta dùng hỗn hợp tecmit. (c) Để bảo vệ nồi hơi bằng thép, người ta thường lót dưới đáy nồi hơi những tấm kim loại bằng kẽm. (d) Hơp kim Na - K có nhiệt độ nóng chảy thấp, thường được dùng trong các thiết bị báo cháy. (e) Để bảo quản thực phẩm nhất là rau quả tươi, người ta có thể dùng SO2. Số phát biểu đúng là
Câu 28 :
Cho 300 ml dung dịch chưa đồng thời Ba(OH)2 1M và NaOH 1,5M vào 150 ml dung dịch chứa đồng thời AlCl3 1M và Al2(SO4)3 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. giá trị của m là
Câu 29 :
Thực hiện các thí nghiệm sau: (a) Cho dung dịch Ba(OH)2 tới dư vào dung dịch FeCl2. (b) Cho dung dịch KHSO4 vào dung dịch BaCl2. (c) Cho dung dịch Na2S vào dung dịch Fe2(SO4)3. (d) Sục khí CO2 tới dư vào dung dịch NaAlO2 (hay Na[Al(OH)4]) (e) Cho kim loại Zn vào lượng dư dung dịch FeCl3. (f) Sục khí SO2 vào lượng dư dung dịch Ca(OH)2. Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
Câu 30 :
Cho các phát biểu sau: (a) Glucozo được dùng để tráng gương, tráng ruột phích, làm thuốc tăng lực. (b) Thành phần chính của cồn 750 mà trong y tế thường dùng để sát trùng là metanol. (c) Để ủ hoa quả nhanh chín và an toàn hơn, có thể thay thế C2H2 bằng C2H4. (d) Hàm lượng tinh bột trong ngô cao hơn trong gạo. (e) Axit glutamic là thuốc ngăn ngừa và chữa trị các triệu chứng suy nhược thần kinh (mất ngủ, nhức đầu, ù tai, chóng mặt,...) Số phát biểu sai là
Câu 31 :
Hidro hóa hoàn toàn (xúc tác Ni, nung nóng) m gam trieste X (tạo bởi glixerol và các axit cacboxylic đơn chức, mạch hở) cần vừa đủ 1,792 lít H2 (đktc). Đun nóng m gam X với dung dịch NaOH (lấy dư 25% so với lượng cần thiết), sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y, thu được 18,44 gam chất rắn khan. Biết trong phân tử X có chứa 7 liên kết ∏. Giá trị của m là
Câu 32 :
Este X có công thức phân tử C8H12O4. Xà phòng hóa hoàn toàn X bằng dung dịch NaOH, thu được hỗn hợp hai muối của hai axit hữu cơ mạch hở X1, X2 đều đơn chức và một ancol X3. Biết X3 tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam; X1 có phản ứng tráng bạc và X2 không no, phân tử chỉ chứa một liên kết đôi (C=C), có mạch cacbon phân nhánh. Số đồng phân cấu tạo thỏa mãn của X là
Câu 33 :
Điện phân 600 ml dung dịch X chứa đồng thời NaCl 0,5M và CuSO4 a mol/l (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) đến khi thu được dung dịch Y có khối lượng giảm 24,25 gam so với khối lượng dung dịch X ban đầu thì ngừng điện phân. Nhúng một thanh sắt nặng 150 gam vào dung dịch Y đến khi các phản ứng xảy ra hoàn toàn, lấy thanh kim loại ra, rửa sạch, làm khô cân được 150,4 gam(giả thiết toàn bộ lượng kim loại tạo thành đều bám hết vào thanh sắt và không có sản phẩm khử của S+6 sinh ra). giá trị của a là
Câu 34 :
Đốt cháy hoàn toàn 0,25 mol hỗn hợp X gồm hai hidrocacbon mạch hở cần dùng vừa đủ 14 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2, sau khi các phản ứng xảy ra hoàn toàn thu được 30 gam kết tủa và một dung dịch có khối lượng giảm 4,3 gam so với khối lượng dung dịch Ca(OH)2 ban đầu. Mặt khác, cho 8,55 gam X trên tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được tối đa m gam kết tủa. Giá trị của m là
Câu 35 :
Dẫn từ từ khí CO2 vào dung dịch chứa đồng thời Ba(OH)2 và NaAlO2. Sự phụ thuộc của khối lượng kết tủa y (gam) vào thể tích khí CO2 tham gia phản ứng (x lít, đktc) được biểu thi bằng đồ thị sau: 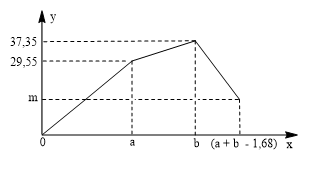 Giá trị của m là
Câu 36 :
Hỗn hợp E gồm sáu trieste X, Y, Z, T, P, Q đều có cùng số mol (MX < MY = MZ < MT = MP < MQ). Đun nóng hỗn hợp E với dung dịch NaOH vừa đủ thu được một ancol mạch hở F và 29,52 gam hỗn hợp G gồm hai muối của hai axit cacboxylic no, đơn chức, mạch hở. Cho toàn bộ F vào bình đựng Na dư, sau phản ứng xảy ra hoàn toàn thấy khối lượng bình tăng lên thêm 10,68 gam và có 4,032 lít khí H2 (đktc) thoát ra. Số nguyên tử cacbon có trong Q là
Câu 37 :
Hỗn hợp M chứa các chất hữu cơ mạch hở gồm tripeptit X, pentapeptit Y; Z (C4H11O2N) và T (C8H17O4N). Đun nóng 67,74 gam hỗn hợp M với dung dịch KOH vừa đủ, thu được 0,1 mol metylamin; 0,15 mol ancol etylic và dung dịch E. Cô cạn dung dịch E thu được hỗn hợ rắn Q gồm bốn muối khan của glyxin, alanin, valin và axit propionic (tỉ lệ mol giữa hai muối của analin và valin lần lượt là 10:3). Mặt khác, đốt cháy hoàn toàn Q cần dùng vừa đủ 2,9 mol O2, thu được CO2, H2O, N2 và 0,385 mol K2CO3. Phần trăm khối lượng của Y trong M có giá trị gần nhât với giá trị nào sau đây?
Câu 38 :
Hỗn hợp M gồm hai axit cacboxylic no, đơn chức, mạch hở X, Y (MX < MY); ancol no ba chức, mạch hở Z và trieste T tạo bởi hai axit và ancol trên. Cho 24 gam M tác dụng vừa đủ với dung dịch chứa 0,35 mol KOH, cô cạn dụng dịch sau phản ứng còn lại m gam muối khan. Mặt khác, đốt cháy hoàn toàn 24 gam M trên bằng lượng vừa đủ khí O2, thu được 0,75 mol CO2 và 0,7 mol H2O. Nhận xét nào su đây là sai?
Câu 39 :
Hòa tan hoàn toàn 3,92 gam bột Fe vào 44,1 gam dung dịch HNO3 50% thu được dung dịch X(không có ion NH4+, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi của nước). Cho X phản ứng với 200ml dung dịch chứa đồng thời KOH 0,5M và NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y thu được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 20,56 gam hỗn hợp chất rắn khan. Nồng độ phần trăm của Fe(NO3)2 trong dung dịch X là
Câu 40 :
Nung m gam hỗn hợp X gồm Fe, Cu, Fe(NO3)2, Cu(NO3)2 và FeCO3 trong bình chân không, thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 là 22,8 (giả sử khí NO2 sinh ra không tham gia phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch chứa đồng thời 0,08 mol KNO3 và 0,68 mol \(H_2SO_4\) (loãng), thu được dung dịch chỉ chứa 98,36 gam muối trung hòa của các kim loại và hỗn hợp khí T gồm NO và H2. Tỉ khối của T so với H2 là 12,2. Biết các phản ứng xảy ra hoàn toàn. giá trị của m gần nhất với giá trị nào sau đây?
Lời giải và đáp án
Câu 1 :
Chất nào sau đây có tính lưỡng tính?
Đáp án : C Phương pháp giải :
Chất vừa tác dụng được với axit, vừa tác dụng được với dd bazo thì có tính chất lưỡng tính Lời giải chi tiết :
NaHCO3 vừa tác dụng được với axit, vừa tác dụng được với dd bazo nên là chất lưỡng tính VD: NaHCO3 + HCl → NaCl + CO2↑ + H2O NaHCO3 + NaOH → Na2CO3 + H2O
Câu 2 :
Al2O3 không tan được trong dung dịch chứa chất nào sau đây?
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học của Al2O3 + Tác dụng được với dd axit, dd bazo Lời giải chi tiết :
Al2O3 không phản ứng được với dd NaCl
Câu 3 :
Kim loại nào sau đây là kim loại kiềm thổ?
Đáp án : B Phương pháp giải :
Kim loại kiềm thổ là các kim loại thuộc nhóm IIA trong bảng hệ thống tuần hoàn các nguyên tố hóa học Lời giải chi tiết :
Fe là kim loại chuyển tiếp Mg là kim loại kiềm thổ Al là kim loại nhóm IIIA K là kim loại kiềm
Câu 4 :
Polime nào sau đây được tổng hợp bằng phản ứng trùng ngưng
Đáp án : B Phương pháp giải :
Trùng ngưng là quá trình kết hợp nhiều phân tử nhỏ (monome) thành phân tử lớn (polime) đồng thời giải phóng những phân tử nhỏ khác như H2O... Lời giải chi tiết :
Poli(metyl meatacrylat). ; C. Poli (vinyl clorua). ; D. Poli (butađien - stiren) điều chế bằng phản ứng trùng hợp Poli(hexametylen -ađipamit) điều chế bằng phản ứng trùng ngưng nH2N-[CH2]6-NH2 + HOOC-[CH2]4-COOH (-NH-[CH2]6-NH-CO-[CH2]4-CO-)n + nH2O
Câu 5 :
Cho các chất: tinh bột, xenlulozo, glucozo, fructozo, saccarozo. Số chất trong dãy thuộc loại polisaccarit là
Đáp án : C Lời giải chi tiết :
Tinh bột và xenlulozo thuộc loại polisaccarit => có 2 chất
Câu 6 :
Dãy gồm các kim loại đều có thể điều chế được bằng phương pháp nhiệt luyện là
Đáp án : A Phương pháp giải :
Phương pháp nhiệt luyện (dùng kim loại mạnh để đẩy kim loại yếu ra khỏi dung dịch muối) => dùng để điều chế các kim loại từ Mg trở về sau trong dãy điện hóa Lời giải chi tiết :
Phương pháp nhiệt luyện (dùng kim loại mạnh để đẩy kim loại yếu ra khỏi dung dịch muối) => dùng để điều chế các kim loại từ Mg trở về sau trong dãy điện hóa A. thỏa mãn B. loại Ba C. Loại Na. D. Loại Ca
Câu 7 :
Dung dịch chất X làm quỳ tím chuyển thành màu hồng. Chất X có thể là
Đáp án : D Phương pháp giải :
Aminoaxit có dạng: (NH2)xR(COOH)y nếu x = y thì quỳ tím không chuyển màu nếu x > y thì quỳ tím chuyển sang màu xanh nếu x < y thì quỳ tím chuyến sang màu đỏ hoặc hồng Lời giải chi tiết :
HOOC-[CH2]2-CH(NH2)-COOH có 2 nhóm -COOH và 1 nhóm -NH2 nên có tính axit mạnh hơn tính bazo do vậy làm quỳ tím chuyển sang màu hồng.
Câu 8 :
Dung dịch của chất X làm quỳ tím hóa đỏ, dung dịch của chất Y làm quỳ tím hóa xanh. Trộn lẫn dung dịch X của hai chất lại thì xuất hiện kết tủa. Vậy X và Y có thể lần lượt là
Đáp án : A Phương pháp giải :
Chọn axit X và bazo Y tác dụng với nhau tạo ra kết tủa Lời giải chi tiết :
Dung dịch chất X làm quỳ tím chuyển sang màu đỏ => dd X có môi trường axit Dung dich chất Y làm quỳ tím hóa xanh => dd Y có môi trường bazo Trộn X với Y có kết tủa => X là H2SO4 và Y là Ba(OH)2 H2SO4 + Ba(OH)2 → BaSO4↓ + 2H2O
Câu 9 :
Khí X được dùng nhiều trong ngành sản xuất nước giải khát và bia rượu. Tuy nhiên, việc gia tăng nồng độ khí X trong không khí là nguyên nhân làm trái đất nóng lên. Khí X là
Đáp án : D Lời giải chi tiết :
CO2 được dùng nhiều trong ngành sản xuất nước giải khát và bia rượu, tuy nhiên, việc gia tăng nồng độ khí X trong không khí là nguyên nhân làm trái đất nóng lên.
Câu 10 :
Etyl axetat chủ yếu được dùng làm dung môi cho các phản ứng hóa học, cũng như để thực hiện công việc chiết các hóa chất khác. Công thức của etyl axetat là
Đáp án : B Phương pháp giải :
Tên este: RCOOR' = tên gốc R' + tên gốc RCOO + at Lời giải chi tiết :
Công thức của etyl axetat là CH3COOC2H5
Câu 11 :
Hóa chất nào sau đây có thể dùng để làm mềm nước có tính cứng tạm thời?
Đáp án : A Phương pháp giải :
Nước có tính cứng tạm thời chứa nhiều ion Mg2+, Ca2+ và HCO3- => để làm mềm nước ta loại bỏ được các ion Mg2+, Ca2+ ra khỏi dung dịch tức chuyển các ion này về dạng kết tủa Lời giải chi tiết :
Nước cứng tạm thời có chứa Mg(HCO3)2 và Ca(HCO3)2 Dùng Na2CO3 để kết tủa được ion Mg2+, Ca2+ có trong dung dịch Na2CO3 + Mg(HCO3)2 → MgCO3↓ + 2NaHCO3 Na2CO3 + Ca(HCO3)2 → CaCO3↓ + 2NaHCO3
Câu 12 :
Cho dung dịch Na2S vào dung dịch chất X, thu được kết tủa đen. Chất X là.
Đáp án : D Lời giải chi tiết :
Na2S + FeCl2 → FeS↓(đen) + 2NaCl
Câu 13 :
Ở điều kiện thường, kim loại nào sau đây không tác dụng với nước?
Đáp án : D Phương pháp giải :
Chỉ tất cả các kim loại kiềm và kiềm thổ (trừ Be, Mg) mới tác dụng với nước ở điều kiện thường. Lời giải chi tiết :
Cu không tác dụng với H2O ở nhiệt độ thường
Câu 14 :
Cho 34,9 gam hỗn hợp gồm CaCO3, KHCO3 và KCl tác dụng hết với 400 ml dung dịch HCl 1M, thu được dung dịch Y và 4,48 lít khí Z (đktc). Cho Y tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thu được m gam kết tủa. giá trị của m là
Đáp án : D Phương pháp giải :
BTNT "C": ∑nCaCO3+ KHCO3 = nCO2 = 0,2 (mol) BTKL ta có: mKCl = 34,9 - mCaCO3+ KHCO3 = ? (g) Khi cho dd Y tác dụng với AgNO3 có pu Cl- + Ag+ → AgCl↓ m↓ = mAgCl =? Lời giải chi tiết :
nHCl = 0,4.1 = 0,4 (mol) ; nCO2(đktc) = 4,48 :22,4 = 0,2 (mol) BTNT "C": ∑nCaCO3+ KHCO3 = nCO2 = 0,2 (mol) BTKL ta có: mKCl = 34,9 - mCaCO3+ KHCO3 = 34,9 - 0,2.100 = 14,9 (g) => nKCl = 14,9 : 74,5 = 0,2 (mol) Dung dịch Y chứa Ca2+, K +, Cl-: 0,6 (mol) (Do bảo toàn nguyên tố Cl trong HCl và KCl) Khi cho dd Y tác dụng với AgNO3 có pu Cl- + Ag+ → AgCl↓ 0,6 → 0,6 (mol) => Khối lượng kết tủa là: mAgCl = 0,6.143,5 = 86,1 (g)
Câu 15 :
Cho các phản ứng sau: (a) NH4Cl + NaOH → NaCl + NH3 + H2O (b) NH4HCO3 + 2KOH → K2CO3 + NH3 + 2H2O (c) NaHCO3 + NaOH → Na2CO3 + H2O (d) Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O (e) Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH Số phản ứng có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O là
Đáp án : B Phương pháp giải :
Viết các phương trình ion rút gọn của các phản ứng ra, chọn các phản ứng có phương trình ion rút gọn như đề bào cho. Lời giải chi tiết :
(a) NH4+ + OH- → NH3 + H2O (b) NH4+ + HCO3 - → NH3 + CO32- + 2H2O (c) HCO3- + OH- → CO32- + H2O (d) Ba2+ + HCO3- + OH- → BaCO3↓ + CO32- + 2H2O (d) Ba2+ + CO32- → BaCO3↓ Vậy chỉ có 1 phương trình (c) có có phương trình ion rút gọn HCO3‑ + OH‑ → CO32- + H2O
Câu 16 :
Cho từ từ đến hết dung dịch chứa 0,48 mol HCl vào dung dịch chứa đồng thời x mol Na2CO3 và 0,2 mol NaHCO3. Sau khi các phản ứng xảy ra hoàn toàn, thu được 4,032 lít CO2 (đktc). giá trị của x là
Đáp án : D Phương pháp giải :
Khi cho H+ từ từ vào dd hỗn hợp x (mol) CO32- và 0,2 mol HCO3- sẽ xảy ra phản ứng theo thứ tự H+ + CO32- → HCO3- H+ + HCO3- → CO2 + H2O Có khí CO2 thoát ra tức là phản ứng (1) đã xảy ra xong, CO32- pư hết Lời giải chi tiết :
nCO2(đktc) = 4,032 :22,4 = 0,18 (mol) Khi cho H+ từ từ vào dd hỗn hợp x (mol) CO32- và 0,2 mol HCO3- sẽ xảy ra phản ứng theo thứ tự H+ + CO32- → HCO3- x ← x (mol) H+ + HCO3- → CO2 + H2O (0,48-x) → (0,48-x) Có khí CO2 thoát ra tức là phản ứng (1) đã xảy ra xong, CO32- pư hết => nCO2 = 0,48 - x = 0,18 => x = 0,3 (mol)
Câu 17 :
Amin X có công thức phân tử trùng với công thức đơn giản nhất. Đốt cháy hoàn toàn 1 lượng X cần dùng vừa đủ 0,475 mol O2, thu được 0,05 mol N2 và 19,5 gam hỗn hợp gồm CO2 và H2O. Công thức phân tử của X là
Đáp án : A Phương pháp giải :
Đặt nCO2 = a (mol) và nH2O = b (mol) Ta có hệ phương trình: \(\left\{ \begin{gathered}{m_{hh}} = {m_{C{O_2}}} + {m_{{H_2}O}} = 19,5 \hfill \\ \xrightarrow{{BT\,:O}}2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}} \hfill \\ \end{gathered} \right.\left\{ \begin{gathered} a = ? \hfill \\ b = ? \hfill \\ \end{gathered} \right.\) Đặt công thức của amin là CxHyNt Ta có: x: y : z = nC : nH : nN = ? Lời giải chi tiết :
Đặt nCO2 = a (mol) và nH2O = b (mol) Ta có hệ phương trình: \(\left\{ \begin{gathered}{m_{hh}} = {m_{C{O_2}}} + {m_{{H_2}O}} = 19,5 \hfill \\ \xrightarrow{{BT\,:O}}2{n_{C{O_2}}} + {n_{{H_2}O}} = 2{n_{{O_2}}} \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} 44a + 18b = 19,5 \hfill \\ 2a + b = 2.0,475 \hfill \\ \end{gathered} \right. \Rightarrow \left\{ \begin{gathered} a = 0,3 \hfill \\ b = 0,35 \hfill \\ \end{gathered} \right.\) => nC = nCO2 = 0,3(mol) nH = 2nH2O = 2.0,35 = 0,7 (mol) nN = 2nN2 = 2.0,05 = 0,1 (mol) Đặt công thức của amin là CxHyNt Ta có: nC : nH : nN = 0,3 : 0,7 : 0,1 = 3 : 7 : 1 => Công thức phân tử của amin là C3H7N
Câu 18 :
Từ các sơ đồ phản ứng sau: 2X1 + 2X2 → 2X3 + H2↑ X3 + CO2 → X4 X3 + X4 → X5 + X2 2X6 + 3X5 + 3X2 → 2Fe(OH)3↓ + 3CO2↑ + 6KCl Các chất thích hợp tương ứng với X3, X5, X6 lần lượt là
Đáp án : C Phương pháp giải :
suy luận từ phương trình 2X6 + 3X5 + 3X2 → 2Fe(OH)3↓ + 3CO2↑ + 6KCl ra được X6, X5, X2 từ đó tìm ra các chất còn lại Lời giải chi tiết :
2X1 + 2X2 → 2X3 + H2↑ 2K + 2H2O → 2KOH + H2↑ X3 + CO2 → X4 KOH + CO2 → KHCO3 X3 + X4 → X5 + X2 KOH + KHCO3 → K2CO3 + H2O 2X6 + 3X5 + 3X2 → 2Fe(OH)3↓ + 3CO2↑ + 6KCl FeCl3 + K2CO3 + 3H2O → 2Fe(OH)3↓ + 3CO2↑ + 6KCl Vậy X3, X5, X6 lần lượt là KOH; K2CO3, FeCl3.
Câu 19 :
Trường hợp nào sau đây, kim loại bị ăn mòn điện hóa học?
Đáp án : B Phương pháp giải :
Ăn mòn điện hóa xảy ra khi + xuất hiện 2 cặp điện cực có bản chất khác nhau: Vd: KL-KL; KL - HK; KL - Hợp chất + các chất tiếp xúc trực tiếp hoặc gián tiếp với nhau thông qua dây dẫn + cùng nhúng trong một dung dịch chất điện li Lời giải chi tiết :
B thỏa mãn 3 điều kiện + xuất hiện 2 cặp kim loại khác nhau là Al3+/Al và Zn2+/Zn + 2 chất tiếp xúc trực tiếp với nhau + cùng nhúng trong dung dịch chất điện li là ZnSO4
Câu 20 :
Cho sơ đồ chuyển hóa: Xenlulozo \(\xrightarrow[{{t^0}}]{{ + {H_2}O/{H^ + }}}X\xrightarrow[{{t^0}}]{{ + Dung\,dich\,AgN{O_3}/N{H_3}(du)}}Y\xrightarrow{{ + Dung\,dich\,HCl}}Z\) Trong sơ đồ trên, các chất X, Y, Z lần lượt là
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học của cacbohidrat Lời giải chi tiết :
Xenlulozo \(\xrightarrow[{{t^0}}]{{ + {H_2}O/{H^ + }}}glucozo(X)\xrightarrow[{{t^0}}]{{ + Dung\,dich\,AgN{O_3}/N{H_3}(du)}}amoni\,gluconat(Y)\xrightarrow{{ + Dung\,dich\,HCl}}axit\,gluconic\,(Z)\) (C6H10O5)n + nH2O \(\xrightarrow{{{H^ + },{t^0}}}\) nC6H12O6 (glucozo) CH3OH-[CH2OH]4CH=O + 2AgNO3 + 3NH3 + H2O \(\xrightarrow{{{t^0}}}\) CH3OH-[CH2OH]4-COONH4 + 2Ag↓ + 2NH4NO3 (amoni gluconat) CH3OH-[CH2OH]4-COONH4 + HCl → CH3OH-[CH2OH]4-COOH + NH4Cl (axit gluconic)
Câu 21 :
Ba dung dịch: Metylamin (CH3NH2), glyxin (Gly) và alanylglyxin (Ala - Gly) đều phản ứng được với
Đáp án : D Phương pháp giải :
Dựa vào tính chất hóa học của amin, aminoaxit và peptit, từ đó chọn ra tính chất hóa học chung Lời giải chi tiết :
Metylamin (CH3NH2), glyxin (Gly) và alanylglyxin (Ala - Gly) đều phản ứng được với dd HCl CH3NH2 +HCl → CH3NH3Cl H2N-CH2-COOH + HCl → H3NCl-CH2-COOH H2N-CH(CH3)-CONH-CH2-COOH + 2HCl → H3N-CH(CH3)-COOH + H3NCl-CH2-COOH
Câu 22 :
Este X mạch hở, có công thức phân tử C6H10O2. Cho X tác dụng với dung dịch NaOH, thu được hai hợp chất hữu cơ Y và Z. Cho Y tác dụng với dung dịch HCl hoặc cho Z tác dụng với nước brom đều thu được chất hữu cơ T. Công thức cấu tạo thu gọn của X là
Đáp án : C Phương pháp giải :
C6H10O2 có độ bất bão hòa k = (6.2 +2 -10)/2 = 2 X + NaOH → Y + Z Y + HCl hoặc Z tác dụng với dd Br2 đều thu được T => Y và Z có cùng số C trong phân tử và Z là andehit Lời giải chi tiết :
C6H10O2 có độ bất bão hòa k = (6.2 +2 -10)/2 = 2 X + NaOH → Y + Z Y + HCl hoặc Z tác dụng với dd Br2 đều thu được T => Y và Z có cùng số C trong phân tử và Z là andehit => CTCT của X là: CH3CH2COOCH=CHCH3. CH3CH2COOCH=CHCH3. + NaOH → CH3CH2COONa (Y) + CH3CH2CH=O (Z) CH3CH2COONa + HCl → CH3CH2COOH (T) + NaCl CH3CH2CH=O + Br2 + H2O \(\xrightarrow{{M{n^{2 + }}}}\) CH3CH2COOH (T) + 2HBr
Câu 23 :
Hình vẽ sau đây mô tả thí nghiệm điều chế khí Y từ hỗn hợp rắn gồm CaC2 và Al4C3:  Khí Y là
Đáp án : C Phương pháp giải :
Viết PTHH của CaC2 và Al4C3 với nước từ đó xác định được hỗn hợp X và khí Y Lời giải chi tiết :
CaC2 + 2H2O → Ca(OH)2 + C2H2↑ Al4C3 + H2O → Al(OH)3↓ + CH4↑ Hỗn hợp khí X có chứa C2H2 và CH4. Cho hh này qua dd Br2 thì C2H2 bị giữ lại, còn CH4 thoát ra ngoài. C2H2 + 2Br2 → C2H2Br4 Vì CH4 không tan trong nước bằng cách đẩy nước. => Khí Y là CH4
Câu 24 :
Cho 51,75 gam bột kim loại M hóa trị II vào 200 ml dung dịch CuCl2 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được 51,55 gam hỗn hợp kim loại. Kim loại M là
Đáp án : C Phương pháp giải :
Sử dụng phương pháp tăng giảm khối lượng mKL giảm = mM pư - mCu Lời giải chi tiết :
nCuCl2 = 0,2.1 = 0,2 (mol) Phản ứng xảy ra hoàn toàn, sau phản ứng thu được hỗn hợp kim loại nên Cu phản ứng hết, M phản ứng dư. M + Cu2+ → M2+ + Cu↓ 0,2 ←0,2 → 0,2 (mol) Khối lượng kim loại giảm = mM pư - mCu sinh ra => 51,75 - 51,55 = 0,2.M - 0,2.64 => M = 65 (Zn)
Câu 25 :
Cho dãy các tơ sau: xenlulozo axetat, capron, nitron, visco, nilon -6, nilon -6,6. Số tơ trong dãy thuộc loại tơ poliamit là
Đáp án : C Phương pháp giải :
tơ poliamit là tơ có nhóm -CONH- trong phân tử nhưng các nhóm này không được tạo từ các gốc α-amino axit Lời giải chi tiết :
Số tơ trong dãy thuộc loại tơ poliamit: capron; nilon -6, nilon -6,6 => có 3 tơ
Câu 26 :
Cho 250 ml dung dịch glucozơ phản ứng hoàn toàn với lượng dư dung dịch AgNO3 trong NH3, thu được 5,4 gam Ag. Nồng độ mol của dung dịch glucozơ đã dùng là
Đáp án : A Lời giải chi tiết :
\({n_{Ag}} = \dfrac{{5,4}}{{108}} = 0,05\,\,mol\) \( \to {n_{glucozo}} = \dfrac{1}{2}{n_{Ag}} = 0,025\,\,mol\) \( \to {C_{M\,\,glucozo}} = \dfrac{{0,025}}{{0,25}} = 0,1\,\,M\)
Câu 27 :
Cho các phát biểu sau: (a) Để loại bỏ lớp cặn CaCO3 trong ấm đun nước, phích đựng nước nóng người ta có thể dùng giấm ăn. (b) Để hàn gắn đường ray bị nứt, gãy người ta dùng hỗn hợp tecmit. (c) Để bảo vệ nồi hơi bằng thép, người ta thường lót dưới đáy nồi hơi những tấm kim loại bằng kẽm. (d) Hơp kim Na - K có nhiệt độ nóng chảy thấp, thường được dùng trong các thiết bị báo cháy. (e) Để bảo quản thực phẩm nhất là rau quả tươi, người ta có thể dùng SO2. Số phát biểu đúng là
Đáp án : C Phương pháp giải :
Dựa vào kiến thức lí thuyết về vô cơ Lời giải chi tiết :
(a) đúng vì giấm ăn là dd CH3COOH từ 2-5% có thể loại bỏ được lớp cặn CaCO3 trong ấm theo PT CaCO3↓ + CH3COOH → (CH3COO)2Ca + H2O (b) đúng, hỗn hợp tecmit là hỗn hợp Al và FeO (c) đúng, vì nồi hơi bằng thép (hợp kim Fe và C) lót dưới đáy nồi miếng kim loại Zn để khi hiện tượng ăn mòn xảy ra thì Zn bị ăn mòn trước, tránh cho thép không bị ăn mòn (d) đúng (e) đúng Khí SO2 là một chất khử với tác dụng chống oxy hóa. Có hai phương pháp bảo quản rau quả sau khi thu hoạch bao gồm: sunfit hóa khí và sunfit hóa ướt + Sunfit hóa khí: SO2 được nạp vào bình chứa và được phun trực tiếp vào sản phẩm rau quả cần bảo quản. Phương pháp này khá tốn sức lao động và cần nhiều thùng chứa nên khá tốn kém. + Sunfit ướt: SO2 sẽ được nạp trực tiếp từ bình thép hoặc được điều chế bằng cách đốt lưu huỳnh trong phòng. Nhờ vậy khí SO2 sẽ chiếm đầy thể tích phòng và thấm vào bề mặt quả để phát huy tác dụng sát trùng.
Câu 28 :
Cho 300 ml dung dịch chưa đồng thời Ba(OH)2 1M và NaOH 1,5M vào 150 ml dung dịch chứa đồng thời AlCl3 1M và Al2(SO4)3 0,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kết tủa. giá trị của m là
Đáp án : C Phương pháp giải :
Lập tỉ lệ: + Nếu k ≤3 thì thu được kết tủa là Al(OH)3 Khi đó kết tủa thu được chứa Al(OH)3 và BaSO4 với nAl(OH)3 = 1/3 nOH- + Nếu 3 < k < 4 thì thu được Al(OH)3 và AlO2- Khi đó kết tủa thu được chứa Al(OH)3 và BaSO4 với nAl(OH)3 = 4nAl3+ - nOH- + Nếu k ≥ 4 thì thu được AlO2- Khi đó kết tủa thu được chỉ là BaSO4 Lời giải chi tiết :
nBa(OH)2 = 0,3.1 = 0,3 (mol) ; nNaOH = 0,3.1,5 = 0,45 (mol) => ∑nOH- = 2nBa(OH)2 + nNaOH = 0,3.2 + 0,45 = 1,05 (mol) nBa2+ = 0,3 (mol) nAlCl3= 0,15.1 = 0,15 (mol); nAl2(SO4)3 = 0,15.0,5 = 0,075 (mol) => ∑nAl3+ = nAlCl3 + 2nAl2(SO4)3 = 0,15 + 0,075.2 = 0,3 (mol) ; nso42- = 0,225 (mol) Ta có: \(3 < \frac{{{n_{O{H^ - }}}}}{{{n_{A{l^{3 + }}}}}} = \frac{{1,05}}{{0,3}} = 3,5 < 4\)=> tạo kết tủa Al(OH)3 và AlO2- nAl(OH)3 = 4nAl3+ - nOH- = 4.0,3 - 1,05 = 0,15 (mol) Vây sau phản ứng thu được kết tủa Al(OH)3: 0,15 mol và BaSO4 :0,225 (mol) => m↓ = 0,15.78 + 0,225.233 = 64,125 (g)
Câu 29 :
Thực hiện các thí nghiệm sau: (a) Cho dung dịch Ba(OH)2 tới dư vào dung dịch FeCl2. (b) Cho dung dịch KHSO4 vào dung dịch BaCl2. (c) Cho dung dịch Na2S vào dung dịch Fe2(SO4)3. (d) Sục khí CO2 tới dư vào dung dịch NaAlO2 (hay Na[Al(OH)4]) (e) Cho kim loại Zn vào lượng dư dung dịch FeCl3. (f) Sục khí SO2 vào lượng dư dung dịch Ca(OH)2. Sau khi các phản ứng xảy ra hoàn toàn, số thí nghiệm thu được kết tủa là
Đáp án : B Phương pháp giải :
Viết các phản ứng xảy ra, chú ý đến dữ kiện đề bài cho chất nào dư Lời giải chi tiết :
(a) Ba(OH)2 + FeCl2 → BaCl2 + Fe(OH)2↓ (b) 2KHSO4 + BaCl2 → BaSO4↓ + 2HCl + K2SO4 (c) 3Na2S + Fe2(SO4)3 + 6H2O → 2Fe(OH)3↓ + 3H2S↑ + 3Na2SO4 (d) CO2 + NaAlO2 + 2H2O → Al(OH)3↓ + NaHCO3 (e) Zn + 2FeCl3 dư → ZnCl2 + 2FeCl2 (f) SO2 + Ca(OH)2 dư → CaSO3↓ + H2O => có 5 thí nghiệm thu được kết tủa (trừ e)
Câu 30 :
Cho các phát biểu sau: (a) Glucozo được dùng để tráng gương, tráng ruột phích, làm thuốc tăng lực. (b) Thành phần chính của cồn 750 mà trong y tế thường dùng để sát trùng là metanol. (c) Để ủ hoa quả nhanh chín và an toàn hơn, có thể thay thế C2H2 bằng C2H4. (d) Hàm lượng tinh bột trong ngô cao hơn trong gạo. (e) Axit glutamic là thuốc ngăn ngừa và chữa trị các triệu chứng suy nhược thần kinh (mất ngủ, nhức đầu, ù tai, chóng mặt,...) Số phát biểu sai là
Đáp án : B Phương pháp giải :
Xem lại lý thuyết về hidrocacbon không no, aminoaxit, ancol và glucozo Lời giải chi tiết :
(a), (c), (e) đúng (b) sai vì Thành phần chính của cồn 750 mà trong y tế thường dùng để sát trùng là etanol (d) hàm lượng tinh bột trong ngô thấp hơn trong gạo => có 2 phát biểu sai
Câu 31 :
Hidro hóa hoàn toàn (xúc tác Ni, nung nóng) m gam trieste X (tạo bởi glixerol và các axit cacboxylic đơn chức, mạch hở) cần vừa đủ 1,792 lít H2 (đktc). Đun nóng m gam X với dung dịch NaOH (lấy dư 25% so với lượng cần thiết), sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y, thu được 18,44 gam chất rắn khan. Biết trong phân tử X có chứa 7 liên kết ∏. Giá trị của m là
Đáp án : D Phương pháp giải :
Sử dụng bảo toàn liên kết pi Lời giải chi tiết :
nH2 = 0,08 mol X có chứa 7 liên kết pi nên X + H2 theo thỉ lệ 1 : 4 ( vì X chứa 3 nhóm -COO) 0,02 mol X + NaOH → 18,44 gam rắn + 0,02 mol C3H5(OH)3 nNaOH =0,02.3.1,25 = 0,075 mol ( Vì NaOH lấy dư 25% so với cần thiết ) bảo toàn khối lượng có m + 0,075.40 = 18,44 + 0,02.92 → m = 17,28 g
Câu 32 :
Este X có công thức phân tử C8H12O4. Xà phòng hóa hoàn toàn X bằng dung dịch NaOH, thu được hỗn hợp hai muối của hai axit hữu cơ mạch hở X1, X2 đều đơn chức và một ancol X3. Biết X3 tác dụng với Cu(OH)2 tạo dung dịch màu xanh lam; X1 có phản ứng tráng bạc và X2 không no, phân tử chỉ chứa một liên kết đôi (C=C), có mạch cacbon phân nhánh. Số đồng phân cấu tạo thỏa mãn của X là
Đáp án : A Phương pháp giải :
Este X tạo bởi X1 và X2 là 2 axit đơn chức mạch hở với ancol X3 nên X là este hai chức X1 là axit đơn chức mạch hở có phản ứng tráng bạc nên X1 là HCOOH X3 là ancol 2 chức Từ đó viết các CTCT thỏa mãn Lời giải chi tiết :
Este X tạo bởi X1 và X2 là 2 axit đơn chức mạch hở với ancol X3 nên X là este hai chức X1 là axit đơn chức mạch hở có phản ứng tráng bạc nên X1 là HCOOH X3 là ancol 2 chức Ta có các công thức thỏa mãn sau 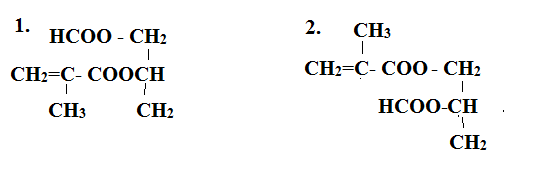 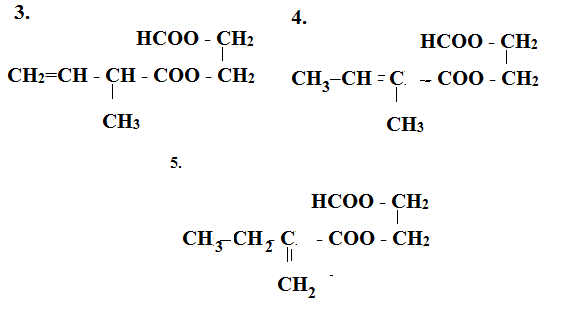 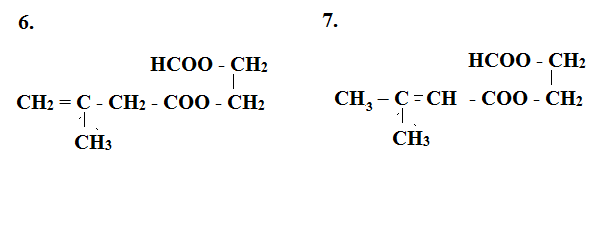
Câu 33 :
Điện phân 600 ml dung dịch X chứa đồng thời NaCl 0,5M và CuSO4 a mol/l (điện cực trơ, màng ngăn xốp, hiệu suất điện phân 100%, bỏ qua sự hòa tan của khí trong nước và sự bay hơi của nước) đến khi thu được dung dịch Y có khối lượng giảm 24,25 gam so với khối lượng dung dịch X ban đầu thì ngừng điện phân. Nhúng một thanh sắt nặng 150 gam vào dung dịch Y đến khi các phản ứng xảy ra hoàn toàn, lấy thanh kim loại ra, rửa sạch, làm khô cân được 150,4 gam(giả thiết toàn bộ lượng kim loại tạo thành đều bám hết vào thanh sắt và không có sản phẩm khử của S+6 sinh ra). giá trị của a là
Đáp án : A Phương pháp giải :
Viết các bán phản ứng xảy ra tại catot, anot Dùng bảo toàn e đối với quá trình điện phân Tăng giảm khối lượng đối với dd Y + Fe Lời giải chi tiết :
Dung dịch Y thu được tác dụng với thanh Fe làm cho thanh Fe tăng khối lượng nên Y có Cu2+ dư Xét phản ứng điện phân dung dịch X Tại K (-): Cu+2 + 2e → Cu Tại A (+) : 2Cl - → Cl2 + 2e nNaCl = 0,6.0,5=0,3 mol Giả sử Cl- điện phân hết thì nCu = =0,15 mol → mdd giảm = mCu + mCl2 = 0,15.64 + 0,3.35,5 = 20,25 < 24,25 => vô lí → tại A xảy ra thêm phản ứng sau: 2H2O → O2 + 4H+ + 4e y → 4y → 4y (mol) → nCu phản ứng = → mdung dịch giảm = mCu + mCl2 + mO2 => 64. (0,15+2y) + 0,15.71 + 32y = 24,25 => y = 0,025 (mol) Dung dịch Y chứa: H+: 0,1 (mol); Cu2+ dư: z (mol) ; SO42-, Na+ Xét dung dịch Y phản ứng vói Fe Fe + Cu2+ → Fe2+ + Cu↓ z ← z → z (mol) Fe + 2H+ → Fe2+ + H2↑ 0,05 ←0,1 (mol) Khối lượng kim loại tăng = mCu - mFe pư => 150,04 -150 = 64z - (z + 0,05).56 => z = 0,4 => nCu2+ ban đầu = 0,15 + 2y+ z = 0,15 + 2.0,025 + 0,4 = 0,6 (mol) → a = 0,6 : 0,6 = 1M
Câu 34 :
Đốt cháy hoàn toàn 0,25 mol hỗn hợp X gồm hai hidrocacbon mạch hở cần dùng vừa đủ 14 lít O2 (đktc). Hấp thụ toàn bộ sản phẩm cháy vào bình đựng dung dịch Ca(OH)2, sau khi các phản ứng xảy ra hoàn toàn thu được 30 gam kết tủa và một dung dịch có khối lượng giảm 4,3 gam so với khối lượng dung dịch Ca(OH)2 ban đầu. Mặt khác, cho 8,55 gam X trên tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được tối đa m gam kết tủa. Giá trị của m là
Đáp án : A Phương pháp giải :
Khi cho sản phẩm cháy vào dung dịch Ca(OH)2 thì mdd giảm = mkết tủa - mCO2 – mH2O bảo toàn nguyên tố O, C, biện luận Lời giải chi tiết :
0,25 mol X + 0,625 mol O2 → x mol CO2 + y mol H2O Khi cho sản phẩm cháy vào dung dịch Ca(OH)2 thì mdd giảm = mkết tủa - mCO2 – mH2O = 30 – 44x – 18 y = 4,3 → 44x + 18y = 25,7 bảo toàn nguyên tố O có 0,625.2 = 2x + y → x = 0,4 mol và y = 0,45 mol X có số →X có CH4 chất còn lại là CnH2n+2-2k ( với k là số liên kết pi) với số mol lần lượt là a và b mol Khi đó ta có a + b = 0,25 mol a + bn = 0,4 mol 2a + b(n+1-k) = 0,45 Từ 3 phương trình trên có b.k = 0,2 Với k = 1 → b = 0,2 → a = 0,05 → n = 1,75 loại Với k = 2 → b = 0,1 → a = 0,15 → n = 2,5 loai Với k = 3 → b = 0,2/3 → a = 0,183 → n = 3,25 loại Với k = 4 → b = 0,05 → a = 0,2 mol → n = 4 → chất còn lại trong X là C4H2 : CH ≡ C – C ≡ CH → 0,2 mol X có m = 0,05. 50 +0,2.16= 5,7 g Nên trong 8,55 gam X có nC4H2 = CH ≡ C – C ≡ CH → Ag- C ≡ C – C ≡ C- Ag 0,075 0,075 mol → mkết tủa = 0,075.264 =19,8
Câu 35 :
Dẫn từ từ khí CO2 vào dung dịch chứa đồng thời Ba(OH)2 và NaAlO2. Sự phụ thuộc của khối lượng kết tủa y (gam) vào thể tích khí CO2 tham gia phản ứng (x lít, đktc) được biểu thi bằng đồ thị sau:  Giá trị của m là
Đáp án : D Phương pháp giải :
Chia đồ thị ra làm 4 giai đoạn + gđ 1: đồ thị đi lên nhanh và tại giá trị nCO2 = a (mol), mkết tủa = 29,55 (g) thì BaCO3 đạt max Ba(OH)2 + CO2 → BaCO3 + H2O + gđ 2: đồ thị đi lên đến cực đại thì Al(OH)3 đạt max Ba(OH)2 + CO2 → BaCO3 + H2O NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3 + gđ 3: đồ thị đi xuống: BaCO3 bị hòa tan dần BaCO3 + CO2 + H2O → Ba(HCO3)2 Tính toán theo PTHH Lời giải chi tiết :
Tại thời điển VCO2 = a lít thì Ba(OH)2 + CO2 → BaCO3 + H2O 0,15 → 0,15 mol → a = 3,36 lít Tại thời điển VCO2 = b lít thì Ba(OH)2 + CO2 → BaCO3 + H2O 0,15 → 0,15 mol NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3 → mAl(OH03 = 37,35 – 29,55 = 7,8 g → nAl(OH)3 = 0,1 mol → b = 0,25.22,4 = 5,6 lít Tại thời điểm VCO2= a + b – 1,68 = 7,28 lít → nCO2 = 0,325 mol Khi đó xảy ra các phản ứng sau : Ba(OH)2 + CO2 → BaCO3 + H2O 0,15 → 0,15 mol NaAlO2 + CO2 + 2H2O → NaHCO3 + Al(OH)3 0,1 0,1 BaCO3 + CO2 + H2O → Ba(HCO3)2 0,075 0,075 →mkết tủa = mBaCO3 + mAl(OH)3 = 0,075.197 + 0,1.78 = 22,575 g
Câu 36 :
Hỗn hợp E gồm sáu trieste X, Y, Z, T, P, Q đều có cùng số mol (MX < MY = MZ < MT = MP < MQ). Đun nóng hỗn hợp E với dung dịch NaOH vừa đủ thu được một ancol mạch hở F và 29,52 gam hỗn hợp G gồm hai muối của hai axit cacboxylic no, đơn chức, mạch hở. Cho toàn bộ F vào bình đựng Na dư, sau phản ứng xảy ra hoàn toàn thấy khối lượng bình tăng lên thêm 10,68 gam và có 4,032 lít khí H2 (đktc) thoát ra. Số nguyên tử cacbon có trong Q là
Đáp án : A Phương pháp giải :
Xét ancol F F là ancol 3 chức nên F + Na → 3/2 H2 Ta có nH2 = 0,18 mol → nF = 0,12 mol Khối lượng bình Na tăng là mbình tăng = mG – mH2 = 10,68 → mG = 10,68 + 0,18.2 = 11,04 g →MF = 92 → F là C3H8O3( glixerol) Xét muối G có nG = 3nF = 3.0,12 =0,36 mol →MG = 29,52 : 0,36 = 82 → G có CTTB là RCOONa thì MR = 15 → G có một muối là HCOONa Từ đó biện luận ra muối còn lại Lời giải chi tiết :
E + NaOH → muối G + ancol F Xét ancol F F là ancol 3 chức nên F + Na → 3/2 H2 Ta có nH2 = 0,18 mol → nF = 0,12 mol Khối lượng bình Na tăng là mbình tăng = mG – mH2 = 10,68 → mG = 10,68 + 0,18.2 = 11,04 g →MF = 92 → F là C3H8O3( glixerol) Xét muối G có nG = 3nF = 3.0,12 =0,36 mol →MG = 29,52 : 0,36 = 82 → G có CTTB là RCOONa thì MR = 15 → G có một muối là HCOONa Vì E gồm các este có cùng số mol và este được tạo từ 2 axit → 2 muối có số mol bằng nhau → muối còn lại có CTPT là CnH2n+1COONa → → muối còn lại C2H5COONa → X tạo bới (HCOO)3C3H5 Y và Z là 2 đồng phân của este tạo bởi (HCOO)2(C2H5COO)C3H5 T và P là 2 đồng phân của (HCOO)(C2H5COO)2C3H5 Q là (C2H5COO)3C3H5
Câu 37 :
Hỗn hợp M chứa các chất hữu cơ mạch hở gồm tripeptit X, pentapeptit Y; Z (C4H11O2N) và T (C8H17O4N). Đun nóng 67,74 gam hỗn hợp M với dung dịch KOH vừa đủ, thu được 0,1 mol metylamin; 0,15 mol ancol etylic và dung dịch E. Cô cạn dung dịch E thu được hỗn hợ rắn Q gồm bốn muối khan của glyxin, alanin, valin và axit propionic (tỉ lệ mol giữa hai muối của analin và valin lần lượt là 10:3). Mặt khác, đốt cháy hoàn toàn Q cần dùng vừa đủ 2,9 mol O2, thu được CO2, H2O, N2 và 0,385 mol K2CO3. Phần trăm khối lượng của Y trong M có giá trị gần nhât với giá trị nào sau đây?
Đáp án : A Phương pháp giải :
Do sau phản ứng thu được CH3NH2 và C2H5OH và C2H5COOK nên suy ra: Z: C2H5COONH3CH3 T: C2H5COOH3N-CH(CH3)-COOC2H5 Do peptit được tạo bởi Gly, Ala, Val nên ta quy đổi hỗn hợp X, Y thành CONH, CH2 và H2O (nH2O = npeptit) Sử dụng định luật bảo toàn khối lượng và bảo toàn nguyên tố để giải. Lời giải chi tiết :
Do sau phản ứng thu được CH3NH2 và C2H5OH và C2H5COOK nên suy ra: Z: C2H5COONH3CH3 T: C2H5COOH3N-CH(CH3)-COOC2H5 nZ = nCH3NH2 = 0,1 mol; nT = nC2H5OH = 0,15 mol => nC2H5COOK = nZ + nT = 0,25 mol nKOH = 2nK2CO3 = 2.0,385 = 0,77 mol Sơ đồ bài toán: \(67,74(g)M\left\{ \begin{gathered}X(3) \hfill \\ Y(5) \hfill \\Z:{C_2}{H_5}COON{H_3}C{H_3}(0,1\,mol) \hfill \\ T:{C_2}{H_5}COO{H_3}NCH(C{H_3})C{\text{OO}}{{\text{C}}_{\text{2}}}{{\text{H}}_{\text{5}}}{\text{(0,15}}\,{\text{mol)}} \hfill \\ \end{gathered} \right.\xrightarrow{{ + KOH:0,77}}\left| \begin{gathered} {\text{dd}}\,E\left\{ \begin{gathered} Gly - K \hfill \\ Ala - K \hfill \\ Val - K \hfill \\ {C_2}{H_5}COOK:0,25 \hfill \\ \end{gathered} \right.\xrightarrow{{ + O2;2,9}}\left\{ \begin{gathered}C{O_2} \hfill \\ {H_2}O \hfill \\{N_2} \hfill \\{K_2}C{O_3}:0,385 \hfill \\ \end{gathered} \right. \hfill \\ \left\{ \begin{gathered} C{H_3}N{H_2}:0,1 \hfill \\ {C_2}{H_5}OH:0,15 \hfill \\ \end{gathered} \right. \hfill \\ \end{gathered} \right.\) * Xác định số mol O2 để đốt muối do X, Y tạo ra: nAla-K (do T) = nT = 0,15 mol nC2H5COOK = 0,25 mol C3H6O2NK + 3,75O2 → 0,5K2CO3 + 2,5CO2 + 3H2O + 0,5N2 0,15 → 0,5625 C3H5O2K + 3,5O2 → 0,5K2CO3 + 2,5CO2 + 2,5H2O + 0,5N2 0,25 → 0,875 nO2(muối do X, Y) = nO2 - nO2(đốt muối do T) - nO2(đốt C2H5COOK) = 2,9 - 0,5625 - 0,875 = 1,4625 mol *Do peptit được tạo bởi Gly, Ala, Val nên ta quy đổi hỗn hợp X, Y thành CONH, CH2 và H2O (nH2O = npeptit) mX,Y = 67,74 - 0,1.105 + 0,15.191 = 28,59 gam nKOH (pư X, Y) = 0,77 - nZ - 2nT = 0,77 - 0,1 - 0,15.2 = 0,37 mol Ta có sơ đồ sau: \(28,59(g)X,Y\left\{ \begin{gathered} CONH:0,37 \hfill \\ C{H_2}:x \hfill \\ {H_2}O \hfill \\ \end{gathered} \right.\xrightarrow{{ + KOH:0,37}}Muoi\left\{ \begin{gathered} {\text{COO}}K:0,37 \hfill \\ N{H_2}:0,37 \hfill \\ C{H_2}:x \hfill \\ \end{gathered} \right.\xrightarrow{{ + O2:1,4625}}\left\{ \begin{gathered} {K_2}C{O_3}:0,185 \hfill \\ C{O_2}:x + 0,185 \hfill \\ {H_2}O:x + 0,37 \hfill \\ \end{gathered} \right.\) BTNT "O": 2nCOOK + 2nO2 (đốt muối do X, Y) = 3nK2CO3 + 2nCO2 + nH2O => 0,37.2 + 2.1,4625 = 3.0,185 + 2(x + 0,185) + x + 0,37 => x = 0,79 mH2O(X, Y) = mX,Y - mCONH - mCH2 = 28,59 - 0,37.43 - 0,79.14 = 1,62 gam => nH2O = 0,09 mol *Đặt nX = a và nY = b (mol) nX,Y = a + b = 0,09 nKOH = 3nX + 5nY => 3a + 5b = 0,37 Giải hệ thu được a = 0,04 và b = 0,05 *Xét quá trình thủy phân M: nH2O = nX + nY + nZ + nT = 0,04 + 0,05 + 0,1 + 0,15 = 0,34 mol BTKL: mM + mKOH = m muối + mCH3NH2 + mC2H5OH + mH2O => 67,74 + 0,77.56 = m muối + 0,1.31 + 0,15.46 + 0,34.18 => m muối = 94,74 gam Đặt nGly-K = u; nAlaK = 10v và nVal-K = 3v (mol) BTNT "K": nKOH = u + 10v + 3v = 0,77 m muối = 113u + 127.10v + 155.3v + 0,25.112 = 94,74 Giải hệ thu được u = 0,13 và y = 0,03 => nGlyK = 0,13 mol; nAlaK(do X,Y) = 0,3 - 0,15 = 0,15 mol; nValK = 0,09 mol Giả sử X, Y có công thức: X: GlynAlamVal3-n-m (0,04 mol) Y: Glyn'Alam'Val5-n'-m' (0,05 mol) nGlyK = 0,04n + 0,05n' = 0,13 chỉ có nghiệm n = 2 và n' = 1 thỏa mãn nAlaK = 0,04m + 0,05m' = 0,15 chỉ có nghiệm m = m = 0 và m' = 3 thỏa mãn Vậy X là Gly2Val (0,04 mol) và GlyAla3Val (0,05 mol) => %mY = 0,05.(75 + 89.3 + 117 - 4.18)/67,74.100% = 28,565% gần nhất với 28,55%
Câu 38 :
Hỗn hợp M gồm hai axit cacboxylic no, đơn chức, mạch hở X, Y (MX < MY); ancol no ba chức, mạch hở Z và trieste T tạo bởi hai axit và ancol trên. Cho 24 gam M tác dụng vừa đủ với dung dịch chứa 0,35 mol KOH, cô cạn dụng dịch sau phản ứng còn lại m gam muối khan. Mặt khác, đốt cháy hoàn toàn 24 gam M trên bằng lượng vừa đủ khí O2, thu được 0,75 mol CO2 và 0,7 mol H2O. Nhận xét nào su đây là sai?
Đáp án : A Phương pháp giải :
Quy đổi hỗn hợp M thành CnH2nO2 ; CmH2m+2O3 : a mol và H2O : -b mol Bảo toàn C có nCO2 = 0,35n + am = 0,75 mol Bảo toàn H có 2nH2O = 0.35.2n + a.(2m+2) – 2b = 0,7.2 → từ 2 phương trình trên có a – b = - 0,05 Khối lượng của hỗn hợp M là 0,35(14n + 32) + a.(14m+ 50) – 18b = 24 Từ đó suy ra a, b và xét các kết luận đúng sai Lời giải chi tiết :
Quy đổi hỗn hợp M thành CnH2nO2 ; CmH2m+2O3 : a mol và H2O : -b mol Vì M phản ứng vừa đủ với 0,35 mol KOH nên naxit = 0,35 mol → CnH2nO2 : 0,35 mol Đốt cháy M Bảo toàn C có nCO2 = 0,35n + am = 0,75 mol Bảo toàn H có 2nH2O = 0.35.2n + a.(2m+2) – 2b = 0,7.2 → từ 2 phương trình trên có a – b = - 0,05 Khối lượng của hỗn hợp M là 0,35(14n + 32) + a.(14m+ 50) – 18b = 24 → 14.(0,35n + am) + 32.0,35 + 50a – 18b = 24 → 50a – 18b = 2,3 → a = 0,1 mol và b = 0,15 mol →neste = 1/3 .b = 0,05 mol → B đúng → 0,35n + 0,1m = 0,75mol Vì m ≥ 3 do đây là ancol 3 chức nên thỏa mãn m = 3 và n = 9/7 ( vì n là số C trung bình của 2 axit) → X là HCOOH → %H trong X = 4,35% → D đúng 24gam M + 0,35 mol KOH → 0,35 mol CnH2n-1O2K Với n = 9/7 → m = 30,8 → C đúng → A sai
Câu 39 :
Hòa tan hoàn toàn 3,92 gam bột Fe vào 44,1 gam dung dịch HNO3 50% thu được dung dịch X(không có ion NH4+, bỏ qua sự hòa tan của các khí trong nước và sự bay hơi của nước). Cho X phản ứng với 200ml dung dịch chứa đồng thời KOH 0,5M và NaOH 1M. Sau khi các phản ứng xảy ra hoàn toàn, lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y thu được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 20,56 gam hỗn hợp chất rắn khan. Nồng độ phần trăm của Fe(NO3)2 trong dung dịch X là
Đáp án : C Phương pháp giải :
Bảo toàn điện tích với các chất trong dd Z Bảo toàn nguyên tố N Bảo toàn khối lượng có mFe + mDD HNO3 = mX + mkhí Lời giải chi tiết :
0,07 mol Fe + 0,35 mol HNO3 → DD X X + 0,1 mol KOH + 0,2 mol NaOH → muối Z Muối Z có K+ : 0,1 mol; Na+ : 0,2 mol; NO3- : x mol và OH- : y mol Bảo toàn điện tích có x + y = 0,3 mol Khi nhiệt phân Z thì NO3- → NO2- →mmuối = 39.0,1 + 23.0,2 + 46x + 17y = 20,56 → x = 0,24 mol và y = 0,06 mol → dung dịch X cũng có 0,24 mol NO3- > 3nFe = 0,21 mol → dung dịch X chứa HNO3 và 0,07 mol Fe(NO3)3 Bảo toàn N có nHNO3(X) = 0,24 – 0,07.3 =0,03 mol Đặt sản phẩm khử của phản ứng là N+n thì ta có N+5 + (5-n) e → N+n Fe → Fe+3 + 3e Ta có \({n_{{N^{ + n}}}} = {n_{HN{O_3}(bd)}} - {n_{N{O_3}(X)}} = 0,35 - 0,24 = 0,11\) → 0,11(5-n) = 3.0,07 =0,21 → n = 3,09 thì khí thoát ra có dạng N2On :0,055 mol Bảo toàn khối lượng có mFe + mDD HNO3 = mX + mkhí → 3,92 + 44,1 = mx + 0,055.(14.2 + 16x) → mX = 43,76 gam → nồng độ % của Fe(NO3)3 trong X là C%[Fe(NO3)3] = 0,07.242 : 43,76. 100% = 38,7%
Câu 40 :
Nung m gam hỗn hợp X gồm Fe, Cu, Fe(NO3)2, Cu(NO3)2 và FeCO3 trong bình chân không, thu được chất rắn Y và hỗn hợp khí Z có tỉ khối so với H2 là 22,8 (giả sử khí NO2 sinh ra không tham gia phản ứng nào khác). Cho Y tan hoàn toàn trong dung dịch chứa đồng thời 0,08 mol KNO3 và 0,68 mol \(H_2SO_4\) (loãng), thu được dung dịch chỉ chứa 98,36 gam muối trung hòa của các kim loại và hỗn hợp khí T gồm NO và H2. Tỉ khối của T so với H2 là 12,2. Biết các phản ứng xảy ra hoàn toàn. giá trị của m gần nhất với giá trị nào sau đây?
Đáp án : D Phương pháp giải :
Quy đổi hỗn hợp X thành Fe, Cu, NO3 và CO3 Đặt số mol của NO3 là x và của CO3 là y →nNO2 =x và nCO2 = y mol Bảo toàn nguyên tố H có 2nO + 2nH2 + 4nNO = 2nH2SO4 => nO =? mCu + mFe + mK + mSO4 = mmuối → mCu + mFe = ? Từ đó tìm được x, y → hỗn hợp ban đầu có m = mCu + mFe + mNO3 + mCO3 =? Lời giải chi tiết :
Quy đổi hỗn hợp X thành Fe, Cu, NO3 và CO3 Đặt số mol của NO3 là x và của CO3 là y Đốt chaý X thì NO3 → NO2 + O CO3 → CO2 + O →nNO2 =x và nCO2 = y mol Khí Z có NO2 và CO2, không có O vì O sinh ra phản ứng trở lại với các kim loại Cu, Fe Y có Cu : z mol , Fe : t mol và O Ta có nO(Y) = x + y(1) Vì hỗn hợp khí Z có tỉ khổi so với H2 là 22,8 nên \(\dfrac{{46x + 44y}}{{x + y}} = 22,8.2 = 45,6 \to x = 4y\)(2) Y + KNO3 + H2SO4 → khí NO và H2 → NO3- phản ứng hết nên nNO =nNO3- = 0,08 mol ( = nKNO3) Xét khí T có \(\begin{array}{l}{d_{T/{H_2}}} = \dfrac{{{M_T}}}{2} = \dfrac{{\dfrac{{2{n_{{H_2}}} + 30.0,08}}{{{n_{{H_2}}} + 0,08}}}}{2} = 12,2\\ \Rightarrow {n_{{H_2}}}=0,02\end{array}\) PTHH 2H+ + O +2e → H2O 4H+ + 3e + NO3- → H2O + NO 2H+ +2e → H2 Bảo toàn nguyên tố H có 2nO + 2nH2 + 4nNO = 2nH2SO4 → 2nO + 2.0,02 + 4.0,08 = 2.0,68 → nO = 0,5 mol(3) Ta có mCu + mFe + mK + mSO4 = mmuối → mCu + mFe + 0,68.96 +0,08.39 = 98,36 → mCu + mFe = 29,96 Từ (1) (2) và (3) tính được x = 0,4 mol và y = 0,1 mol → hỗn hợp ban đầu có m = mCu + mFe + mNO3 + mCO3 = 29,96 + 0,4.62 + 0,1.60= 60,76 g |












