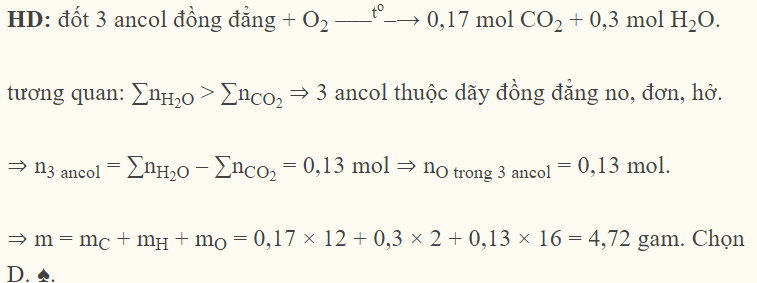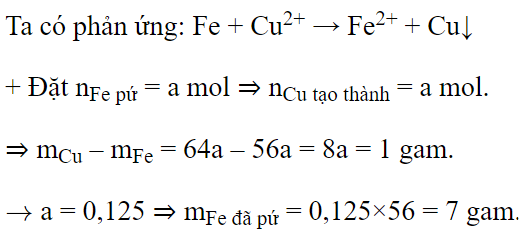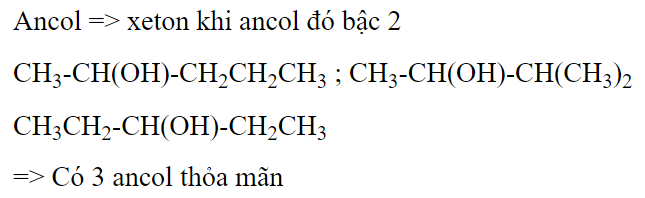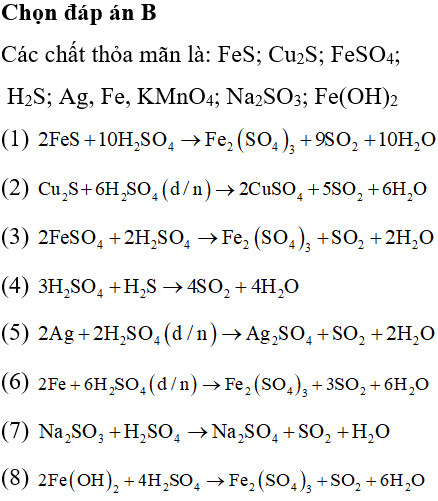Đề khảo sát chất lượng đầu năm Hóa 12 - Đề số 5Đề bài
Câu 1 :
Chất nào sau đây là chất điện li mạnh?
Câu 2 :
Oxit kim loại bị khử bởi khí CO ở nhiệt độ cao là
Câu 3 :
Ancol nào sau đây có số nguyên tử cacbon bằng số nhóm -OH?
Câu 4 :
Dung dịch 37-40% fomandehit trong nước gọi là fomon được dùng để ngâm xác động vật, thuộc da, tẩy uế, diệt trùng… Công thức hóa học của fomandehit là
Câu 5 :
Thành phần chính của phân ure là
Câu 6 :
Cho phản ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Khi hệ số cân bằng phản ứng là nguyên và tối giản thì số phân tử HNO3 bị khử là
Câu 7 :
Một hidrocacbon X cộng hợp với axit HCl theo tỉ lệ mol 1:1 tạo sản phẩm có thành phần khối lượng clo là 45,223%. Công thức phân tử của X là
Câu 8 :
Đốt cháy hoàn toàn m gam hỗn hợp 3 ancol đơn chức, thuộc cùng dãy đồng đẳng, thu được 3,808 lít khí CO2 (đktc) và 5,4 gam H2O. Giá trị của m là
Câu 9 :
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là
Câu 10 :
Hòa tan hoàn toàn 1,02 gam Al2O3 trong dung dịch H2SO4 loãng dư, thu được khối lượng muối là
Câu 11 :
Cho hỗn hợp A gồm 0,01 mol HCHO và 0,02 mol CH3CHO và dung dịch AgNO3 trong NH3 dư đun nóng. Sau khi phản ứng hoàn toàn khối lượng Ag thu được là
Câu 12 :
Số ancol đồng phân cấu tạo của nhau có công thức phân tử C5H12O, tác dụng với CuO đun nóng sinh ra xeton là
Câu 13 :
Đốt cháy hoàn toàn hidrocacbon X bằng lượng oxi vừa đủ, thu được CO2 và H2O có tổng số mol bằng tổng số mol của X và O2 tham gia phản ứng. Số nguyên tử hidro (H) có trong X là
Câu 14 :
Hỗn hợp X gồm Al2O3 (0,12 mol), Mg (0,2 mol), Zn (0,1 mol). Cho X tác dụng hết với dung dịch HNO3 loãng (dư), sau phản ứng khối lượng dung dịch tăng 23,54g. Số mol HNO3 phản ứng là
Câu 15 :
Nhận định nào sau đây sai?
Câu 16 :
Cho các chất: FeS, Cu2S, FeSO4, H2S, Ag, Fe, KMnO4, Na2SO3, Fe(OH)2. Số chất có thể phản ứng với H2SO4 đặc nóng tạo ra SO2 là
Câu 17 :
Cho các dung dịch NaOH, BaCl2, Na2CO3, NaHSO4 được dán nhãn X, Y, Z, T không theo thứ tự. Thực hiện các thí nghiệm đối với 4 dung dịch X, Y, Z, T và có kết quả như bảng sau
Câu 18 :
Tiến hành các thí nghiệm sau: (1) O3 tác dụng với dung dịch KI (2) Axit HF tác dụng với SiO2 (3) Cho khí Cl2 tác dụng với khí H2S (4) Khí SO2 tác dụng với nước Cl2 (5) KClO3 tác dụng với dung dịch HCl đặc, đun nóng (6) Cho H2O2 vào dung dịch KMnO4/H2SO4 (7) MnO2 tác dụng với dung dịch HCl đặc, đun nóng Số thí nghiệm tạo ra đơn chất là
Câu 19 :
Hỗn hợp khí X gồm vinylaxetilen, axetilen và propan (x gam). Chia X làm 3 phần bằng nhau. - Phần 1 tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 20,76 gam kết tủa - Phần 2 phản ứng tối đa với 0,24 mol H2 (xúc tác Ni, to) - Đốt cháy hoàn toàn phần 3 với lượng oxi vừa đủ, thu được CO2 và H2O có tỉ lệ mol 1:1 Giá trị của x là
Câu 20 :
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối với H2 bằng 5. Tỉ lệ a:b bằng
Lời giải và đáp án
Câu 1 :
Chất nào sau đây là chất điện li mạnh?
Đáp án : B Phương pháp giải :
Chất điện li mạnh là chất khi tan trong nước, phân li hoàn toàn ra ion Lời giải chi tiết :
NaCl khi tan trong nước phân li hoàn toàn ra ion Na+ và Cl-
Câu 2 :
Oxit kim loại bị khử bởi khí CO ở nhiệt độ cao là
Đáp án : D Phương pháp giải :
Kim loại đứng sau Al trong dãy điện hóa sẽ bị CO khử ở nhiệt độ cao Lời giải chi tiết :
CuO bị CO khử thành kim loại Cu CuO + CO → Cu + CO2
Câu 3 :
Ancol nào sau đây có số nguyên tử cacbon bằng số nhóm -OH?
Đáp án : A Phương pháp giải :
Xác định công thức cấu tạo của các chất Lời giải chi tiết :
Glixerol: CH2(OH) – CH(OH) – CH2(OH) => Có 3 nhóm -OH, 3 C Etilenclicol: CH2(OH) – CH2 – CH2(OH) => Có 2 nhóm -OH, 3 C Ancol benzylic: C6H5CH2OH => Có 1 nhóm -OH, 7 C Propan-1,2-diol: CH2(OH) – CH(OH) – CH3 => Có 2 nhóm -OH, 3 C => Glixerol có số cacbon bằng số nhóm -OH
Câu 4 :
Dung dịch 37-40% fomandehit trong nước gọi là fomon được dùng để ngâm xác động vật, thuộc da, tẩy uế, diệt trùng… Công thức hóa học của fomandehit là
Đáp án : A Lời giải chi tiết :
Công thức hóa học của fomandehit là HCHO
Câu 5 :
Thành phần chính của phân ure là
Đáp án : D Lời giải chi tiết :
Thành phần chính của phân ure là (NH2)2CO
Câu 6 :
Cho phản ứng: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Khi hệ số cân bằng phản ứng là nguyên và tối giản thì số phân tử HNO3 bị khử là
Đáp án : B Phương pháp giải :
Sử dụng phương pháp thăng bằng electron Lời giải chi tiết :
3x/ Cu → Cu2+ + 2e 2x/ N+5 + 3e → N+2 => Có 2 phân tử HNO3 bị khử thành NO
Câu 7 :
Một hidrocacbon X cộng hợp với axit HCl theo tỉ lệ mol 1:1 tạo sản phẩm có thành phần khối lượng clo là 45,223%. Công thức phân tử của X là
Đáp án : C Phương pháp giải :
X + HCl theo tỉ lệ 1:1 => Có 1 nối đôi => CnH2n + HCl → CnH2n+1Cl Lời giải chi tiết :
X + HCl theo tỉ lệ 1:1 => Có 1 nối đôi => CnH2n + HCl → CnH2n+1Cl - Thành phần khối lượng clo là 45,223% => 45,223% = 35,5/(14n + 36,5) x 100% => n = 3 Vậy công thức của X là C3H6
Câu 8 :
Đốt cháy hoàn toàn m gam hỗn hợp 3 ancol đơn chức, thuộc cùng dãy đồng đẳng, thu được 3,808 lít khí CO2 (đktc) và 5,4 gam H2O. Giá trị của m là
Đáp án : D Phương pháp giải :
nCO2 = 3,808 : 22,4 = 0,17 (mol) nH2O = 5,4 : 18 = 0,3 (mol) => no (trong ancol) = 0,3 – 0,17 = 0,13 (mol) Lời giải chi tiết :
Câu 9 :
Nhúng một đinh sắt sạch vào dung dịch Cu(NO3)2. Sau một thời gian lấy đinh sắt ra, làm khô, thấy khối lượng đinh sắt tăng 1 gam. Khối lượng sắt đã phản ứng là
Đáp án : B Phương pháp giải :
Áp dụng định luật tăng giảm khối lượng Lời giải chi tiết :
Câu 10 :
Hòa tan hoàn toàn 1,02 gam Al2O3 trong dung dịch H2SO4 loãng dư, thu được khối lượng muối là
Đáp án : C Phương pháp giải :
nAl2O3 = 1,02 : 102 = 0,01 mol Muối: Al2(SO4)3: 0,01 mol Lời giải chi tiết :
nAl2O3 = 1,02 : 102 = 0,01 mol Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O nAl2O3 = nAl2(SO4)3 => mmuối = 0,01.(27.2 + 96.3) = 3,42 gam
Câu 11 :
Cho hỗn hợp A gồm 0,01 mol HCHO và 0,02 mol CH3CHO và dung dịch AgNO3 trong NH3 dư đun nóng. Sau khi phản ứng hoàn toàn khối lượng Ag thu được là
Đáp án : A Phương pháp giải :
1 HCHO tạo ra 4 Ag 1 CH3CHO tạo ra 2 Ag Lời giải chi tiết :
1 HCHO tạo ra 4 Ag => 0,01 mol HCHO tạo ra 0,04 mol Ag 1 CH3CHO tạo ra 2 Ag => 0,02 mol CH3CHO tạo ra 0,04 mol Ag => Sau khi phản ứng hoàn toàn khối lượng Ag thu được = 108 .(0,04 + 0,04) = 8,64 gam
Câu 12 :
Số ancol đồng phân cấu tạo của nhau có công thức phân tử C5H12O, tác dụng với CuO đun nóng sinh ra xeton là
Đáp án : B Phương pháp giải :
Ancol bậc 2 tác dụng với CuO tạo ra xeton Lời giải chi tiết :
Câu 13 :
Đốt cháy hoàn toàn hidrocacbon X bằng lượng oxi vừa đủ, thu được CO2 và H2O có tổng số mol bằng tổng số mol của X và O2 tham gia phản ứng. Số nguyên tử hidro (H) có trong X là
Đáp án : C Phương pháp giải :
CxH2y + (2x+y)/2O2 → xCO2 + yH2O Giả sử mol CxHy là 1 => 1 + (2x + y)/2 = x + y Lời giải chi tiết :
CxH2y + (2x+y)/2 O2 → xCO2 + yH2O Giả sử mol CxHy là 1 mol => 1 + (2x+y)/2 = x + y => 2 + 2x + y = 2x + 2y => y =2
Câu 14 :
Hỗn hợp X gồm Al2O3 (0,12 mol), Mg (0,2 mol), Zn (0,1 mol). Cho X tác dụng hết với dung dịch HNO3 loãng (dư), sau phản ứng khối lượng dung dịch tăng 23,54g. Số mol HNO3 phản ứng là
Đáp án : B Phương pháp giải :
Nhận xét: mX = mtăng = 23,54 gam => Không có khí thoát ra => Sản phẩm khử là NH4NO3 Bảo toàn electron: 8nNH4NO3 = 2nMg + 2nZn nHNO3 = 10nNH4NO3 + 2nO = 1,47 Lời giải chi tiết :
Ta thấy: mX = mtăng = 23,54 gam => Không có khí thoát ra => Sản phẩm khử là NH4NO3 - Bảo toàn electron: 8nNH4NO3 = 2nMg + 2nZn => nNH4NO3 = 0,075 mol => nHNO3 = 10nNH4NO3 + 2nO = 1,47 mol
Câu 15 :
Nhận định nào sau đây sai?
Đáp án : B Phương pháp giải :
Flo là nguyên tử có độ âm điện lớn nhất trong bảng tuần hoàn Lời giải chi tiết :
Đáp án B sai vì Flo là nguyên tử có độ âm điện lớn nhất trong bảng tuần hoàn => Trong hợp chất chỉ có số oxi hóa là -1
Câu 16 :
Cho các chất: FeS, Cu2S, FeSO4, H2S, Ag, Fe, KMnO4, Na2SO3, Fe(OH)2. Số chất có thể phản ứng với H2SO4 đặc nóng tạo ra SO2 là
Đáp án : B Phương pháp giải :
Dựa vào tính chất hóa học của H2SO4 đặc, nóng Lời giải chi tiết :
Câu 17 :
Cho các dung dịch NaOH, BaCl2, Na2CO3, NaHSO4 được dán nhãn X, Y, Z, T không theo thứ tự. Thực hiện các thí nghiệm đối với 4 dung dịch X, Y, Z, T và có kết quả như bảng sau
Đáp án : B Phương pháp giải :
X + Y → kết tủa X + Z → khí Lời giải chi tiết :
Ta có: BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl 2NaHSO4 + Na2CO3 → 2Na2SO4 + CO2 + H2O => X là Na2CO3, Y là BaCl2, Z là NaHSO4 => T là NaOH
Câu 18 :
Tiến hành các thí nghiệm sau: (1) O3 tác dụng với dung dịch KI (2) Axit HF tác dụng với SiO2 (3) Cho khí Cl2 tác dụng với khí H2S (4) Khí SO2 tác dụng với nước Cl2 (5) KClO3 tác dụng với dung dịch HCl đặc, đun nóng (6) Cho H2O2 vào dung dịch KMnO4/H2SO4 (7) MnO2 tác dụng với dung dịch HCl đặc, đun nóng Số thí nghiệm tạo ra đơn chất là
Đáp án : C Phương pháp giải :
Viết phương trình của từng phản ứng Lời giải chi tiết :
(1) O3 + 2KI + H2O → 2KOH + O2 + I2 (2) 4HF + SiO2 → SiF4 + 2H2O (3) Cl2 + H2S → 2HCl + S (4) SO2 + Cl2 + H2O → H2SO4 + HCl (5) KClO3 + HCl → KCl + Cl2 + H2O (6) H2O2 + 2KMnO4 + 3H2SO4 → 2MnSO4 + O2 + K2SO4 + 4H2O (7) MnO2 + HCl → MnCl2 + Cl2 + H2O => Có 5 thí nghiệm tạo ra đơn chất
Câu 19 :
Hỗn hợp khí X gồm vinylaxetilen, axetilen và propan (x gam). Chia X làm 3 phần bằng nhau. - Phần 1 tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 20,76 gam kết tủa - Phần 2 phản ứng tối đa với 0,24 mol H2 (xúc tác Ni, to) - Đốt cháy hoàn toàn phần 3 với lượng oxi vừa đủ, thu được CO2 và H2O có tỉ lệ mol 1:1 Giá trị của x là
Đáp án : A Phương pháp giải :
Gọi số mol của 3 chất lần lượt là a, b, c mol - Phần 1: 159a + 240b = 20,76 - Phần 2: 3a + 2b = 0,24 - Phần 3: 4a + 2b + 3c = 2a + b + 4c Lời giải chi tiết :
Câu 20 :
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối với H2 bằng 5. Tỉ lệ a:b bằng
Đáp án : B Phương pháp giải :
Bước 1: Y: FeS, Fe dư, S dư Z: H2, H2S Bước 2: Tính tỉ lệ mol của H2 và H2S Bước 3: Giả sử số mol của 2 khí Bước 4: Bảo toàn mol Fe để tính mol Fe ban đầu Bước 5: Lập luận phản ứng tính theo nguyên tố S Bước 5: Tính mol S ban đầu Lời giải chi tiết :
|