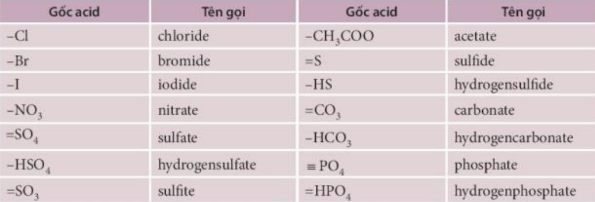
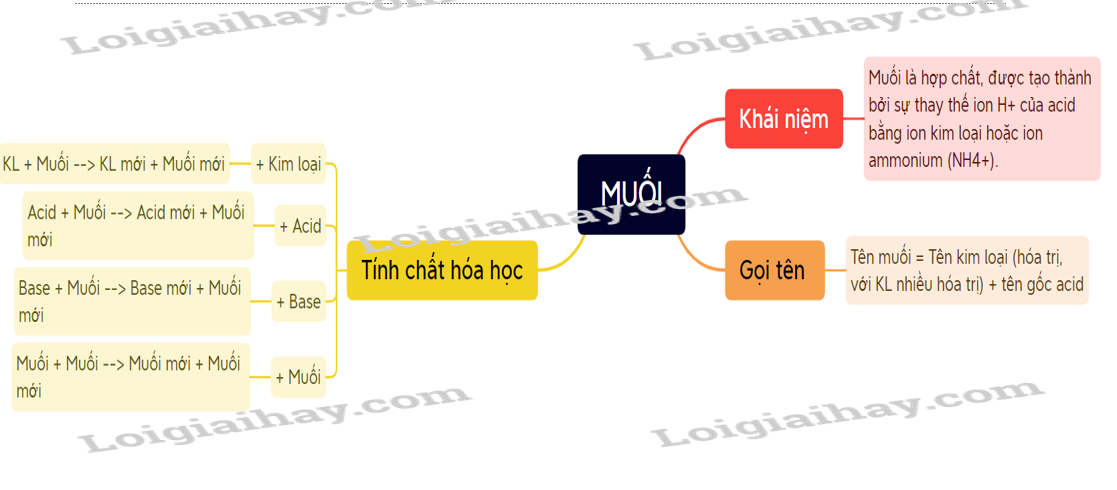
Lý thuyết muối - Khoa học tự nhiên 8 - Kết nối tri thứcMuối là hợp chất, được tạo thành từ sự thay thế ion H+ của acid bằng ion kim loại hoặc ion ammonium (NH4+). Tổng hợp đề thi học kì 1 lớp 8 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Khoa học tự nhiên I. Khái niệm - Muối là hợp chất, được tạo thành từ sự thay thế ion H+ của acid bằng ion kim loại hoặc ion ammonium (NH4+). VD: Na2SO4 (sodium sulfate); NH4Cl (ammonium chloride) - Gọi tên: Tên muối = Tên kim loại (hóa trị, với kim loại nhiều hóa trị) + tên gốc acid. Tên một số gốc acid: II. Tính tan của muối - Đa số các muối là chất rắn, có những muối không tan trong nước, có muối ít tan và có muối tan tốt trong nước. III. Tính chất hóa học 1. Tác dụng với kim loại Kim loại + Muối → Kim loại mới + Muối mới VD: Zn + FeSO4 → ZnSO4 + Fe 2. Tác dụng với dung dịch acid Muối + Acid → Muối mới + Acid mới (Sản phẩm tạo thành phải có ít nhất một chất là chất khí/ chất ít tan/ không tan). VD: CaCO3 + 2HCl → CaCl2 + CO2 + H2O 3. Dung dịch muối tác dụng với dung dịch base Muối + Base → Muối mới + Base mới (Sản phẩm tạo thành phải có ít nhất một chất là chất khí/ chất ít tan/ không tan). 4. Tác dụng với dung dịch muối khác Sản phẩm thu được có ít nhất một muối không tan hoặc ít tan. Ví dụ: 2AgNO3 + BaCl2 → 2AgCl + Ba(NO3)2 IV: Điều chế Một số phương pháp điều chế muối: - Dung dịch acid tác dụng với dung dịch base. - Dung dịch acid tác dụng với oxide base. - Dung dịch acid tác dụng với muối - Dung dịch acid tác dụng với dung dịch base. - Dung dịch muối tác dụng với dung dịch muối. Sơ đồ tư duy
|