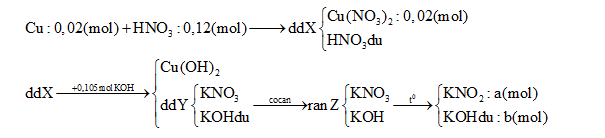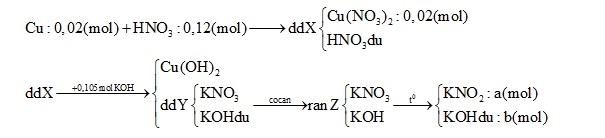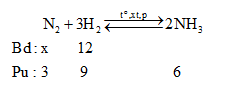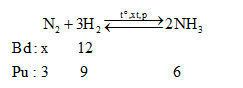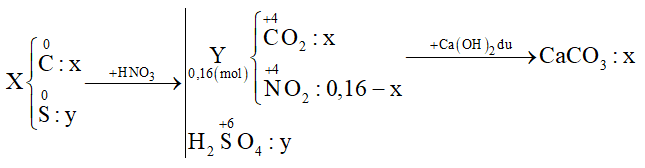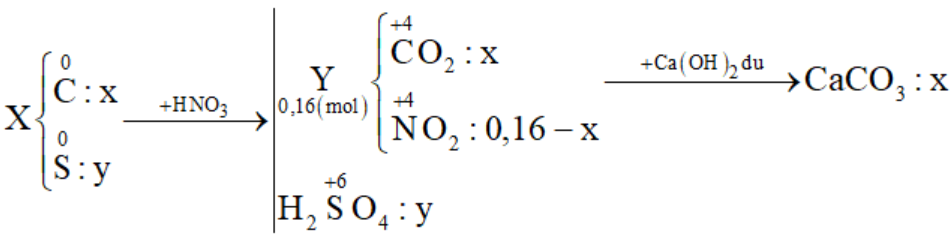Trắc nghiệm Tổng hợp bài tập nitơ - photpho - Hóa 11Đề bài
Câu 1 :
Hòa tan hoàn toàn 4,8 gam kim loại M (biết M chỉ có một hóa trị duy nhất) vào dung dịch axit HNO3 dư, thu được dung dịch A. Chia A thành 2 phần bằng nhau. - Phần 1: cho tác dụng với NaOH dư được kết tủa B. Nung B đến khối lượng không đổi thu được 4,0 gam oxit kim loại. - Phần 2: cô cạn ở điều kiện thích hợp thu được 25,6 gam một muối X duy nhất. Muối X có công thức phân tử là
Câu 2 :
Nung hỗn hợp rắn A gồm a mol Mg và 0,25 mol Cu(NO3)2, sau một thời gian thu được chất rắn B và 10,08 lít khí hỗn hợp D gồm NO2 và O2. Hòa tan hoàn tòa B vào dung dịch chứa 1,3 mol HCl (vừa đủ), thu được dung dịch X chỉ chứa m gam hỗn hợp muối clorua và 1,12 lít hỗn hợp khí Y gồm N2 và H2 có tỉ khối so với hidro là 11,4. Biết các thể tích đều ở đktc. Giá trị của m gần nhất với :
Câu 3 :
Lấy 240 ml dung dịch gồm NaOH 1,6M và KOH 1M tác dụng hết với dung dịch H3PO4 thu được dung dich X. Chia X thành 2 phần bằng nhau: - Phần 1: Cô cạn thu được 20,544 gam hỗn hợp muối khan. - Phần 2: Cho tác dụng với dung dịch CaCl2 (dư) thu được m gam kết tủa. Giá trị của m là
Câu 4 :
Hòa tan hoàn toàn 3,6 gam Mg trong 500 ml dung dịch HNO3 0,8M, phản ứng kết thúc thu được 448 ml một khí X (ở dktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2M. Giá trị của V là
Câu 5 :
Cho 8,64 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ hỗn hợp phản ứng, lúc đầu tạo ra sản phẩm khử là khí NO, sau đó thấy thoát ra khí không màu X. Sau khi các phản ứng kết thúc thấy còn lại 4,08 gam chất rắn không tan. Biết rằng tổng thể tích của hai khí NO và X là 1,792 lít (đktc) và tổng khối lượng là 1,84 gam. Cô cạn cẩn thận dung dịch sau phản ứng thu được m gam chất muối khan. Giá trị nào sau đây gần với m nhất?
Câu 6 :
Hòa tan hoàn toàn 1,28 g Cu vào 12,6 gam dd HNO3 60% thu được dung dịch X. Cho X tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 8,78 gam chất rắn. Nồng độ phần trăm của Cu(NO3)2 trong X là:
Câu 7 :
Từ 5,299 kg quặng photphorit chứa 78% Ca3(PO4)2 còn lại là tạp chất trơ người ta tiến hành điều chế axit photphoric với hiệu suất cả quá trình là 75%. Lấy 0,5% axit thu được hòa tan vào nước rồi trộn với 100 ml dung dịch NaOH xM thu được dung dịch X. Cô cạn cẩn thận dung dịch X thu được 17,2 gam chất rắn. Giá trị gần đúng của x là
Câu 8 :
Nhiệt phân hoàn toàn 20,2 gam hỗn hợp gồm Cu(NO3)2 và Fe(NO3)2 thu được hỗn hợp khí X. Dẫn từ từ hỗn hợp khí X vào nước (không có không khí), sau khi các phản ứng xảy ra hoàn toàn thu được 2 lít dung dịch Y và còn 0,448 lít khí (đktc) thoát ra. pH của dung dịch Y là
Câu 9 :
Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 13,9 gam hỗn hợp chất rắn khan. Giá trị của m là
Câu 10 :
Cho x mol N2 và 12 mol H2 vào bình kín. Tại thời điểm cân bằng thấy có 6 mol NH3 tạo thành.Tính hiệu suất của phản ứng tổng hợp NH3 trên.Biết hiệu suất chung của phản ứng là 75%. Tìm x?
Câu 11 :
Hòa tan hết hỗn hợp X gồm Al, Mg và Al(NO3)3 trong dung dịch chứa NaHSO4 và 0,06 mol NaNO3. Sau phản ứng thu được dung dịch Y chỉ chứa 115,28 gam các muối trung hòa và V lít (đktc) hỗn hợp khí T gồm H2 và N2O (tỉ lệ mol 1:1). Y tác dụng tối đa với 36,8 gam NaOH trong dung dịch và thu được 13,92 gam kết tủa. Giá trị của V là
Câu 12 :
Đun nóng m gam hỗn hợp Cu và Fe với tỉ lệ khối lượng tương ứng là 7 : 3 với một lượng dung dịch HNO3. Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít (đktc) hỗn hợp sản phẩm khử gồm NO và NO2. Biết lưọng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là
Câu 13 :
Lấy m gam hỗn hợp rắn gồm Mg, Zn, FeCO3, FeS2 (trong đó nguyên tố oxi chiếm 16,71% khối lượng hỗn hợp) nung trong bình chứa 0,16 mol O2, sau phản ứng hoàn toàn thu được hỗn hợp rắn X không chứa nguyên tố lưu huỳnh và hỗn hợp khí Y (có tỉ khối so với H2 là 27). Cho X vào dung dịch chứa 0,72 mol HCl và 0,03 mol NaNO3, sau phản ứng hoàn toàn thấy dung dịch thu được chỉ chứa muối clorua và 1,12 lít (đktc) hỗn hợp hai khí thoát ra có khối lượng là 0,66 gam (trong đó có một khí hóa nâu ngoài không khí). Giá trị của m gần nhất với giá trị nào dưới đây?
Câu 14 :
Hòa tan hoàn toàn 16,4g hỗn hợp X gồm FeO, Fe3O4 , Cu (trong đó FeO chiếm 1/3 tổng số mol hỗn hợp X) trong dung dịch NaNO3 và HCl, thu được dung dịch Y chỉ chứa các muối clorua và 0,896 lit NO (sản phẩm khử duy nhất của N+5, dktc). Mặt khác hòa tan hoàn toàn 16,4g hỗn hợp X trên trong dung dịch HCl thu được dung dịch Z chỉ chứa 3 muối có tổng khối lượng là 29,6g. Trộn dung dịch Y với dung dịch Z thì thu được dung dịch T. Cho dung dịch AgNO3 tới dư vào dung dịch T thu được m gam kết tủa . Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với :
Câu 15 :
Cho m1 gam hỗn hợp X chứa Al, Fe(NO3)2 và 0,1 mol Fe3O4 tan hết trong dung dịch chứa 1,025 mol H2SO4. Sau phản ứng thu được 5,04 lít (đktc) hỗn hợp khí Y gồm hai khí trong đó có một khí hóa nâu ngoài không khí và dung dịch Z chỉ chứa các muối trung hòa có khối lượng là 132,5 gam. Biết tỉ khối của Y so với H2 là 31/3. Cho một lượng vừa đủ BaCl2 vào Z sau khi các phản ứng xảy ra xong cho tiếp AgNO3 dư vào thì thu được m2 gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của tổng m1 + m2 là
Câu 16 :
Hòa tan hoàn toàn 192,07 gam hỗn hợp NaHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO và Al2O3( trong đó oxi chiếm 30% về khối lượng) tan hết vào X. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch chỉ chứa muối trung hòa và 2,016 lít hỗn hợp khí T có tổng khối lượng 1,84 gam gồm 5 khí đktc, trong đó H2,N2O, NO2 lần lượt có số mol là 0,04; 0,01; 0,01. Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
Câu 17 :
Hòa tan hết một hỗn hợp Q chứa 0,6 mol Fe3O4; 0,5 mol Fe; 0,4 mol CuO vào một dung dịch hỗn hợp gồm HCl 3,7M; HNO3 4,7M. Sau khi phản ứng hoàn toàn thu được dung dịch Y trong đó chỉ chứa muối Fe3+ và muối Cu2+ và khí NO (là sản phẩm khử duy nhất). Tổng khối lượng muối trong dung dịch Y là
Câu 18 :
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z thu được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của Fe(NO3)2 trong X là
Câu 19 :
Hỗn hợp X gồm Mg, Al, MgO, Al2O3. Hòa tan m gam hỗn hợp X bằng dung dịch HCl vừa đủ thì thu được dung dịch chứa m + 70,295 gam muối. Cho 2m gam X tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được 26,656 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho 3m gam X tác dụng với dung dịch HNO3 loãng, dư thu được 11,424 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với H2 là 318/17 và dung dịch Y chứa 486,45 gam muối. Giá trị m gần nhất với giá trị nào sau đây?
Câu 20 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg, Fe, FeCO3, Cu(NO3)2 vào dung dịch chứa NaNO3 (0,045 mol) và dung dịch H2SO4 thu được dung dịch Y chỉ chứa 62,605 gam muối trung hòa (không có ion Fe3+) và 3,808 lít (đktc) hỗn hợp khí Z (trong đó có 0,02 mol khí H2). Tỉ khối của Z so với O2 là 19/17. Thêm dung dịch NaOH 1M vào Y đến khi thu được kết tủa lớn nhất là 31,72 gam thì vừa hết 865 ml. Mặt khác, cho Y tác dụng vừa đủ với dung dịch BaCl2 được dung dịch T. Cho lượng dư dung dịch AgNO3 vào T thu được tổng 256,04 gam kết tủa. Phần trăm khối lượng của Mg trong X là
Câu 21 :
Hòa tan hết 7,44 gam hỗn hợp gồm Mg, MgO, Fe, Fe2O3 vào dung dịch chứa 0,4 mol HCl và 0,05 mol NaNO3, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X chứa 22,47 gam muối và 0,448 lít (đktc) hỗn hợp khí gồm NO, N2 có tỉ khối so với H2 bằng 14,5. Cho dung dịch NaOH (dư) vào dung dịch X thu được kết tủa Y, lấy Y nung trong không khí đến khối lượng không đổi thu được 9,6 gam chất rắn. Mặt khác, nếu cho dung dịch X tác dụng với dung dịch AgNO3 (dư) thu được m gam kết tủa. Biết chất tan trong X chỉ chứa hỗn hợp các muối. Giá trị của m là
Câu 22 :
Cho hỗn hợp A gồm Fe và Fe2O3 tác dụng với dung dịch X gồm H2SO4 và NaNO3, sau phản ứng thu được 0,896 lít khí NO (đktc) và dung dịch Y chỉ chứa các muối. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được 69,13 gam kết tủa. Cho dung dịch Y tác dụng với dung dịch HCl dư thu được 0,224 lít khí NO và dung dịch Z. Biết dung dịch Z không có khả năng phản ứng với dung dịch X, NO là sản phẩm khử duy nhất của N+5. Phần trăm khối lượng của Fe trong hỗn hợp ban đầu gần nhất với giá trị nào sau đây?
Câu 23 :
Hòa tan hết 16,58 gam hỗn hợp X gồm Al, Mg, Fe, FeCO3 trong dung dịch chứa 1,16 mol NaHSO4 và 0,24 mol HNO3, thu được dung dịch Z (chỉ chứa muối trung hòa) và 6,89 gam hỗn hợp khí Y gồm CO2, N2, NO, H2 (trong Y có 0,035 mol H2 và tỉ lệ mol NO : N2 = 2 : 1). Dung dịch Z phản ứng tối đa với 1,46 mol NaOH, lọc lấy kết tủa đem nung trong không khí tới khối lượng không đổi thu được 8,8 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Fe đơn chất trong X là:
Câu 24 :
Cho 3,5a gam hỗn hợp X gồm C và S tác dụng với lượng dư dung dịch HNO3 đặc, nóng, thu được hỗn hợp khí Y gồm NO2 và CO2 có thể tích 3,584 lít (đktc). Dẫn toàn bộ Y qua bình đựng dung dịch nước vôi trong dư thu được 12,5a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là:
Câu 25 :
Hòa tan hết 2,72 gam hỗn hợp X gồm: FeS2, FeS, Fe, CuS và Cu trong 500 ml dung dịch HNO3 1M, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,07 mol một chất khí. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Mặt khác, dung dịch Y có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 là NO. Giá trị của m là
Câu 26 :
Hòa tan hết 11,02 gam hỗn hợp X gồm FeCO3, Fe(NO3)2 và Al vào dung dịch Y chứa KNO3 và 0,4 mol HCl, thu được dung dịch Z và 2,688 lít (đktc) khí T gồm CO2, H2 và NO (có tỷ lệ mol tương ứng là 5 : 2 : 5). Dung dịch Z phản ứng được tối đa với 0,45 mol NaOH. Nếu cho Z tác dụng với dung dịch AgNO3 dư thì thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn và NO là sản phẩm khử duy nhất của N+5 trong các phản ứng trên. Cho các kết luận liên quan đến bài toán gồm: (a) Khi Z tác dụng với dung dịch KOH thì có khí thoát ra. (b) Số mol khí H2 trong T là 0,04 mol. (c) Khối lượng Al trong X là 1,62 gam. (d) Thành phần phần trăm về khối lượng của AgCl trong m gam kết tủa là 92,75%. Số kết luận đúng là
Lời giải và đáp án
Câu 1 :
Hòa tan hoàn toàn 4,8 gam kim loại M (biết M chỉ có một hóa trị duy nhất) vào dung dịch axit HNO3 dư, thu được dung dịch A. Chia A thành 2 phần bằng nhau. - Phần 1: cho tác dụng với NaOH dư được kết tủa B. Nung B đến khối lượng không đổi thu được 4,0 gam oxit kim loại. - Phần 2: cô cạn ở điều kiện thích hợp thu được 25,6 gam một muối X duy nhất. Muối X có công thức phân tử là
Đáp án : D Phương pháp giải :
Gọi số mol muối mỗi phần là x. Ta có số mol kim loại ban đầu là 2x +) Từ khối lượng kim loại M => PT (1) Nếu muối tạo thành chỉ là M(NO3)n => PT (2) Từ (1) và (2) => giá trị x theo n +) Số mol oxit thu được là x/2 => PT (3) Từ (1) và (3) => giá trị x theo n +) So sánh 2 giá trị x nhận thấy điều giả sử sai => muối ngậm nước +) Từ khối lượng muối mỗi phần => PT (4) Kết hợp (1), (3), (4) => các giá trị: nx ; mx; a/n = 12 => kim loại và công thức muối Lời giải chi tiết :
Gọi hóa trị của kim loại là n (1 ; 2 ; 3), Khối lượng mol là a (g) Gọi số mol muối mỗi phần là x. Ta có số mol kim loại ban đầu là 2x Có : 2ax = 4,8 nên ax = 2,4 (1) Nếu muối tạo thành chỉ là M(NO3)n thì ta có : (a + 62n)x = 25,6 (2) Từ (1) và (2) => $x=\frac{25,62,4}{62n}=\frac{0,187}{n}$ Mặt khác, số mol oxit thu được là x/2 => $(2a+16n).\frac{x}{2}=4$ (3) Từ (1) và (3) => $x=\frac{42,4}{16n}=\frac{0,1}{n}$ 2 giá trị x không bằng nhau. Vì vậy muối phải là muối ngậm nước. Đặt công thức muối là M(NO3)n.mH2O Khối lượng muối mỗi phần là (a + 62n + 18m)x = 25,6 (4) Kết hợp (1), (3), (4) ta có hệ sau : ax = 2,4 (2a + 16n).x/2 = 4 (a + 62n + 18m)x = 25,6 => nx = 0,2 ; mx = 0,6 => a/n = 12. Thay n = 1, 2, 3 ta được a = 24 thỏa mãn => Mg Thay n = 2 => x = 0,1 ; do đó m = 6 Vậy M là Mg và muối là Mg(NO3)2.6H2O
Câu 2 :
Nung hỗn hợp rắn A gồm a mol Mg và 0,25 mol Cu(NO3)2, sau một thời gian thu được chất rắn B và 10,08 lít khí hỗn hợp D gồm NO2 và O2. Hòa tan hoàn tòa B vào dung dịch chứa 1,3 mol HCl (vừa đủ), thu được dung dịch X chỉ chứa m gam hỗn hợp muối clorua và 1,12 lít hỗn hợp khí Y gồm N2 và H2 có tỉ khối so với hidro là 11,4. Biết các thể tích đều ở đktc. Giá trị của m gần nhất với :
Đáp án : D Phương pháp giải :
+) Tính nN2 và nH2 Trong Y chứa khí H2 chứng tỏ NO3- hết Hỗn hợp muối clorua gồm : a mol MgCl2 ; 0,25 mol CuCl2 ; NH4Cl Bảo toàn Clo => ${{n}_{N{{H}_{4}}Cl}}$ theo a Bảo toàn H : ${{n}_{{{H}_{2}O}}}~=\frac{1}{2}.\left( {{n}_{HCl}}+4{{n}_{N{{H}_{4}}Cl}}\text{-}2{{n}_{{{H}_{2}}}} \right)$ Bảo toàn O : ${{n}_{O}}{{~}_{(Cu{{\left( N{{O}_{3}} \right)}_{2}})}}={{n}_{O\,(D)}}+{{n}_{O\,({{H}_{2}}O)}}~\Rightarrow a$ => m Lời giải chi tiết :
nD = 0,45 => nO (D) = 0,9 mol nY = 0,05 mol Đặt ${{n}_{{{N}_{2}}}}~=x\text{ }\Rightarrow \text{ }{{n}_{{{H}_{2}}}}=0,05x$ => 28x + 2.(0,05 – x) = 0,05.11,4.2 = 1,14 => x = 0,04 mol => nN2 = 0,04 mol và nH2 = 0,01 mol Trong Y chứa khí H2 chứng tỏ NO3- hết Hỗn hợp muối clorua gồm : a mol MgCl2 ; 0,25 mol CuCl2 ; NH4Cl Bảo toàn Clo : ${{n}_{N{{H}_{4}}Cl}}$ = 1,3 – 2a – 0,5 = 0,8 – 2a Bảo toàn H : ${{n}_{{{H}_{2}O}}}~=\frac{1}{2}.\left( {{n}_{HCl}}+4{{n}_{N{{H}_{4}}Cl}}\text{-}2{{n}_{{{H}_{2}}}} \right)=4a-0,96$ Bảo toàn O : ${{n}_{O}}{{~}_{(Cu{{\left( N{{O}_{3}} \right)}_{2}})}}={{n}_{O\,(D)}}+{{n}_{O\,({{H}_{2}}O)}}~\Rightarrow \text{ }0,25.6=0,9+4a-0,96$ => a = 0,39 mol => m = 0,39.95 + 0,25.135 + (0,8 – 2.0,39).53,5 = 71,87 gam
Câu 3 :
Lấy 240 ml dung dịch gồm NaOH 1,6M và KOH 1M tác dụng hết với dung dịch H3PO4 thu được dung dich X. Chia X thành 2 phần bằng nhau: - Phần 1: Cô cạn thu được 20,544 gam hỗn hợp muối khan. - Phần 2: Cho tác dụng với dung dịch CaCl2 (dư) thu được m gam kết tủa. Giá trị của m là
Đáp án : B Phương pháp giải :
+) Quy đổi hỗn hợp kiềm về MOH với M=(23.0,384+39.0,24)/0,624=379/13 +) Xét trường hợp tạo từng muối => phản ứng tạo muối nào +) Gọi số mol mỗi muối là x và y, bảo toàn M và khối lượng hỗn hợp muối => x, y Lời giải chi tiết :
nNaOH = 0,384 mol; nKOH = 0,24 mol Gọi CT chung của kiềm là MOH (với $M=\frac{23.0,384+39.0,24}{0,624}=\frac{379}{13}$ ) Giả sử chỉ tạo một trong các muối sau: MH2PO4: ${{n}_{M{{H}_{2}}P{{O}_{4}}}}={{n}_{MOH}}=0,624\Rightarrow {{m}_{M{{H}_{2}}P{{O}_{4}}}}=0,624.\frac{1640}{13}=78,72\text{ }gam$ M2HPO4: ${{n}_{{{M}_{2}}HP{{O}_{4}}}}=\frac{1}{2}.{{n}_{MOH}}=\frac{0,624}{2}\Rightarrow {{m}_{{{M}_{2}}HP{{O}_{4}}}}=\frac{0,624}{2}.\frac{2006}{13}=48,144$ gam M3PO4: ${{n}_{{{M}_{3}}P{{O}_{4}}}}=\frac{1}{3}.{{n}_{MOH}}=\frac{0,624}{3}\Rightarrow {{m}_{{{M}_{3}}P{{O}_{4}}}}=\frac{0,624}{3}.\frac{2372}{13}=37,952\,gam$ Vì: 37,952 g < 20,544.2 = 41,088 < 48,144 g => Tạo 2 muối M2HPO4 (x mol); M3PO4 (y mol) (số mol trong 1 phần) Ta có: $\frac{2006}{13}.x+\frac{2372}{13}.y=20,544$ (1) $2x+3y=\frac{0,624}{2}$ (2) => x = 0,048; y = 0,072 ${{n}_{C{{a}_{3}}{{(P{{O}_{4}})}_{2}}}}=\frac{1}{2}.{{n}_{{{M}_{3}}P{{O}_{4}}}}=0,036\,mol;\,{{n}_{CaHP{{O}_{4}}}}={{n}_{{{M}_{2}}HP{{O}_{4}}}}=0,048\,mol$ => ${{m}_{\downarrow }}={{m}_{C{{a}_{3}}{{\left( P{{O}_{4}} \right)}_{2}}}}+{{m}_{CaHP{{O}_{4}}}}=0,036.310+0,048.136=17,688\text{ }gam$
Câu 4 :
Hòa tan hoàn toàn 3,6 gam Mg trong 500 ml dung dịch HNO3 0,8M, phản ứng kết thúc thu được 448 ml một khí X (ở dktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04 gam. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2M. Giá trị của V là
Đáp án : D Phương pháp giải :
+) Bảo toàn e => NH4NO3 +) Bảo toàn nguyên tố N => số mol HNO3 trong Y +) ${{n}_{NaOH}}~={{n}_{HN{{O}_{3}}(Y)}}+2{{n}_{Mg}}+{{n}_{N{{H}_{4}}N{{O}_{3}}}}$ Lời giải chi tiết :
nMg = 0,15 mol ; nHNO3 = 0,4 mol ; nX = 0,02 mol mX = 3,6 – 3,04 = 0,56 gam => MX = 28 (N2) Bảo toàn e : ${{n}_{N{{H}_{4}}N{{O}_{3}}}}~=\frac{1}{8}.\left( 0,15.2-0,02.10 \right)=0,0125\text{ }mol$ Bảo toàn Nito : ${{n}_{HN{{O}_{3}}\,(Y)}}=0,4-\left( 2{{n}_{Mg}}+2{{n}_{{{N}_{2}}}}+2{{n}_{N{{H}_{4}}N{{O}_{3}}}} \right)=0,035\text{ }mol$ ${{n}_{NaOH}}~={{n}_{HN{{O}_{3}}(Y)}}+2{{n}_{Mg}}+{{n}_{N{{H}_{4}}N{{O}_{3}}}}=0,3475\text{ }mol$ => Vdd NaOH = 173,75 ml
Câu 5 :
Cho 8,64 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ hỗn hợp phản ứng, lúc đầu tạo ra sản phẩm khử là khí NO, sau đó thấy thoát ra khí không màu X. Sau khi các phản ứng kết thúc thấy còn lại 4,08 gam chất rắn không tan. Biết rằng tổng thể tích của hai khí NO và X là 1,792 lít (đktc) và tổng khối lượng là 1,84 gam. Cô cạn cẩn thận dung dịch sau phản ứng thu được m gam chất muối khan. Giá trị nào sau đây gần với m nhất?
Đáp án : A Phương pháp giải :
- Khí X là H2. Gọi nNO = a (mol); nH2 = b (mol) ∑ nX = a + b = 0,08 (1) ∑ mX = 30a + 2b = 1,84 (2) Từ (1) và (2) => a = ?; b = ? - Bảo toàn electron thấy: ∑ ne (nhận) = 3nNO + 2nH2 < ne (Mg nhường) => tạo muối NH4+ - Bảo toàn electron => ${{n}_{NH_{4}^{+}}}=\dfrac{2{{n}_{Mg\text{ }pu}}-3{{n}_{NO}}-2{{n}_{{{H}_{2}}}}}{8}$ - Bảo toàn nguyên tố N => ${{n}_{NO_{3}^{-}}}\Rightarrow {{n}_{N{{a}^{+}}}}\Rightarrow {{n}_{N{{a}_{2}}S{{O}_{4}}}}$ => mmuối $={{m}_{MgS{{O}_{4}}}}~+{{m}_{{{\left( N{{H}_{4}} \right)}_{2}}S{{O}_{4}}}}\text{+}{{m}_{N{{a}_{2}}S{{O}_{4}}}}$ Lời giải chi tiết :
mMg pư = 8,64 – 4,08 = 4,56 (g) => nMg pư = 0,19 (mol) => ne (Mg nhường) = 0,38 (mol) nX = 0,08 (mol) => MX = 1,84 : 0,08 = 23 (g/mol) => khí X là H2 Gọi nNO = a (mol); nH2 = b (mol) ∑ nX = a + b = 0,08 (1) ∑ mX = 30a + 2b = 1,84 (2) Từ (1) và (2) => a = 0,06 ; b = 0,02 => ∑ ne (nhận) = 3nNO + 2nH2 = 0,06.3 + 0,02.2 = 0,22 < ne (Mg nhường) = 0,38 => tạo muối NH4+ Bảo toàn electron => $2{{n}_{Mg\text{ }pu}}~=3{{n}_{NO}}+2{{n}_{{{H}_{2}}}}+8{{n}_{NH_{4}^{+}}}$ => ${{n}_{NH_{4}^{+}}}=\dfrac{2{{n}_{Mg\text{ }pu}}-3{{n}_{NO}}-2{{n}_{{{H}_{2}}}}}{8}=0,02\text{ }\left( mol \right)$ BTNT N => ${{n}_{NO_{3}^{-}}}={{n}_{NO}}+{{n}_{NH_{4}^{+}}}~=0,06+0,02=0,08\text{ }\left( mol \right)\Rightarrow {{n}_{N{{a}^{+}}}}=0,08\text{ }\left( mol \right)$ => mmuối = ${{m}_{MgS{{O}_{4}}}}+{{m}_{{{\left( N{{H}_{4}} \right)}_{2}}S{{O}_{4}}}}+{{m}_{N{{a}_{2}}S{{O}_{4}}}}$= 0,19.120 + 132.0,01 + 0,04.142 = 29,8 (g) => Giá trị gần nhất với m là 29,6
Câu 6 :
Hòa tan hoàn toàn 1,28 g Cu vào 12,6 gam dd HNO3 60% thu được dung dịch X. Cho X tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 8,78 gam chất rắn. Nồng độ phần trăm của Cu(NO3)2 trong X là:
Đáp án : A Phương pháp giải :
∑nKOH = a + b = 0,105 (1) ∑ mrắn = 85a + 56b = 8,78 (2) Từ (1) và (2) => a = ? ; b =? Bảo toàn electron => kết luận được N+5 bị khử thành NO và NO2 => tìm số mol mỗi khí => mdd X = mCu + mdd HNO3 – m khí => C% Cu(NO3)2 = ? Lời giải chi tiết :
∑nKOH = a + b = 0,105 (1) ∑ mrắn = 85a + 56b = 8,78 (2) Từ (1) và (2) => a = 0,1 (mol) ; b = 0,005 (mol) nKNO3 tạo ra từ Cu(NO3)2 = 0,04 (mol) => nKNO3 tạo ra từ HNO3 dư = 0,1 – 0,04 = 0,06 (mo) => nHNO3 dư = 0,12- 0,06 = 0,06 (mol) => nHNO3 bị khử = 0,06 – 0,02.2 = 0,02 (mol) Với ne( Cu nhường) = 2.nCu = 0,04 (mol) => Trung bình mỗi N+5 nhận 0,04/0,02 = 2e => Tạo NO2 (1e) và NO ( 3e) => nNO = nNO2 = 0,02/ 2= 0,01(mol) Vậy mdd X = mCu + mdd HNO3 – m khí = 1,28 + 12,6 – 0,01.30 – 0,01.46 = 13,12 (g) => C% Cu(NO3)2 = [( 0,02.188) : 13,12].100% = 28,66%
Câu 7 :
Từ 5,299 kg quặng photphorit chứa 78% Ca3(PO4)2 còn lại là tạp chất trơ người ta tiến hành điều chế axit photphoric với hiệu suất cả quá trình là 75%. Lấy 0,5% axit thu được hòa tan vào nước rồi trộn với 100 ml dung dịch NaOH xM thu được dung dịch X. Cô cạn cẩn thận dung dịch X thu được 17,2 gam chất rắn. Giá trị gần đúng của x là
Đáp án : D Phương pháp giải :
PTHH : Ca3(PO4)2 $\xrightarrow{H=75%}$ 2H3PO4 ${{n}_{C{{a}_{3}}{{\left( P{{O}_{4}} \right)}_{2}}}}~=\frac{5299.0,78}{310}=13,33\text{ }mol$ → ${{n}_{{{H}_{3}}P{{O}_{4}}}}~=13,33.0,75.2.0,005=0,1\text{ }mol$ Các phương trình có thể xảy ra là : H3PO4 + 3NaOH → Na3PO4 + 3H2O H3PO4 + 2NaOH → Na2 HPO4 + 2H2O H3PO4 + NaOH → NaH2PO4 + H2O Nếu chất rắn chỉ có muối thì Lượng muối tạo ra tối đa khi tạo thành Na3PO4 => mNa3PO4 = 0,1.164 = 16,4 < 17,2 → còn dư NaOH → chỉ tạo muối Na3PO4: 0,1 mol và còn dư NaOH : 0,8 gam Bảo toàn Na tìm được số mol NaOH Lời giải chi tiết :
PTHH : Ca3(PO4)2 → 2H3PO4 ${{n}_{C{{a}_{3}}{{\left( P{{O}_{4}} \right)}_{2}}}}~=\frac{5299.0,78}{310}=13,33$ mol → nH3PO4 = 13,33.0,75.2.0,005 = 0,1 mol Các phương trình có thể xảy ra là : H3PO4 + 3NaOH → Na3PO4 + 3H2O H3PO4 + 2NaOH → Na2 HPO4 + 2H2O H3PO4 + NaOH → NaH2PO4 + H2O Nếu chất rắn chỉ có muối Lượng muối tạo ra tối đa khi tạo thành Na3PO4 => mNa3PO4 = 0,1.164 =16,4 < 17,2 → còn dư NaOH → chỉ tạo muối Na3PO4: 0,1 mol và còn dư NaOH : 0,8 gam hay 0,02 mol Bảo toàn nguyên tố Na có 0,1.3 + 0,02 = nNaOH = 0,32 = 0,1x → x = 3,2M
Câu 8 :
Nhiệt phân hoàn toàn 20,2 gam hỗn hợp gồm Cu(NO3)2 và Fe(NO3)2 thu được hỗn hợp khí X. Dẫn từ từ hỗn hợp khí X vào nước (không có không khí), sau khi các phản ứng xảy ra hoàn toàn thu được 2 lít dung dịch Y và còn 0,448 lít khí (đktc) thoát ra. pH của dung dịch Y là
Đáp án : C Phương pháp giải :
2Cu(NO3)2 $\xrightarrow{{{t}^{0}}}$2CuO + 4NO2↑+ O2↑ (1) 4Fe(NO3)2 $\xrightarrow{{{t}^{0}}}$ 2Fe2O3 + 8NO2↑ + O2↑ (2) 4NO2 + O2 + 2H2O → 4HNO3 (3) Gọi 2x và 4y là số mol của Cu(NO3)2 và Fe(NO3)2 Ta thấy ở PTHH (1) và (3): ${{n}_{N{{O}_{2}}}}:{{n}_{{{O}_{2}}}}~=4:1$ Ở PTHH (2) : ${{n}_{N{{O}_{2}}}}:{{n}_{{{O}_{2}}}}~=8:1$ => số khí thoát ra chính là khí NO2 dư ở PTHH (2) => nNO2 (2) =? (mol) => Số mol của Fe(NO3)2 =? nCu(NO3)2 = ? => nHNO3 từ đó tính được giá trị pH =? Lời giải chi tiết :
2Cu(NO3)2 $\xrightarrow{{{t}^{0}}}$2CuO + 4NO2↑+ O2↑ (1) 2x → 4x → x (mol) 4Fe(NO3)2 $\xrightarrow{{{t}^{0}}}$2Fe2O3 + 8NO2↑ + O2↑ (2) 4y → 8y → y (mol) 4NO2 + O2 + 2H2O → 4HNO3 (3) Ta thấy ở PTHH (1) và (3): ${{n}_{N{{O}_{2}}}}:{{n}_{{{O}_{2}}}}~=4:1$ Ở PTHH (2): ${{n}_{N{{O}_{2}}}}:{{n}_{{{O}_{2}}}}~=8:1$ => số khí thoát ra chính là khí NO2 dư ở PTHH (2) => ${{n}_{N{{O}_{2}}}}=\frac{0,448}{22,4}=0,02$ (mol) => 4y = 0,02 => y = 0,005 (mol) BTKL: mhh = 188.2x + 180.4y = 20,2 => x = 0,044 (mol) => ${{n}_{HN{{O}_{3}}}}=2{{n}_{Cu{{\left( N{{O}_{3}} \right)}_{2}}}}~+2{{n}_{Fe{{\left( N{{O}_{3}} \right)}_{2}}}}-{{n}_{N{{O}_{2}}}}$dư = 2. 2.0,044 + 2. 4.0,005 – 0,02 = 0,196 (mol) => ${{C}_{M}}{{~}_{HN{{O}_{3}}}}=\frac{0,196}{2}=0,098M$ => pH = -log [HNO3] = 1
Câu 9 :
Cho m gam P2O5 vào dung dịch chứa 0,1 mol NaOH và 0,05 mol KOH, thu được dung dịch X. Cô cạn X, thu được 13,9 gam hỗn hợp chất rắn khan. Giá trị của m là
Đáp án : B Phương pháp giải :
Quy về công thức chung của dd kiềm là MOH với M là nguyên tử khối trung bình của Na và K Từ số mol MOH xét các trường hợp: + Chỉ tạo 1 muối MH2PO4 thì thu được mi gam chất rắn + Chỉ tạo 1 muối M2HPO4 thì thu được m2 gam muối + Chỉ tạo muối M3PO4 thì thu được m3 gam muối So sánh giá trị m đề bài đã cho với mi, m2, m3 Nếu mi < m < m2 => tạo 2 muối MH2PO4 và M2HPO4 Nếu m2 < m < m3 => tạo 2 muối M2HPO4 và M3PO4 Khi đó bảo toàn mol MOH và khối lượng rắn m 2 ẩn 2 phương trình giải ra đáp án. Lời giải chi tiết :
Giả sử dung dịch kiềm có công thức chung là: MOH: 0,15 (mol) với $M=\frac{0,1.23+0,05.39}{0,1+0,05}=\frac{85}{3}(g/mol)$ + Nếu phản ứng chỉ tạo 1 muối: $\begin{array}{*{35}{l}}\begin{align}& M{{H}_{2}}P{{O}_{4}}:0,15(mol)=>{{m}_{1}}=0,15.\frac{376}{3}=18,8(g) \\& {{M}_{2}}HP{{O}_{4}}:0,075(mol)=>{{m}_{2}}=0,075.\frac{458}{3}=11,45(mol) \\& {{M}_{3}}P{{O}_{4}}:0,05(mol)=>{{m}_{3}}=0,05.180=9(g) \\\end{align} \\\end{array}$ Ta thấy 11,45= m2 < mrắn = 13, 9 < m1 = 18,8 => tạo cả 2 muối MH2PO4 và M2HPO4 \(\left\{ {\begin{array}{*{20}{l}}\begin{array}{l}\sum {{n_M} = {\mkern 1mu} } x + 2y = 0,15\\\sum {{m_{{\kern 1pt} ran}}{\mkern 1mu} = \frac{{376}}{3}x + \frac{{458}}{3}y = 13,9}\end{array}\end{array}} \right. = > \left\{ {\begin{array}{*{20}{l}}\begin{array}{l}x = 0,05{\mkern 1mu} (mol)\\y = 0,05{\mkern 1mu} (mol)\end{array}\end{array}} \right.\). BTNT: P => ${{n}_{P}}~={{n}_{M{{H}_{2}}P{{O}_{4}}}}~+{{n}_{{{M}_{3}}P{{O}_{4}}}}~$ = 0,05 + 0,05 = 0,1 (mol) => ${{n}_{{{P}_{2}}{{O}_{5}}}}~=\frac{1}{2}.{{n}_{P}}~=0,05\left( mol \right)\Rightarrow {{m}_{{{P}_{2}}{{O}_{5}}}}~=0,05.142=7,1\text{ (gam)}$
Câu 10 :
Cho x mol N2 và 12 mol H2 vào bình kín. Tại thời điểm cân bằng thấy có 6 mol NH3 tạo thành.Tính hiệu suất của phản ứng tổng hợp NH3 trên.Biết hiệu suất chung của phản ứng là 75%. Tìm x?
Đáp án : D Phương pháp giải :
Nhận thấy: $\frac{{{n}_{{{H}_{2}}pu}}}{{{n}_{{{H}_{2}}bd}}}.100\%=\frac{9}{12}.100\%=H\%$=> Hiệu suất tính theo H2 Lời giải chi tiết :
Nhận thấy: $\frac{{{n}_{{{H}_{2}}pu}}}{{{n}_{{{H}_{2}}bd}}}.100\%=\frac{9}{12}.100\%=75\%$=> Hiệu suất tính theo H2 Nếu H% tính theo N2 thì: nN2 bđ = 3.(100/75) = 4 => nN2 bđ = x ≥ 4
Câu 11 :
Hòa tan hết hỗn hợp X gồm Al, Mg và Al(NO3)3 trong dung dịch chứa NaHSO4 và 0,06 mol NaNO3. Sau phản ứng thu được dung dịch Y chỉ chứa 115,28 gam các muối trung hòa và V lít (đktc) hỗn hợp khí T gồm H2 và N2O (tỉ lệ mol 1:1). Y tác dụng tối đa với 36,8 gam NaOH trong dung dịch và thu được 13,92 gam kết tủa. Giá trị của V là
Đáp án : D Phương pháp giải :
+ Bảo toàn electron + Bảo toàn nguyên tố N, Al Lời giải chi tiết :
Đặt nN2O = nH2 = a (mol) nNH4+ = b (mol) => nH+ = 10nN2O + 2nH2 + 10 nNH4+ = 12a + 10b => nNa+ = 12a + 10b + 0,06 ; nSO42- = 12a + 10b nMg = nMg(OH)2 = 0,24 (mol) Bảo toàn electron: 2nMg + 3nAl = 8nN2O + 2nH2 + 8nNH4+ => nAl = (10a + 8b – 0,48)/3 BTNT N => 3nAl(NO3)3 + nNaNO3 = 2n N2O + nNH4+ => nAl(NO3)3 = (2a + b – 0,06)/3 BTNT Al => nAl3+ trong X = nAl + nAl(NO3) = 4a + 3b – 0,18 Khối lượng muối trong X (Na+ ; Al3+; Mg2+; NH4+ ; SO42-): 23( 12a + 10b + 0,06) + 27 (4a + 3b – 0,18) + 0,24.24 + 18b + 96 (12a + 10b) = 115, 28 (1) nNaOH = 4nAl3+ + 2nMg2+ + nNH4+ => 0,92 = 4 (4a + 3b – 0,18) + 2.024 + b (2) Từ (1) và (2) => a = b = 0,04 (mol) => nT = 2a = 0,08 (mol) => V= 1,792 (lít)
Câu 12 :
Đun nóng m gam hỗn hợp Cu và Fe với tỉ lệ khối lượng tương ứng là 7 : 3 với một lượng dung dịch HNO3. Sau khi kết thúc phản ứng thu được 0,75m gam chất rắn, dung dịch X và 5,6 lít (đktc) hỗn hợp sản phẩm khử gồm NO và NO2. Biết lưọng HNO3 đã phản ứng là 44,1 gam. Giá trị của m là
Đáp án : A Phương pháp giải :
Ta có: mCu = 0,7m và mFe = 0,3m Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m Ta có: nNO + nNO2 = 0,25 mol (1) Quá trình nhận electron: NO3-+ 1e + 2H+ → NO2 + H2O NO3-+ 3e + 4H+ → NO + 2H2O Ta có: nH+ = 2.nNO2+ 4.nNO = 0, 7 mol (2) Giải hệ (1) và (2) ta có: nNO và nNO2 Quá trình cho electron là: Fe → Fe2+ + 2e Áp dụng định luật bảo toàn electron ta có: 2.nFe = nNO2 + 3.nNO → nFe pứ = 0,25m/56 → Tính được giá trị m. Lời giải chi tiết :
Ta có: nHNO3 = 44,1: 63 = 0,7 mol Ta có: mCu = 0,7m và mFe = 0,3m Khối lượng chất rắn sau khi kết thúc các phản ứng là 0,75m → Chất rắn này gồm 0,7m gam Cu và 0,05m gam Fe → mFe pứ = 0,3m - 0,05m = 0,25m Ta có: nNO + nNO2 = 0,25 mol (1) Quá trình nhận electron: NO3-+ 1e + 2H+ → NO2 + H2O NO3-+ 3e + 4H+ → NO + 2H2O Ta có: nH+ = 2.nNO2 + 4.nNO = 0, 7 mol (2) Giải hệ (1) và (2) ta có: nNO = 0,1 mol và nNO2 = 0,15 mol Do sau phản ứng vẫn còn Fe dư và Cu nên quá trình cho electron là: Fe → Fe2+ + 2e Áp dụng định luật bảo toàn electron ta có: 2.nFe = nNO2 + 3.nNO = 0,15 + 3.0,1 = 0,45 mol → nFe pứ = 0,225 mol = 0,25m/56 (mol) → m = 50,4 gam
Câu 13 :
Lấy m gam hỗn hợp rắn gồm Mg, Zn, FeCO3, FeS2 (trong đó nguyên tố oxi chiếm 16,71% khối lượng hỗn hợp) nung trong bình chứa 0,16 mol O2, sau phản ứng hoàn toàn thu được hỗn hợp rắn X không chứa nguyên tố lưu huỳnh và hỗn hợp khí Y (có tỉ khối so với H2 là 27). Cho X vào dung dịch chứa 0,72 mol HCl và 0,03 mol NaNO3, sau phản ứng hoàn toàn thấy dung dịch thu được chỉ chứa muối clorua và 1,12 lít (đktc) hỗn hợp hai khí thoát ra có khối lượng là 0,66 gam (trong đó có một khí hóa nâu ngoài không khí). Giá trị của m gần nhất với giá trị nào dưới đây?
Đáp án : A Phương pháp giải :
Đặt số mol của FeCO3 là x mol, FeS2 : y mol Đốt cháy X có CO2 : x mol và SO2 : 2y mol và hỗn hợp rắn X Vì dY/H2 = MY : 2 = 27 → MY = 54 = \(\dfrac{{44x + 64.2y}}{{x + 2y}}\) → x = 2y X + HCl + NaNO3: quy đổi X thành M ( M là kim loại) và O Vì khí thu được có M = 13,2 (g/mol) mà một khí hóa nâu ngoài không khí là NO → khí còn lại có M < 13,2 → khí đó là H2 nNO < nNO3 nên xảy ra phản ứng tạo NH4+ 4H+ + NO3- + 3e → H2O + NO 10H+ + NO3- + 9e → 3H2O + NH4+ O + 2e → O2- O2- + 2H+ → H2O 2 H+ + 2e → H2 Bảo toàn nguyên tố Lời giải chi tiết :
Đặt số mol của FeCO3 là x mol, FeS2 : y mol Đốt cháy X có CO2 : x mol và SO2 : 2y mol và hỗn hợp rắn X Vì dY/H2 = MY : 2 = 27 → MY = 54 = \(\dfrac{{44x + 64.2y}}{{x + 2y}}\) → x = 2y X + HCl + NaNO3: quy đổi X thành M ( M là kim loại) và O nkhí = 0,05 mol Vì khí thu được có M = 0,66 : 0,05 = 13,2 (g/mol) mà một khí hóa nâu ngoài không khí là NO → khí còn lại có M < 13,2 → khí đó là H2 nNO = a mol và nH2 = b mol thì nkhí = a + b =0,05 mol và mkhí = 30a + 2b = 0,66 nên a = 0,02 mol và b = 0,03 mol Vì khí sinh ra có H2 nên lượng NO3- phải phản ứng hết, mà nNO < nNO3 nên xảy ra phản ứng tạo NH4+ PTHH : 4H+ + NO3- + 3e → H2O + NO 0,08 0,02 0,06 0,02
10H+ + NO3- + 9e → 3H2O + NH4+ 0,1 0,01 0,09 0,01 O + 2e → O2- O2- + 2H+ → H2O 2 H+ + 2e → H2 Vì dung dịch thu được chỉ chứa muối clo nên H+ hết nên 0,08 + 0,1 + 2nO + 0,03.2= 0,72 mol→ nO = 0,24 mol Bảo toàn O cho phản ứng đốt cháy X có nO(X) + 2nO2 = nO(Y) + 2nSO2 + 2nCO2 → 3x + 2.0,16 = 0,24 + 2.2y + 2x → 3x + 0,32 = 0,24 + 2x + 2x → x = 0,08 mol → nO(X) = 0,08.3 = 0,24 mol → mO(X) = 3,84 gam Vì trong X chiếm 16,71% O nên mX = 3,84 : 16,71 .100 =22,98 gam gần nhất với 23 gam
Câu 14 :
Hòa tan hoàn toàn 16,4g hỗn hợp X gồm FeO, Fe3O4 , Cu (trong đó FeO chiếm 1/3 tổng số mol hỗn hợp X) trong dung dịch NaNO3 và HCl, thu được dung dịch Y chỉ chứa các muối clorua và 0,896 lit NO (sản phẩm khử duy nhất của N+5, dktc). Mặt khác hòa tan hoàn toàn 16,4g hỗn hợp X trên trong dung dịch HCl thu được dung dịch Z chỉ chứa 3 muối có tổng khối lượng là 29,6g. Trộn dung dịch Y với dung dịch Z thì thu được dung dịch T. Cho dung dịch AgNO3 tới dư vào dung dịch T thu được m gam kết tủa . Biết các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với :
Đáp án : D Phương pháp giải :
- Tìm số mol các chất trong X dựa vào các dữ kiện : mX ; nFeO = 1/3nX ; Thí nghiệm 2 - Qui đổi cả quá trình thành sơ đồ sau : \(\left. \begin{gathered}F{\text{e}} \hfill \\Cu \hfill \\O \hfill \\ \end{gathered} \right\} + \left\{ \begin{gathered}NaN{{\text{O}}_3} \hfill \\HCl \hfill \\AgN{O_3} \hfill \\ \end{gathered} \right. \to \left\{\begin{gathered}F{{\text{e}}^{3 + }} \hfill \\C{u^{2 + }} \hfill \\ \end{gathered} \right. + \left\{\begin{gathered}Ag \hfill \\ AgCl \hfill \\ \end{gathered} \right. + NO + {H_2}O\) => Áp dụng định luật bảo toàn electron để tìm ra số mol Ag Lời giải chi tiết :
- Gọi số mol FeO, Fe3O4, Cu trong X lần lượt là a ; b ; c => nX = a + b + c = 3a (= 3nFeO) => 2a – b – c = 0 (1) - Ta có : mX = mFeO + mFe3O4 + mCu => 72a + 232b + 64c = 16,4g (2) - Khi X + HCl : Bảo toàn H : nH2O.2 = nHCl = 2x => Bảo toàn khối lượng : mX + mHCl = mmuối + mH2O => 16,4 + 36,5.2x = 29,6 + 18x => x = 0,24 mol Bảo toàn nguyên tố oxi : nO(X) = nO(H2O) => a + 4b = 0,24 (3) => nHCl (TN2) = 2nH2O = 0,48 mol Từ (1,2,3) => a = 0,04 ; b = 0,05 ; c = 0,03 mol - Thí nghiệm 1 có : nNO = 0,896 : 22,4 = 0,04 mol => Công thức tính nhanh : nHCl = 4nNO + 2nO(X) = 0,64 mol => nHCl tổng = 0,64 + 0,48 = 1,12 mol - Trộn dung dịch Y và dung dịch Z để phản ứng với AgNO3 dư => Qui đổi về thành quá trình sau : \(\left. \begin{gathered}F{{\text{e}}_{0,38}} \hfill \\C{u_{0,06}} \hfill \\{O_{0,48}} \hfill \\ \end{gathered} \right\} + \left\{ \begin{gathered}NaN{{\text{O}}_3} \hfill \\HC{l_{1,12}} \hfill \\AgN{O_3} \hfill \\\end{gathered} \right. \to \left\{ \begin{gathered}F{{\text{e}}^{3 + }} \hfill \\C{u^{2 + }} \hfill \\\end{gathered} \right. + \left\{ \begin{gathered}Ag \hfill \\AgCl \hfill \\\end{gathered} \right. + N{O_{0,04}} + {H_2}O\) (Trong đó : nFe = nFeO + 3nFe3O4 ; nO = nFeO + 4nFe3O4) (Số mol X gấp đôi vì gộp cả 2 thí nghiệm) - Bảo toàn electron : 3nFe + 2nCu = nAg + 2nO + 3nNO => nAg = 0,18 mol Lại có : nAgCl = nHCl = 1,12 mol (Bảo toàn nguyên tố Cl) => mkết tủa = mAg + mAgCl = 180,16g (Gần nhất với giá trị 180,15)
Câu 15 :
Cho m1 gam hỗn hợp X chứa Al, Fe(NO3)2 và 0,1 mol Fe3O4 tan hết trong dung dịch chứa 1,025 mol H2SO4. Sau phản ứng thu được 5,04 lít (đktc) hỗn hợp khí Y gồm hai khí trong đó có một khí hóa nâu ngoài không khí và dung dịch Z chỉ chứa các muối trung hòa có khối lượng là 132,5 gam. Biết tỉ khối của Y so với H2 là 31/3. Cho một lượng vừa đủ BaCl2 vào Z sau khi các phản ứng xảy ra xong cho tiếp AgNO3 dư vào thì thu được m2 gam kết tủa. Biết các phản ứng hoàn toàn. Giá trị của tổng m1 + m2 là
Đáp án : C Phương pháp giải :
MY = 62/3 và trong Y có chứa khí không màu hóa nâu trong không khí => Y có chứa H2 và NO Tính được số mol của H2 và NO Do khí thu được chứa H2 nên ta suy ra dd Z chứa Al3+, Fe2+, NH4+ (có thể có) và SO42- Lập sơ đồ bài toán, sử dụng các định luật bảo toàn điện tích, bảo toàn nguyên tố để xác định số mol các chất và các ion. Lời giải chi tiết :
MY = 62/3 và trong Y có chứa khí không màu hóa nâu trong không khí => Y có chứa H2 và NO Đặt nNO = a và nH2 = b (mol) nY = a + b = 5,04/22,4 = 0,225 (1) mY = 30a + 2b = 0,225.62/3 (2) Giải hệ (1) và (2) được a = 0,15 và b = 0,075 Do khí thu được chứa H2 nên ta suy ra dd Z chứa Al3+, Fe2+, NH4+ (có thể có) và SO42- *Sơ đồ bài toán: \(\left\{ \matrix{ +) m chất tan trong Z = 27x + 56(y + 0,3) + 18(2y - 0,15) + 1,025.96 = 132,5 (3) +) BTĐT cho dd Z: 3nAl3+ + 2nFe2+ + nNH4+ = 2nSO42- => 3x + 2(y + 0,3) + 2y - 0,15 = 2.1,025 (4) Giải (3) (4) được x = 0,4 và y = 0,1 => m1 = mAl + mFe(NO3)2 + mFe3O4 = 0,4.27 + 0,1.180 + 0,1.232 = 52 gam *Dung dịch Z chứa \(\left\{ \matrix{ +) Khi cho BaCl2 vừa đủ vào dd Z: nBaCl2 pư = nSO42- = 1,025 mol => mBaSO4 = 1,025 mol +) Khi cho AgNO3 dư vào dd vừa thu được thì có xảy ra các phản ứng sau: Ag+ + Cl- → AgCl Ag+ + Fe2+ → Fe3+ + Ag Như vậy: nAgCl = nCl- = 2nBaCl2 = 2,05 mol nAg = nFe2+ = 0,4 mol => m2 = mBaSO4 + mAgCl + mAg = 1,025.233 + 2,05.143,5 + 0,4.108 = 576,2 gam Vậy: m1 + m2 = 52 + 576,2 = 628,2 gam
Câu 16 :
Hòa tan hoàn toàn 192,07 gam hỗn hợp NaHSO4 và Fe(NO3)3 vào nước được dung dịch X. Cho m gam hỗn hợp Y gồm Mg, Al, MgO và Al2O3( trong đó oxi chiếm 30% về khối lượng) tan hết vào X. Sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch chỉ chứa muối trung hòa và 2,016 lít hỗn hợp khí T có tổng khối lượng 1,84 gam gồm 5 khí đktc, trong đó H2,N2O, NO2 lần lượt có số mol là 0,04; 0,01; 0,01. Cho BaCl2 dư vào Z thu được 356,49 gam kết tủa. Giá trị của m gần nhất với giá trị nào sau đây?
Đáp án : C Phương pháp giải :
T có chứa 5 khí là sản phẩm của phản ứng Y + dung dịch X trong đó có H2; N2O và NO2 nên hai khí còn lại là NO và N2 Đặt T có nN2 = x mol và nNO = y mol thì pt nT (1) Khối lượng của T là mT (2) Giải (1) và (2) có x và y Khi cho Z + BaCl2 thì chỉ xảy ra phản ứng : Ba2+ + SO42- → BaSO4 Bảo toàn nguyên tố S có nNaHSO4 = nBaSO4 = 1,53 mol → mFe(NO3)3 Bảo toàn nguyên tố N có 3nFe(NO3)3 > nNO + 2nN2O + 2nN2 + nNO2 → Phản ứng có tạo thêm NH4+ : nNH4 =? Ta có 4H+ + NO3- + 3e → NO + H2O 10H+ + 2NO3- + 8e → N2O + 5H2O 12H+ + 2NO3- + 10e → N2 +6 H2O 2H+ + NO3- + 1e → NO2 + H2O 10H+ + NO3- + 8e → NH4+ + 3H2O 2H+ +2e → H2 2H+ + O2- → H2O => tính được nO theo PTHH Lời giải chi tiết :
T có chứa 5 khí là sản phẩm của phản ứng Y + dung dịch X trong đó có H2; N2O và NO2 nên hai khí còn lại là NO và N2 Đặt T có nN2 = x mol và nNO = y mol thì nT = 0,09 mol = x + y + 0,04 + 0,01 + 0,01 → x + y =0,03 (1) Khối lượng của T là mT = 28x + 30y + 0,04.2 +0,01.44 + 0,01.46 → 28x + 30y =0,86 (2) Giải (1) và (2) có x = 0,02 mol và y =0,01 mol Vì phản ứng tạo khi H2 nên N+5 phản ứng hết → dung dịch thu được chứa SO42- và các cation khác Khi cho Z + BaCl2 thì chỉ xảy ra phản ứng : Ba2+ + SO42- → BaSO4 → nBaSO4 = 1,53 mol Bảo toàn nguyên tố S có nNaHSO4 = nBaSO4 = 1,53 mol → mFe(NO3)3 = 192,07 – 1,53.120 = 8,47 g nên nFe(NO3)3 = 0,035 mol Bảo toàn nguyên tố N có 3nFe(NO3)3 =0,105 mol nNO + 2nN2O + 2nN2 + nNO2 = 0,01 + 2.0,01+2.0,02 + 0,01 = 0,08 mol < 3nFe(NO3)3 → Phản ứng có tạo thêm NH4+ : nNH4 =0,105 – 0,08 =0,025 mol Ta có 4H+ + NO3- + 3e → NO + H2O 10H+ + 2NO3- + 8e → N2O + 5H2O 12H+ + 2NO3- + 10e → N2 +6 H2O 2H+ + NO3- + 1e → NO2 + H2O 10H+ + NO3- + 8e → NH4+ + 3H2O 2H+ +2e → H2 2H+ + O2- → H2O Vì dung dịch thu được chỉ chứa muối trung hòa nên bảo toàn H có : nNaHSO4 = 4nNO + 10nN2O + 12nN2 + 2nNO2 + 10nNH4 + 2nO + 2nH2 → 1,53 = 4.0,01 + 10.0,01 + 12.0,02 + 2.0,01 + 0,025.10 + 2nO + 2.0,04→ nO = 0,4 mol → mO(Y) = 6,4 g → mY = mO : 30 .100 = 21,33 g → gần nhất với 20g
Câu 17 :
Hòa tan hết một hỗn hợp Q chứa 0,6 mol Fe3O4; 0,5 mol Fe; 0,4 mol CuO vào một dung dịch hỗn hợp gồm HCl 3,7M; HNO3 4,7M. Sau khi phản ứng hoàn toàn thu được dung dịch Y trong đó chỉ chứa muối Fe3+ và muối Cu2+ và khí NO (là sản phẩm khử duy nhất). Tổng khối lượng muối trong dung dịch Y là
Đáp án : D Phương pháp giải :
Qui hỗn hợp Q về: 0,6 mol Fe2O3; 0,5 mol Fe; 0,6 mol FeO; 0,4 mol CuO 4H+ + NO3- + 3e → NO + 2H2O Vì phản ứng chỉ tạo Fe3+ và Cu2+ → Chỉ có Fe và FeO bị oxi hóa ⇒ nH+ pứ oxi hóa = 4nFe + \(\frac{4}{3}\)nFeO ⇒ nNO = ¼ . nH+ pứ oxi hóa Gọi số mol HCl là 3,7a mol ⇒ số mol HNO3 là 4,7a mol Bảo toàn điện tích: trong Y: 3nFe3+ + 2nCu2+ = nCl- + nNO3- ⇒ a = 1 ⇒ nHCl và nNO3( muối) ⇒ mmuối = mFe3+ + mCu2+ + mCl + nNO3( muối) Lời giải chi tiết :
Qui hỗn hợp Q về: 0,6 mol Fe2O3; 0,5 mol Fe; 0,6 mol FeO; 0,4 mol CuO 4H+ + NO3- + 3e → NO + 2H2O Vì phản ứng chỉ tạo Fe3+ và Cu2+ Chỉ có Fe và FeO bị oxi hóa ⇒ nH+ pứ oxi hóa = 4nFe + \(\frac{4}{3}\)nFeO = 2,8 mol ⇒ nNO = 0,7 mol Gọi số mol HCl là 3,7a mol ⇒ số mol HNO3 là 4,7a mol ⇒ nNO3( muối) = 4,7a – 0,7( mol) Bảo toàn điện tích: trong Y: 3nFe3+ + 2nCu2+ = nCl- + nNO3- ⇒ (0,6.3+0,5).3 + 2.0,4 = 3,7a + 4,7a – 0,7 ⇒ a = 1 ⇒ nHCl = 3,7 mol và nNO3( muối) = 4 mol ⇒ mmuối = mFe3+ + mCu2+ + mCl + nNO3( muối) =533,75 gam
Câu 18 :
Hòa tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B (gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z thu được chất rắn T. Nung T đến khối lượng không đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ phần trăm của Fe(NO3)2 trong X là
Đáp án : D Phương pháp giải :
Bảo toàn nguyên tố, bảo toàn khối lượng, bảo toàn điện tích. Lời giải chi tiết :
Nếu KOH phản ứng hết thì T chứa KNO2: nKNO2 = nKOH = 0,5 mol => m chất rắn = 0,5.101 = 50,5 gam > 41,05 (g) (vô lí) => KOH dư - Đặt T gồm: KOH dư (a mol) và KNO2 (b mol) + BTNT "K": nKOH = nKOH dư + nKNO2 => a + b = 0,5 + m chất rắn = 56a + 85b = 41,05 Giải hệ được: a = 0,05 và b = 0,45 BTNT "N": nKNO2 = nNO3- (dd X) = 0,45 mol - Đặt A gồm: Fe (x mol) và Cu (y mol) + mA = 56x + 64y = 11,6 + mFe2O3 + mCuO = 160.0,5x + 80y = 16 Giải hệ được x = 0,15 và y = 0,05 TH1: Giả sử dd X chứa: Fe3+ (0,15), Cu2+ (0,05), H+ và NO3- (0,45) \(11,6(g)A\left\{ \matrix{ BTĐT => nH+ = nNO3- - 2nFe3+ - 2nCu2+ = 0,45 - 0,15.3 - 0,05.2 = -0,1 < 0 (loại) TH2: Dung dịch X chứa: Fe2+ (u); Fe3+ (v); Cu2+ (0,05) và NO3- (0,45) + BTĐT: 2u + 3v + 2.0,05 = 0,45 + BTNT "Fe": u + v = 0,15 Giải hệ được u = 0,1 và v = 0,05 BTNT H: nH2O = 0,5.nHNO3 = 0,35 mol BTNT "N": nN(B) = nHNO3 - nNO3- = 0,7 - 0,45 = 0,25 mol Do dd X chứa NO3- dư nên không sinh ra H2 => Khí B chỉ chứa N và O BTNT "O": nO(B) = 3nHNO3 - 3nNO3- - nH2O = 0,7.3 - 0,45.3 - 0,35 = 0,4 mol => mB = mN + mO = 0,25.14 + 0,4.16 = 9,9 gam BTKL: m dd X = mA + mdd HNO3 - mB = 11,6 + 87,5 - 9,9 = 89,2 (g) C% Fe(NO3)2 = (0,1.180/89,2).100% = 20,2%
Câu 19 :
Hỗn hợp X gồm Mg, Al, MgO, Al2O3. Hòa tan m gam hỗn hợp X bằng dung dịch HCl vừa đủ thì thu được dung dịch chứa m + 70,295 gam muối. Cho 2m gam X tác dụng với dung dịch H2SO4 đặc, nóng, dư thu được 26,656 lít SO2 (đktc, sản phẩm khử duy nhất). Nếu cho 3m gam X tác dụng với dung dịch HNO3 loãng, dư thu được 11,424 lít hỗn hợp khí NO và N2O (đktc) có tỉ khối so với H2 là 318/17 và dung dịch Y chứa 486,45 gam muối. Giá trị m gần nhất với giá trị nào sau đây?
Đáp án : C Phương pháp giải :
Quy đổi m gam X thành Mg; Al và O với số mol lần lượt là a, b và c mol Khi cho X + HCl thì mmuối = mMgCl2 + mAlCl3 → pt (1) 2m gam X + H2SO4 đặc nóng dư thì : Bảo toàn e có 2.nMg + 2.nAl – 2.nO = 2nSO2 (2) 3m gam X + HNO3 loãng dư → NO và N2O với số mol x và y mol → lập phương trình tìm x và y Vì 2.3a + 3.3b – 3.2c = 1,5nSO2 > 0,24.3 + 0,27.8 nên pư tạo NH4+ Mg → Mg2+ + 2e Al → Al3+ + 3e O + 2e → O2- N+5 + 3e → N+2 2N+5 + 8e →2N+1 N+5 +8e → N-3 Bảo toàn e có → nN-3→ nNH4+ mmuối = mMg(NO3)2 + mAl(NO3)3 +mNH4MO3 (3) Giải (1)(2)(3) được a ; b và c Lời giải chi tiết :
Quy đổi m gam X thành Mg; Al và O với số mol lần lượt là a, b và c mol Khi cho X + HCl thì mmuối = mMgCl2 + mAlCl3 = 95a + 133,5b = m + 70,295 = 24a + 27b + 16z + 70,295 (1) 2m gam X + H2SO4 đặc nóng dư thì : Mg → Mg2+ + 2e Al → Al3+ + 3e O + 2e → O2- S+6 + 2e → S+4 Bảo toàn e có 2.2a + 2.3b – 2.2c = 2nSO2 = 2.1,19 (2) 3m gam X + HNO3 loãng dư → NO và N2O với số mol x và y mol \(\left\{ \begin{gathered}{n_{khi}} = x + y = 0,51 \\{M_{khi}} = \frac{{30x + 44y}}{{x + y}} = \frac{{318}}{{17}}.2 \\\end{gathered} \right. \to \left\{ \begin{gathered}x = 0,24 \\y = 0,27 \\\end{gathered} \right.\) Vì 2.3a + 3.3b – 3.2c = 2.1,5.1,19 > 0,24.3 + 0,27.8 nên pư tạo NH4+ Mg → Mg2+ + 2e Al → Al3+ + 3e O + 2e → O2- N+5 + 3e → N+2 2N+5 + 8e →2N+1 N+5 +8e → N-3 Bảo toàn e có 2.3a + 3.3b – 3.2c = 0,24.3 + 0,27.8 + 8nN-3 → nN-3 = 2.1,5.1,19 – 0,24.3 – 0,27.8 = 0,08625 → nNH4+ = 0,08625 mol mmuối = mMg(NO3)2 + mAl(NO3)3 +mNH4MO3 = 148.3a + 213.3b + 0,08625.80 = 486,45(3) Giải (1)(2)(3) được a = 0,49 mol; b = 0,41 mol và c = 0,51 mol → m= 24a + 27b + 16c = 30,99 gam gần nhất với 31
Câu 20 :
Hòa tan hoàn toàn m gam hỗn hợp X gồm Mg, Fe, FeCO3, Cu(NO3)2 vào dung dịch chứa NaNO3 (0,045 mol) và dung dịch H2SO4 thu được dung dịch Y chỉ chứa 62,605 gam muối trung hòa (không có ion Fe3+) và 3,808 lít (đktc) hỗn hợp khí Z (trong đó có 0,02 mol khí H2). Tỉ khối của Z so với O2 là 19/17. Thêm dung dịch NaOH 1M vào Y đến khi thu được kết tủa lớn nhất là 31,72 gam thì vừa hết 865 ml. Mặt khác, cho Y tác dụng vừa đủ với dung dịch BaCl2 được dung dịch T. Cho lượng dư dung dịch AgNO3 vào T thu được tổng 256,04 gam kết tủa. Phần trăm khối lượng của Mg trong X là
Đáp án : C Phương pháp giải :
Đặt số mol các muối MgSO4, FeSO4, CuSO4, (NH4)2SO4 lần lượt là a, b, c, d Bảo toàn Na → nNa2SO4(Y) = 0,0225 mol → pt khối lượng muối của Y (1) Pt số mol nNaOH (2) Phương trình m↓ (3) Sản phẩm sau đó là Na2SO4 => nNa2SO4 = ½ nNaOH + nNa2SO4 ban đầu → nBaSO4 Sau đó thêm tiếp AgNO3 dư => Tạo thêm AgCl = ? mol và Ag với nAg = nFe2+ = b => pt m↓ (4) Giải (1) (2) (3) (4) => a ; b; c ; d (mol) BTNT H: 2nH2SO4 = 8n(NH4)2SO4 + 2nH2 + 2nH2O => nH2O BTKL: mX = mmuối + mkhí + mH2O – mNaNO3 – mH2SO4 Lời giải chi tiết :
Đặt số mol các muối MgSO4, FeSO4, CuSO4, (NH4)2SO4 lần lượt là a, b, c, d Bảo toàn Na → nNa2SO4(Y) = 0,5nNaNO3 = 0,0225 mol 120a + 152b + 160c + 132d + 0,0225.142 = 62,605 (1) nNaOH = 2a + 2b + 2c + 2d = 0,865 (2) m↓ = 58a + 90b + 98c = 31,72 (3) Sản phẩm sau đó là Na2SO4 => nNa2SO4 = ½ nNaOH + nNa2SO4 ban đầu = 0,4325 + 0,0225 = 0,455 nBaCl2 = 0,455 => Vừa đủ để tạo ra nBaSO4 = 0,455 Sau đó thêm tiếp AgNO3 dư => Tạo thêm AgCl = 0,455.2 = 0,91 mol và nAg = nFe2+ = b => m↓ = 108b + 0,91.143,5 + 0,455.233 = 256,04 (4) Giải (1) (2) (3) (4) => a = 0,2; b = 0,18; c = 0,04; d = 0,0125 (mol) Như trên đã có nH2SO4 = nNa2SO4 tổng = 0,455 BTNT H: 2nH2SO4 = 8n(NH4)2SO4 + 2nH2 + 2nH2O => nH2O = 0,385 mol BTKL: mX = mmuối + mkhí + mH2O – mNaNO3 – mH2SO4 = 27,2 gam Bảo toàn Mg có nMg = nMgSO4 = 0,2 mol → %Mg = 17,65%
Câu 21 :
Hòa tan hết 7,44 gam hỗn hợp gồm Mg, MgO, Fe, Fe2O3 vào dung dịch chứa 0,4 mol HCl và 0,05 mol NaNO3, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch X chứa 22,47 gam muối và 0,448 lít (đktc) hỗn hợp khí gồm NO, N2 có tỉ khối so với H2 bằng 14,5. Cho dung dịch NaOH (dư) vào dung dịch X thu được kết tủa Y, lấy Y nung trong không khí đến khối lượng không đổi thu được 9,6 gam chất rắn. Mặt khác, nếu cho dung dịch X tác dụng với dung dịch AgNO3 (dư) thu được m gam kết tủa. Biết chất tan trong X chỉ chứa hỗn hợp các muối. Giá trị của m là
Đáp án : C Phương pháp giải :
- Tính số mol mỗi khí trong hỗn hợp. - Bảo toàn khối lượng ⟹ Số mol H2O. - Bảo toàn nguyên tố H ⟹ Số mol NH4+. - Bảo toàn nguyên tố N ⟹ Số mol NO3- trong X. - Tính tổng số mol điện tích Mg2+ và Fe2+ trong X và tổng số mol điện tích Mg2+ và Fe2+ trong 9,6 gam chất rắn để suy ra số mol Fe2+. - Kết tủa sau cùng thu được gồm AgCl và Ag. Lời giải chi tiết :
- Xét hỗn hợp khí: Đặt nNO = x mol; nN2 = y mol. ⟹ \(\left\{ \begin{array}{l}x + y = 0,02\\30x + 28y = 0,02.14,5.2 = 0,58\end{array} \right.\) ⟹ x = y = 0,01. - Bảo toàn khối lượng: mH2O = mhh bđ + mHCl + mNaNO3 - mmuối - mhh khí = 7,44 + 0,4.36,5 + 0,05.85 - 22,47 - 0,58 = 3,24 gam. ⟹ nH2O = 3,24/18 = 0,18 mol. - Bảo toàn nguyên tố H: nHCl = 4nNH4+ + 2nH2O ⟹ nNH4+ = (0,4 - 2.0,18)/4 = 0,01 mol. - Bảo toàn nguyên tố N: nNaNO3 = nNO3-/X + nNH4+ + nN/khí ⟹ nNO3-/X = nNaNO3 - nNH4+ - nNO - 2nN2 = 0,05 - 0,01 - 0,01 - 0,01.2 = 0,01 mol. - Dung dịch X gồm \(\left\{ \begin{array}{l}M{g^{2 + }}\\F{e^{2 + }}\\F{e^{3 + }}\\N{a^ + }:0,{05^{mol}}\\NH_4^ + :0,{01^{mol}}\\C{l^ - }:0,{4^{mol}}\\NO_3^ - :0,{01^{mol}}\end{array} \right.\) ⟹ mMg + mFe = 22,47 - 0,05.23 - 0,01.18 - 0,4.35,5 - 0,01.62 = 6,32 gam. - Xét 9,6 gam hỗn hợp rắn gồm MgO và Fe2O3. mO/rắn = 9,6 - 6,32 = 3,28 gam ⟹ nO/rắn = 0,205 mol ⟹ nđiện tích Mg2+, Fe2+ = 0,41 mol (1) - Xét dung dịch X có nđiện tích Mg2+, Fe2+ = 0,4 + 0,01 - 0,05 - 0,01 = 0,35 mol (2) - Từ (1)(2), tổng số mol điện tích Mg2+ và Fe2+ trong X nhỏ hơn trong 9,6 gam chất rắn vì trong X có Fe2+ còn trong 9,6 gam chất rắn Fe đã bị oxi hóa hoàn toàn thành Fe3+. ⟹ nFe2+ = 0,41 - 0,35 = 0,06 mol. - Trong dung dịch X có 0,06 mol Fe2+; 0,4 mol Cl- ⟹ Khi tác dụng với AgNO3 sinh ra kết tủa gồm 0,06 mol Ag và 0,4 mol AgCl. ⟹ m ↓ = 0,06.108 + 0,4.143,5 = 63,88 gam.
Câu 22 :
Cho hỗn hợp A gồm Fe và Fe2O3 tác dụng với dung dịch X gồm H2SO4 và NaNO3, sau phản ứng thu được 0,896 lít khí NO (đktc) và dung dịch Y chỉ chứa các muối. Cho dung dịch Y tác dụng với dung dịch Ba(OH)2 dư thu được 69,13 gam kết tủa. Cho dung dịch Y tác dụng với dung dịch HCl dư thu được 0,224 lít khí NO và dung dịch Z. Biết dung dịch Z không có khả năng phản ứng với dung dịch X, NO là sản phẩm khử duy nhất của N+5. Phần trăm khối lượng của Fe trong hỗn hợp ban đầu gần nhất với giá trị nào sau đây?
Đáp án : D Phương pháp giải :
\(\left\{ \begin{array}{l}Fe\\F{e_2}{O_3}\end{array} \right.\) + dd X \(\left\{ \begin{array}{l}{H_2}S{O_4}\\NaN{O_3}\end{array} \right.\)→ dd Y \(\left\{ \begin{array}{l}F{e^{3 + }}\\F{e^{2 + }}\\N{a^ + }\\SO_4^{2 - }\\NO_3^ - \end{array} \right.\) + NO ↑ + H2O Kết tủa gồm Fe(OH)2, Fe(OH)3, BaSO4 - Từ dd Y + HCl ⟹ nFe2+ - Đặt nFe3+ = x; nSO42- = y; nNa+ = z Lập hệ PT dựa vào: + Bảo toàn điện tích trong dung dịch Y + 69,13 gam kết tủa - Dựa vào phân chia nhiệm vụ H+ ⟹ nFe2O3 - Bảo toàn nguyên tố Fe ⟹ nFe Lời giải chi tiết :
\(\left\{ \begin{array}{l}Fe\\F{e_2}{O_3}\end{array} \right.\)+ dd X \(\left\{ \begin{array}{l}{H_2}S{O_4}\\NaN{O_3}\end{array} \right.\)→ dd Y \(\left\{ \begin{array}{l}F{e^{3 + }}\\F{e^{2 + }}\\N{a^ + }\\SO_4^{2 - }\\NO_3^ - \end{array} \right.\) + NO ↑ + H2O - A + dd X: 4H+ + NO3- + 3e → NO + 2H2O 0,04 ← 0,04 - Dd Y + HCl dư: (sau phản ứng thu được dung dịch Z không có phản ứng với dung dịch X ⟹ Z không còn Fe2+) 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O 0,03 ← 0,01 - Dd Y gồm \(\left\{ \begin{array}{l}F{e^{3 + }}:x\\F{e^{2 + }}:0,03\\N{a^ + }:z\\SO_4^{2 - }:y\\NO_3^ - :z - 0,04\end{array} \right.\)⟹ Bảo toàn điện tích: 3x + 0,06 + z = 2y + z - 0,04 ⟹ -3x + 2y = 0,1 (1) - 69,13 gam kết tủa gồm \(\left\{ \begin{array}{l}Fe{(OH)_2}:0,03\\Fe{(OH)_3}:x\\BaS{O_4}:y\end{array} \right.\) ⟹ 107x + 233y = 69,13 - 0,03.90 = 66,43 (2) (1)(2) ⟹ x = 0,12; y = 0,23. ⟹ nH+ = 2y = 0,46 mol. - A + dd X: 4H+ + NO3- + 3e → NO + 2H2O 0,16 ←0,04 ← 0,04 2H+ + O2- → H2O 0,3 → 0,15 ⟹ nFe2O3 = 0,15/3 = 0,05 mol Bảo toàn nguyên tố Fe: nFe = 0,12 + 0,03 - 0,05.2 = 0,05 mol. ⟹ %mFe = 25,93% gần nhất với 26%.
Câu 23 :
Hòa tan hết 16,58 gam hỗn hợp X gồm Al, Mg, Fe, FeCO3 trong dung dịch chứa 1,16 mol NaHSO4 và 0,24 mol HNO3, thu được dung dịch Z (chỉ chứa muối trung hòa) và 6,89 gam hỗn hợp khí Y gồm CO2, N2, NO, H2 (trong Y có 0,035 mol H2 và tỉ lệ mol NO : N2 = 2 : 1). Dung dịch Z phản ứng tối đa với 1,46 mol NaOH, lọc lấy kết tủa đem nung trong không khí tới khối lượng không đổi thu được 8,8 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng Fe đơn chất trong X là:
Đáp án : B Phương pháp giải :
- Đặt nNH4+ = a; nCO2 = b; nN2 = c; nNO = 2c - Lâp hệ PT dựa vào: + Khối lượng hỗn hợp khí Y. + Số mol H+ phản ứng. + Bảo toàn nguyên tố N. - nFeCO3 = nCO2 = b nAl = 1,46 - 1,16 = 0,3 mol - Đặt nMg = x mol; nFe = y mol - Lập hệ PT dựa vào: + Khối lượng hỗn hợp X ban đầu. + 8,8 gam chất rắn gồm MgO, Fe2O3 ⟹ %mFe Lời giải chi tiết :
16,58g \(\left\{ \begin{array}{l}Al\\Mg\\Fe\\FeC{O_3}\end{array} \right.\)+ \(\left\{ \begin{array}{l}NaHS{O_4}:1,16\\HN{O_3}:0,24\end{array} \right.\)→ dd Z \(\left\{ \begin{array}{l}A{l^{3 + }}\\M{g^{2 + }}\\F{e^{2 + }}\\F{e^{3 + }}\\NH_4^ + \\N{a^ + }:1,16\\SO_4^{2 - }:1,16\end{array} \right.\) + khí Y \(\left\{ \begin{array}{l}C{O_2}:b\\NO:2c\\{N_2}:c\\{H_2}:0,035\end{array} \right.\) + H2O - Đặt nNH4+ = a; nCO2 = b; nN2 = c; nNO = 2c. - Khối lượng khí Y: 44b + 30.2c + 28c + 2.0,035 = 6,89 ⟹ 44b + 88c = 6,82 (1) - 4H+ + NO3- + 3e → NO + 2H2O 12H+ + 2NO3- + 10e → N2 + 6H2O 10H+ + NO3- + 8e → NH4+ + 3H2O 2H+ + CO32- → CO2 + H2O 2H+ + 2e → H2 ⟹ nH+ = 4nNO + 12nN2 + 10nNH4+ + 2nCO2 + 2nH2 = 1,16 + 0,24 = 1,4 ⟹ 4.2c + 12c + 10a + 2b = 1,4 - 0,035.2 ⟹ 10a + 2b + 20c = 1,33 (2) - Bảo toàn nguyên tố N nNO3- = nNH4+ + nNO + 2nN2 ⟹ a + 2c + 2c = 0,24 ⟹ a + 4c = 0,24 (3) Từ (1)(2)(3) ⟹ a = 0,01; b = 0,04; c = 0,0575 ⟹ nFeCO3 = 0,04 mol. - nNaOH pứ = 1,46 mol chênh 0,3 mol so với 1,16 mol (3nAl3+ + 2nMg2+ + 2nFe2+ + 3nFe3+ + nNH4+ = 2nSO42- - nNa+ = 1,16 mol) do còn phản ứng NaOH hòa tan Al(OH)3. ⟹ nAl3+ = 1,46 - 1,16 = 0,3 mol. - Đặt nMg = x mol; nFe = y mol. ⟹ 24x + 56y + 0,3.27 + 0,04.116 = 16,58 ⟹ 24x + 56y = 3,84 (5) - 8,8 gam chất rắn gồm MgO: x mol; Fe2O3: 0,5y + 0,02 mol ⟹ 40x + 160(0,5y + 0,02) = 8,8 ⟹ 40x + 80y = 5,6 (6) Từ (5)(6) ⟹ x = 0,02; y = 0,06 ⟹ %mFe = 20,27%.
Câu 24 :
Cho 3,5a gam hỗn hợp X gồm C và S tác dụng với lượng dư dung dịch HNO3 đặc, nóng, thu được hỗn hợp khí Y gồm NO2 và CO2 có thể tích 3,584 lít (đktc). Dẫn toàn bộ Y qua bình đựng dung dịch nước vôi trong dư thu được 12,5a gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của a là:
Đáp án : B Phương pháp giải :
Đặt số mol C và S lần lượt là x và y (mol) Cho X + HNO3 đặc nóng:
+) Bảo toàn e → 4nC + 6nS = nNO2 → (1) +) Từ tỉ lệ \(\frac{{{m_X}}}{{{m_{CaC{{\rm{O}}_3}}}}}\) → (2) Giải (1) (2) được x và y Xác định giá trị của a Lời giải chi tiết :
Đặt số mol C và S lần lượt là x và y (mol) Cho X + HNO3 đặc nóng:
+) Bảo toàn e → 4nC + 6nS = nNO2 → 4x + 6y = 0,16 - x (1) +) \(\frac{{{m_X}}}{{{m_{CaC{{\rm{O}}_3}}}}} = \frac{{12{\rm{x}} + 32y}}{{100{\rm{x}}}} = \frac{{3,5}}{{12,5}}\) (2) Giải (1) (2) được x = 0,02 và y = 0,01 ⟹ mX = 3,5a = 0,02.12 + 0,01.32 ⟹ a = 0,16
Câu 25 :
Hòa tan hết 2,72 gam hỗn hợp X gồm: FeS2, FeS, Fe, CuS và Cu trong 500 ml dung dịch HNO3 1M, sau khi kết thúc các phản ứng thu được dung dịch Y và 0,07 mol một chất khí. Cho Y tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Mặt khác, dung dịch Y có thể hòa tan tối đa m gam Cu. Biết trong các quá trình trên, sản phẩm khử duy nhất của N+5 là NO. Giá trị của m là
Đáp án : C Phương pháp giải :
Coi hh X gồm Fe, Cu và S \(2,72\,g\,X\left\{ \begin{array}{l}Fe:\,x(mol)\\Cu:\,y(mol)\\S\end{array} \right. + HN{O_3}:0,5 \to 0,07\,mol\,NO + dd\,Y\left\{ \begin{array}{l}F{e^{3 + }}\\F{e^{2 + }}\\{H^ + }\\S{O_4}^{2 - }\\N{O_3}^ - \end{array} \right. + BaC{l_2}du \to 4,66\,g\,BaS{O_4}\) Sử dụng bảo toàn nguyên tố S, H Sử dụng bảo toàn khối lượng và bảo toàn e Lời giải chi tiết :
Coi hh X gồm Fe, Cu và S \(2,72\,g\,X\left\{ \begin{array}{l}Fe:\,x(mol)\\Cu:\,y(mol)\\S\end{array} \right. + HN{O_3}:0,5 \to 0,07\,mol\,NO + dd\,Y\left\{ \begin{array}{l}F{e^{3 + }}\\F{e^{2 + }}\\{H^ + }\\S{O_4}^{2 - }\\N{O_3}^ - \end{array} \right. + BaC{l_2}du \to 4,66\,g\,BaS{O_4}\) BTNT “S”: nS = nBaSO4 = 4,66 : 233 = 0,02 (mol) quá trình nhường e Fe → Fe+3 + 3e x → 3x (mol) Cu → Cu+2 + 2e y → 2y (mol) S + H2O + 6e → 8H+ + SO42- 0,02 → 0,12→ 0,16 (mol) quá trình nhận e 4H+ + NO3‑ + 3e → NO + 2H2O (*) 0,28 0,21 ← 0,07 (mol) Lượng H+ có trong dd Y là: nH+ = nHNO3 + 8nS - 4nNO = 0,5 + 8.0,02 - 4.0,07 = 0,38 (mol) Ta có hệ: \(\left\{ \begin{array}{l}{m_{hhX}} = 56x + 64y + 0,02.32 = 2,72\\Bt\,e:3x + 2y + 0,12 = 0,21\end{array} \right. \Rightarrow \left\{ \begin{array}{l}x = 0,02\\y = 0,015\end{array} \right.\) Vậy dd Y chứa \(\left\{ \begin{array}{l}F{e^{3 + }}:0,02\,\,mol\\C{u^{2 + }}:0,015\,mol\\{H^ + }:0,38\,\,mol\\S{O_4}^{2 - }:\,0,02\,mol\\N{O_3}^ - :0,43\,mol\end{array} \right. + Cu:a(mol) \to \left\{ \begin{array}{l}F{e^{2 + }}:0,015\,\,mol\\C{u^{2 + }}:0,015\, + a\,mol\\S{O_4}^{2 - }:\,0,02\,mol\\N{O_3}^ - :\end{array} \right. + NO + {H_2}O\) Cho Cu vào dd Y có: nNO = 1/4nH+ = 1/4.0,38 = 0,095 (mol) (Nhìn theo tương tự như bán phản ứng (*)) Bảo toàn e ta có: 2nCu = nFe3+ + 3nNO = 0,02 + 3.0,095 → nCu = 0,1525 (mol) → mCu = 0,1525×64 = 9,76 (g)
Câu 26 :
Hòa tan hết 11,02 gam hỗn hợp X gồm FeCO3, Fe(NO3)2 và Al vào dung dịch Y chứa KNO3 và 0,4 mol HCl, thu được dung dịch Z và 2,688 lít (đktc) khí T gồm CO2, H2 và NO (có tỷ lệ mol tương ứng là 5 : 2 : 5). Dung dịch Z phản ứng được tối đa với 0,45 mol NaOH. Nếu cho Z tác dụng với dung dịch AgNO3 dư thì thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn và NO là sản phẩm khử duy nhất của N+5 trong các phản ứng trên. Cho các kết luận liên quan đến bài toán gồm: (a) Khi Z tác dụng với dung dịch KOH thì có khí thoát ra. (b) Số mol khí H2 trong T là 0,04 mol. (c) Khối lượng Al trong X là 1,62 gam. (d) Thành phần phần trăm về khối lượng của AgCl trong m gam kết tủa là 92,75%. Số kết luận đúng là
Đáp án : C Lời giải chi tiết :
Đặt nFe(NO3)2 = x mol và nAl = y mol Xét hỗn hợp khí T có nT = 0,12 mol thì theo tỉ lệ có nCO2 = 0,05 mol, nH2 = 0,02 mol và nNO = 0,05 mol → nFeCO3 = 0,05 mol → 180x + 27y + 0,05.116 = 11,02 (1) PTHH: 4H+ + NO3- + 3e → 2H2O + NO 2H+ + CO32- → H2O + CO2 2H+ + 2e → H2 → nH+pư = 0,05.2 + 0,02.2 + 0,05.4 = 0,34 mol → nH+dư = 0,06 mol Dung dịch Z có Fe3+: z mol thì Fe2+: x + 0,05 – z (mol) Bảo toàn e có z + 3y = 2nH2 + 3nNO = 0,19 mol (2) Z + NaOH → thì nNaOH = nH+ dư + 3z + 2(x + 0,05 - z) + 4y = 0,45 mol → 2x + 4y + z = 0,29 mol (3) Giải (1)(2)(3) có x = 0,02 mol; y = 0,06; z = 0,01 mol Vậy dung dịch Z có \(\left\{ \begin{array}{l}F{{\rm{e}}^{3 + }}\left( {0,01} \right);F{{\rm{e}}^{2 + }}\left( {0,06} \right);A{l^{3 + }}\left( {0,06} \right);{H^ + }\left( {0,06} \right)\\{K^ + }\left( {0,01} \right)\left( {BT{\rm{D}}T} \right)\\C{l^ - }\left( {0,4} \right)\end{array} \right.\) Khi cho Z tác dụng với AgNO3 dư: 3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO 0,045 ← 0,06 Fe2+ + Ag+ → Fe3+ + Ag 0,015 → 0,015 Ag+ + Cl- → AgCl 0,4 → 0,4 Kết tủa gồm 0,015 mol Ag và 0,4 mol AgCl. (a) sai, vì Z không có NH4+. (b) sai, số mol khí H2 trong T là 0,02 mol. (c) đúng. (d) sai, %mAgCl = \(\dfrac{{0,4.143,5}}{{0,015.108 + 0,4.143,5}}.100\% \) = 97,26%. Vậy có 1 phát biểu đúng.
|