Trắc nghiệm Bài 4. Phản ứng trao đổi ion trong dung dịch các chất điện li - Hóa 11Đề bài
Câu 1 :
Dãy gồm các chất có thể cùng tồn tại trong một dung dịch:
Câu 2 :
Trong một dung dịch có thể cùng tồn tại các ion sau:
Câu 3 :
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là
Câu 4 :
Cho các phản ứng hoá học sau: (1) (NH4)2SO4 + BaCl2 (2) CuSO4 + Ba(NO3)2 (3) Na2SO4 + BaCl2 (4) H2SO4 + BaSO3 (5) (NH4)2SO4 + Ba(OH)2 (6) Fe2(SO4)3 + Ba(NO3)2 Các phản ứng đều có cùng phương trình ion rút gọn là
Câu 5 :
Cho 0,1 mol Ca2+ và x mol NO3− cùng tồn tại trong một dung dịch. Giá trị của x là:
Câu 6 :
Một dung dịch chứa 0,01 mol Mg2+, 0,03 mol Na+, x mol Cl- và y mol PO43−. Tổng khối lượng các muối tan có trong dung dịch là 2,59 gam. Giá trị của x và y lần lượt là:
Câu 7 :
Dựa vào định luật bảo toàn điện tích cho biết dung dịch nào sau đây không thể tồn tại ?
Câu 8 :
Dung dịch Y chứa Ca2+ 0,1 mol; Mg2+ 0,3 mol; Cl− 0,4 mol; HCO3− y mol. Cô cạn dung dịch ta thu được m gam muối khan. Giá trị của m là:
Câu 9 :
Cho hỗn hợp X gồm x mol FeS2 và 0,025 mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại và giải phóng khí NO duy nhất. Giá trị của x là :
Câu 10 :
Dụng dịch X có chứa 5 ion: Mg2+, Ba2+, Ca2+; 0,125 mol Cl- và 0,25 mol NO3-. Thêm dần V lít dung dịch Na2CO3 1M vào X đến khi thu được lượng kết tủa lớn nhất. Giá trị của V là:
Câu 11 :
Hoà tan hoàn toàn 16 gam hỗn hợp X gồm Mg và Fe bằng dung dịch HCl 3M. Kết thúc thí nghiệm thu được dung dịch Y và 8,96 lít khí H2 (đktc). Để kết tủa phản ứng hoàn toàn với dung dịch Y cần vừa đủ 300 ml NaOH 2M. Thể tích dung dịch HCl đã dùng là:
Câu 12 :
Chia hỗn hợp X gồm 2 kim loại có hóa trị không đổi thành 2 phần bằng nhau. Phần 1: Hòa tan hoàn toàn bằng dung dịch HCl dư thu được 1,792 lít H2 (đktc). Phần 2: Nung trong không khí dư, thu được 2,84 gam hỗn hợp rắn chỉ gồm các oxit. Khối lượng hỗn hợp X là:
Câu 13 :
Trộn dung dịch chứa Ba2+ ; OH− 0,06 mol và Na+ 0,02 mol với dung dịch HCO3− 0,04 mol; CO32− 0,03 mol và Na+. Khối lượng kết tủa thu được sau khi trộn là:
Câu 14 :
Dung dịch X chứa 0,025 mol CO32-; 0,1 mol Na+ ; 0,25 mol NH4+ và 0,3 mol Cl−. Cho 270 ml dung dịch Ba(OH)2 0,2 M vào và đun nhẹ (giả sử H2O bay hơi không đáng kể).Tổng khối lượng dung dịch X và dung dịch Ba(OH)2 sau quá trình phản ứng giảm đi là:
Câu 15 :
Dung dịch X chứa các ion: Fe3+ ; SO42 ; NH4+; Cl−. Chia dung dịch thành 2 phần bằng nhau: - Phần 1: Cho tác dụng với lượng dư dung dịch NaOH , đun nóng thu được 0,672 lít khí ở đktc và 1,07 gam kết tủa. - Phần 2: Tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Tổng khối lượng các muối khan thu được khi cô cạn dung dịch X là (quá trình cô cạn chỉ có nước bay hơi)
Câu 16 :
Cho 22,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thì thu được bao nhiêu gam muối clorua khan?
Câu 17 :
Cho hỗn hợp X gồm x mol FeS2 và y mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại. Và giải phóng khí NO duy nhất. Mối liện hệ giữa x và y là:
Câu 18 :
Dung dịch B chứa ba ion K+; Na+; PO43-. 1 lít dung dịch B tác dụng với CaCl2 dư thu được 31 gam kết tủa. Mặt khác nếu cô cạn 1 lít dung dịch B thu được 37,6 gam chất rắn khan. Nồng độ của 3 ion K+; Na+; PO43- lần lượt là:
Câu 19 :
Phản ứng nào sau đây không phải là phản ứng trao đổi?
Câu 20 :
Cặp chất nào sau đây không thể tồn tại trong một dung dịch?
Câu 21 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
Câu 22 :
Phương trình ion rút gọn của phản ứng cho biết
Câu 23 :
Ion CO2−3 cùng tồn tại với các ion sau trong một dung dịch:
Câu 24 :
Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
Câu 25 :
Trong các dung dịch: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2, có bao nhiêu chất tác dụng được với dung dịch Ba(HCO3)2?
Câu 26 :
Trộn các cặp dung dịch các chất sau với nhau: 1) NaHSO4 + NaHSO3 2) Na3PO4 + K2SO4 3) AgNO3 + Fe(NO3)2 4) C6H5ONa + H2O 5) CuS + HNO3 6) BaHPO4 + H3PO4 7) NH4Cl + NaNO2 (đun nóng) 8) Ca(HCO3)2 + NaOH 9) NaOH + Al(OH)3 10) MgSO4 + HCl. Số phản ứng xảy ra là
Câu 27 :
Cho dãy các chất: H2SO4,KOH, Ca(NO3)2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
Câu 28 :
Phương trình phân tử: BaHPO4 + H2SO4 →BaSO4 ↓+ H3PO4 tương ứng với phương trình ion thu gọn nào sau đây?
Câu 29 :
Dung dịch NaHSO4 tác dụng được với tất cá các chất có trong nhóm nào sau đây?
Câu 30 :
Cho sơ đồ sau: X + Y → CaCO3 + BaCO3 + H2O X,Y có thể là
Câu 31 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
Câu 32 :
Dung dịch nào sau đây không tác dụng với dung dịch HCl loãng?
Câu 33 :
Một dung dịch chứa x mol Na+, y mol Ca2+, z mol HCO3-, t mol Cl-. Hệ thức quan hệ giữa x, y , z, t được xác định là:
Câu 34 :
Thể tích (ml) của dung dịch NaOH 0,3M cần để trung hòa 3 lít dung dịch HCl 0,01M là
Câu 35 :
Cặp chất nào sau đây tác dụng với nhau tạo ra sản phẩm đều là chất khí?
Câu 36 :
Phương trình hóa học nào viết sai so với phản ứng xảy ra?
Câu 37 :
Cho phản ứng NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
Câu 38 :
Trung hòa 10 ml dung dịch HCl 1M cần 20 ml dung dịch KOH nồng độ a mol/l. Giá trị của a là
Câu 39 :
Cần thêm ít nhất bao nhiêu lít NH3 (đktc) vào 250 ml dung dịch Al2(SO4)3 0,2M để làm kết tủa hoàn toàn ion nhôm dưới dạng Al(OH)3.
Câu 40 :
Dung dịch X được tạo ra từ 2 muối chứa đồng thời các ion: Al3+, Fe2+, Cl-, SO42-. Cho dung dịch BaCl2 dư vào dung dịch chứa 200 ml dung dịch X thu được 13,98 gam kết tủa. Mặt khác, cho dung dịch Ba(OH)2 đến dư vào 200 ml dung dịch X thu được 21,18 gam kết tủa. Nồng độ mol/l của Cl- là?
Câu 41 :
Nhỏ từ từ 0,125 lít dung dịch Ba(OH)2 1M vào dung dịch gồm 0,024 mol FeCl3; 0,016 mol Al2(SO4)3 và 0,04 mol H2SO4 thu được m gam kết tủa. Tính giá trị m?
Câu 42 :
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch HCl 1,04M và H2SO4 0,28M, thu được dung dịch X và khí H2. Cho 850 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn thu được 16,5 gam kết tủa gồm 2 chất. Mặt khác cho từ từ dung dịch hỗn hợp KOH 0,8M và Ba(OH)2 0,1M vào X đến khi thu được lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây?
Câu 43 :
Dung dịch X gồm 0,25 mol Ba2+; 1,3 mol Na+; a mol OH- và b mol Cl-. Cho 400 ml dung dịch Y gồm H2SO4 0,25M; HCl 0,25M và ZnSO4 1M vào dung dịch X. Sau khi các phản ứng kết thúc, thu được kết tủa G. Nung toàn bộ G đến khối lượng không đổi thu được 69,59 gam chất rắn H. Giá trị của b là:
Câu 44 :
Dung dịch X gồm NaOH 0,2M và Ba(OH)2 0,05M. Dung dịch Y gồm Al2(SO4)3 0,4M và H2SO4 xM. Trộn 0,1 lít dung dịch Y với 1 lít dung dịch X thu được 16,33 gam kết tủa. Giá trị của x là:
Câu 45 :
Dung dịch X chứa các cation gồm Mg2+, Ba2+, Ca2+ và các anion gồm Cl- và NO3-. Thêm từ từ 250 ml dung dịch Na2CO3 1M vào dung dịch X thì thu được lượng kết tủa lớn nhất. Tổng số mol các anion có trong dung dịch X là:
Câu 46 :
Trộn lẫn hỗn hợp các ion sau: (I) K+, CO32-, S2- với H+, Cl-, NO3- (II) Na+, Ba2+, OH- với H+, Cl-, SO42- (III) NH4+, H+, SO42- với Na+, Ba2+, OH- (IV) H+, Fe2+, SO42- với Ba2+, K+, OH- (V) K+, Na+, HSO3- với Ba2+, Ca2+, OH- (VI) Cu2+, Zn2+, Cl- với K+, Na+, OH- Trường hợp có thể xảy ra 3 phản ứng là :
Câu 47 :
Có 2 dung dịch chứa 2 cation và 2 anion không trùng nhau trong các ion sau: K+ (0,15 mol), Mg2+ (0,1 mol), NH4+ (0,25 mol), H+ (0,25 mol), Cl- (0,1 mol), SO42- (0,075 mol), NO3- (0,25 mol), CO32- (0,15 mol). Một trong 2 dung dịch trên chứa các ion nào dưới đây?
Câu 48 :
Cho dãy các ion sau: (a) H+, Fe3+, NO3-, SO42- (b) Ag+, Na+, NO3-, Cl- (c) Al3+, NH4+, Br-+, OH- (d) Mg2+, K+, SO42-, PO43- (e) K+, HPO42-, Na+, OH- (g) Fe2+, Na+, HSO4-, NO3- (h) Ag+, NH4+, SO42-, I- (i) Mg2+, Na+, SO42- Số dãy gồm các ion cùng tồn tại trong 1 dung dịch là:
Câu 49 :
Trộn 150 ml dung dịch MgCl2 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Cl- trong dung dịch mới là
Câu 50 :
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
Câu 51 :
Hỗn hợp X gồm Na và Ba có tỉ lệ mol 1 : 1. Hòa tan một lượng X vào nước được 3,36 lít H2 (đktc) và dung dịch Y. Cho 4,48 lít CO2 hấp thụ hết vào dung dịch Y thì thu được m gam kết tủa. Giá trị của m là:
Câu 52 :
Hòa tan hoàn toàn hỗn hợp X gồm 0,12 mol FeS2 và a mol Cu2S vào dung dịch HNO3 đặc (đủ) sau phản ứng thu được dung dịch A chỉ chứa muối sunfat và khí NO2. Giá trị của a là:
Câu 53 :
Cho dung dịch KOH 1 M tới dư vào dung dịch X sau phản ứng thu được kết tủa. Dung dịch X có thể chứa đồng thời các chất
Câu 54 :
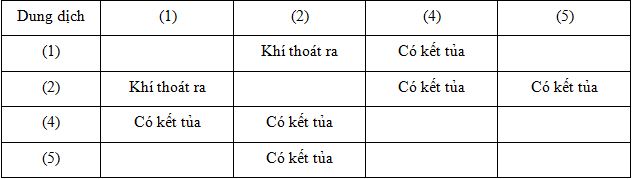
Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau:
Các dung dịch (1), (3), (5) lần lượt là
Câu 55 :
Thực hiện các thí nghiệm sau: (a) Cho dung dịch Ba(HCO3)2 vào dung dịch NaHSO4. (b) Cho Na vào dung dịch FeCl2 dư. (c) Cho dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. (d) Sục khí CO2 dư vào dung dịch hỗn hợp NaOH và Ba(OH)2. (e) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2. Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả kết tủa và khí là
Lời giải và đáp án
Câu 1 :
Dãy gồm các chất có thể cùng tồn tại trong một dung dịch:
Đáp án : B Phương pháp giải :
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li Lời giải chi tiết :
Dãy gồm các chất có thể cùng tồn tại trong 1 dung dịch là các chất không phản ứng được với nhau A sai vì BaCl2 có thể tác dụng với Na2SO4; Na2CO3 có thể tác dụng với H2SO4 C sai vì Na2CO3 có thể tác dụng với BaCl2 D sai vì HCl có thể tác dụng với NaOH và Na2CO3
Câu 2 :
Trong một dung dịch có thể cùng tồn tại các ion sau:
Đáp án : A Phương pháp giải :
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li Lời giải chi tiết :
Các ion có thể cùng tồn tại với nhau trong dung dịch thì không phản ứng với nhau B sai vì: NH4+ + OH- → NH3 + H2O C sai vì: 3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O D sai vì Ba2+ + SO42- → BaSO4
Câu 3 :
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li Lời giải chi tiết :
Dãy gồm các ion không thể cùng tồn tại trong một dung dịch là Na+,K+,HSO−4,OH− Vì: HSO4- + OH- → SO42- + H2O
Câu 4 :
Cho các phản ứng hoá học sau: (1) (NH4)2SO4 + BaCl2 (2) CuSO4 + Ba(NO3)2 (3) Na2SO4 + BaCl2 (4) H2SO4 + BaSO3 (5) (NH4)2SO4 + Ba(OH)2 (6) Fe2(SO4)3 + Ba(NO3)2 Các phản ứng đều có cùng phương trình ion rút gọn là
Đáp án : A Phương pháp giải :
Xem lại lí thuyết phản ứng trao đổi ion trong dung dịch chất điện li Lời giải chi tiết :
(1) SO42- + Ba2+ → BaSO4 (4) 2H+ + SO42- + BaSO3 → BaSO4 + SO2 + H2O (2) SO42- + Ba2+ → BaSO4 (5) 2NH4+ + SO42- + Ba2+ + OH- → BaSO4 + NH3 + H2O (3) SO42- + Ba2+ → BaSO4 (6) SO42- + Ba2+ → BaSO4 => Các phản ứng có cùng phương trình ion rút gọn là: (1), (2), (3), (6).
Câu 5 :
Cho 0,1 mol Ca2+ và x mol NO3− cùng tồn tại trong một dung dịch. Giá trị của x là:
Đáp án : B Phương pháp giải :
Áp dụng ĐLBT điện tích: ∑n(+)=∑n(−) Lời giải chi tiết :
Áp dụng ĐLBT điện tích: dung dịch luôn trung hòa về điện => 2.nCa2+ = 1.nNO3− = > 2.0,1 = 1.x => x = 0,2 (mol)
Câu 6 :
Một dung dịch chứa 0,01 mol Mg2+, 0,03 mol Na+, x mol Cl- và y mol PO43−. Tổng khối lượng các muối tan có trong dung dịch là 2,59 gam. Giá trị của x và y lần lượt là:
Đáp án : D Phương pháp giải :
+) Áp dụng định luật bảo toàn điện tích có PT(1) +) Áp dụng định luật bảo toàn khối lượng ta có: mmuối = ∑mion => PT (2) Lời giải chi tiết :
Áp dụng định luật bảo toàn điện tích ta có: 0,01.2 + 0,03.1 = x.1 + y.3 (1) Áp dụng định luật bảo toàn khối lượng ta có: mmuối = ∑mion = > 2,59 = 0,01.24 + 0,03.23 + x.35,5 + y.95 (2) - Giải hệ hai phương trình (1) và (2) ta được: x = 0,02; y = 0,01
Câu 7 :
Dựa vào định luật bảo toàn điện tích cho biết dung dịch nào sau đây không thể tồn tại ?
Đáp án : A Phương pháp giải :
Áp dụng định luật bảo toàn điện tích: ∑n( + )=∑n( - ) Lời giải chi tiết :
Dung dịch luôn trung hòa về điện nên: ∑n( + )=∑n( - ) A. 0,1.1 + 0,1.2 + 0,15 ≠ 0,25.1 + 0,1. 1 B. 0,2.2 + 0,25.1 = 0,25.1 + 0,4.1 C. 0,1.1 + 0,2.2 = 0,05.1 + 0,05.1 + 0,2.1 D. 0,2.2 + 0,1.1 + 0,1.1 = 0,25.2 + 0,05.1 + 0,05.1
Câu 8 :
Dung dịch Y chứa Ca2+ 0,1 mol; Mg2+ 0,3 mol; Cl− 0,4 mol; HCO3− y mol. Cô cạn dung dịch ta thu được m gam muối khan. Giá trị của m là:
Đáp án : C Phương pháp giải :
Bước 1: Tìm y: Áp dụng ĐLBTĐT => y Bước 2: Tính số mol của CO32− Khi cô cạn : 2HCO3− → CO32− + H2O + CO2 nCO32−=12 nHCO3− Bước 3: Tính khối lượng muối mmuối=mCa2++ mMg2+ + mCl− + mCO32− Lời giải chi tiết :
Bước 1: Áp dụng ĐLBT điện tích: nCa2++nMg2+=nCl−+nHCO−3 =>nHCO−3=(0,1.2+0,3.2)−0,4=0,4(mol) Bước 2: Khi cô cạn dung dịch HCO−3 chuyển thành CO2−3theo phương trình: =>nCO2−3=12.nHCO−3=0,2(mol) Bước 3: Khối lượng của muối m = mkim loại + mgốc axit m=mCa2++mMg2++mCl−+mCO2−3 m=40.0,1+24.0,3+35,5.0,4+60.0,2=37,4(g)
Câu 9 :
Cho hỗn hợp X gồm x mol FeS2 và 0,025 mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại và giải phóng khí NO duy nhất. Giá trị của x là :
Đáp án : C Phương pháp giải :
Bảo toàn điện tích, bảo toàn nguyên tố Lời giải chi tiết :
{FeS2Cu2S+HNO3→{Fe2(SO4)3CuSO4+NO+H2O - Bảo toàn nguyên tố S ta có: nSO2−4=2.nFeS2+nCu2S=2x+0,025 → dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 0,05; SO42-: (2x + 0,025) mol - Áp dụng định luật bảo toàn điện tích: 3x + 2.0,05 = 2.(2x + 0,025) → x = 0,05
Câu 10 :
Dụng dịch X có chứa 5 ion: Mg2+, Ba2+, Ca2+; 0,125 mol Cl- và 0,25 mol NO3-. Thêm dần V lít dung dịch Na2CO3 1M vào X đến khi thu được lượng kết tủa lớn nhất. Giá trị của V là:
Đáp án : C Phương pháp giải :
+) Vì cả ba ion Mg2+, Ca2+ và Ba2+ đều tạo kết tủa với CO32- nên đến khi được kết tủa lớn nhất thì dung dịch chỉ chứa Na+, Cl-, và NO3-. +) Áp dụng định luật bảo toàn toàn điện tích: nNa+=nCl−+nNO−3 Lời giải chi tiết :
Vì cả ba ion Mg2+, Ca2+ và Ba2+ đều tạo kết tủa với CO32- nên đến khi được kết tủa lớn nhất thì dung dịch chỉ chứa Na+, Cl-, và NO3-. Gọi nNa2CO3 = a mol => nNa+ = 2a mol Áp dụng định luật bảo toàn toàn điện tích ta có: ∑ n( + ) = ∑ n( - )=>2a.1= 0,125.1+0,25.1=> a=0,1875 (mol) =>V=n:CM=0,1875(l)
Câu 11 :
Hoà tan hoàn toàn 16 gam hỗn hợp X gồm Mg và Fe bằng dung dịch HCl 3M. Kết thúc thí nghiệm thu được dung dịch Y và 8,96 lít khí H2 (đktc). Để kết tủa phản ứng hoàn toàn với dung dịch Y cần vừa đủ 300 ml NaOH 2M. Thể tích dung dịch HCl đã dùng là:
Đáp án : A Phương pháp giải :
+) Dung dịch Y chứa Mg2+, Fe2+, H+ dư (nếu có), Cl-. Khi cho Y tác dụng với dung dịch NaOH vừa đủ thì dung dịch thu được sau phản ứng chỉ còn lại Na+ và Cl-. Áp dụng định luật bảo toàn điện tích: nCl−=nNa+ =>VHCl Lời giải chi tiết :
nNa+ = nOH− = nNaOH = 0,3.2 = 0,6 (mol) Dung dịch Y chứa Mg2+, Fe2+, H+ dư (nếu có), Cl-. Khi cho Y tác dụng với dung dịch NaOH vừa đủ thì dung dịch thu được sau phản ứng chỉ còn lại Na+ và Cl-. Áp dụng định luật bảo toàn điện tích cho dung dịch này ta có: nCl−=nNa+=0,6 (mol) =>VHCl = n:CM = 0,6:3 = 0,2(l)
Câu 12 :
Chia hỗn hợp X gồm 2 kim loại có hóa trị không đổi thành 2 phần bằng nhau. Phần 1: Hòa tan hoàn toàn bằng dung dịch HCl dư thu được 1,792 lít H2 (đktc). Phần 2: Nung trong không khí dư, thu được 2,84 gam hỗn hợp rắn chỉ gồm các oxit. Khối lượng hỗn hợp X là:
Đáp án : D Phương pháp giải :
+) nHCl = 2nH2=>nCl− +)2.nO2−(trong oxit) = 1.nCl−(trong muối ) Áp dụng định luật bảo toàn khối lượng cho phản ứng ở phần 2: moxit= mKL + mO=> mKL =>mX Lời giải chi tiết :
Nhận xét: Tổng số mol điện tích ion dương (của 2 kim loại) ở 2 phần là bằng nhau. Suy ra, tổng số mol điện tích ion âm ở 2 phần cũng bằng nhau. nH2(KTC)= 0,08 (mol) => nHCl = 2nH2= 0,16(mol)=>nCl− = 0,16 (mol) =>2.nO2−(trong oxit) = 1.nCl−(trong muối ) =>2.nO2−(trong oxit) = 1.0,16 => nO2−(trong oxit) = 0,08 (mol) Áp dụng định luật bảo toàn khối lượng cho phản ứng ở phần 2: moxit= mKL + mO=>2,84= mKL + 0,08.16=> mKL=1,56 (g) =>mX=2.1,56=3,12(g)
Câu 13 :
Trộn dung dịch chứa Ba2+ ; OH− 0,06 mol và Na+ 0,02 mol với dung dịch HCO3− 0,04 mol; CO32− 0,03 mol và Na+. Khối lượng kết tủa thu được sau khi trộn là:
Đáp án : A Phương pháp giải :
- Tính số mol Ba2+ BTDT:2nBa2++nNa+=nOH− - Tính nCO32− HCO−3 + OH− → CO32− + H2O => nCO32− - Tính nBaCO3 So sánh nCO32− và nBa2+ =>nBaCO3=> mBaCO3 Lời giải chi tiết :
- BTDT:2nBa2++nNa+=nOH− =>2.nBa2+ + 1.0,02 = 1.0,06 = >nBa2+ = 0,02(mol) − HCO−3 + OH− → CO32− + H2O => nCO32−=0,07 - nCO32− > nBa2+ nBaCO3=nBa2+=0,02mol =>mBaCO3↓ = 0,02.197 =3,94(g)
Câu 14 :
Dung dịch X chứa 0,025 mol CO32-; 0,1 mol Na+ ; 0,25 mol NH4+ và 0,3 mol Cl−. Cho 270 ml dung dịch Ba(OH)2 0,2 M vào và đun nhẹ (giả sử H2O bay hơi không đáng kể).Tổng khối lượng dung dịch X và dung dịch Ba(OH)2 sau quá trình phản ứng giảm đi là:
Đáp án : C Phương pháp giải :
- Khối lượng dung dịch giảm đi chính là khối lượng chất kết tủa và chất khí bay lên CO32−+Ba2+→BaCO3↓ NH4++OH−→NH3↑+H2O - Tính nBa(OH)2 và nNH3 => m giảm Lời giải chi tiết :
- Khối lượng dung dịch giảm đi chính là khối lượng chất kết tủa và chất khí bay lên nBa(OH)2= 0,27.0,2 = 0,054 (mol) −CO32−+Ba2+→BaCO3↓ NH4++OH−→NH3↑+H2O −mBaCO3+mNH3=0,025.197+0,108.17=6,761(g)
Câu 15 :
Dung dịch X chứa các ion: Fe3+ ; SO42 ; NH4+; Cl−. Chia dung dịch thành 2 phần bằng nhau: - Phần 1: Cho tác dụng với lượng dư dung dịch NaOH , đun nóng thu được 0,672 lít khí ở đktc và 1,07 gam kết tủa. - Phần 2: Tác dụng với lượng dư dung dịch BaCl2 thu được 4,66 gam kết tủa. Tổng khối lượng các muối khan thu được khi cô cạn dung dịch X là (quá trình cô cạn chỉ có nước bay hơi)
Đáp án : C Phương pháp giải :
- Tính số mol NH4+, nFe3+, nSO42− nNH4+=nNH3, nFe3+=nFe(OH)3, nSO42−=nBaSO4 - Tính số mol Cl- Bảo toàn điện tích: 3.nFe3++ 1.nNH+4= 2.nSO2−4+ 1.nCl− => nCl- - Tính khối lượng phần 1: Bảo toàn khối lượng trong 1 phần mFe3++ mNH+4 + mSO2−4+ mCl− => cô cạn dung dịch X thu được: mmuối = 2.m phần 1 Lời giải chi tiết :
- Phần 1: nNH3 = 0,03 mol; nFe(OH)3 = 0,01 mol => nFe3+ = 0,01 mol NH4+ + OH- → NH3 + H2O nNH4+ = nNH3 = 0,03 mol Phần 2: nBaSO4 = 0,02 mol => nSO4 = 0,02 mol - Bảo toàn điện tích: 3.nFe3++ 1.nNH+4= 2.nSO2−4+ 1.nCl− => 3.0,01 + 1.0,03 = 2.0,02 + nCl- => nCl- = 0,02 mol - Bảo toàn khối lượng (trong 1 phần) mFe3++ mNH+4 + mSO2−4+ mCl−=0,01.56+0,03.18+0,02.96+0,02.35,5=3,73gam => cô cạn dung dịch X thu được: mmuối = 2.3,73 = 7,46 gam
Câu 16 :
Cho 22,4 gam hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 gam kết tủa. Lọc tách kết tủa, cô cạn dung dịch thì thu được bao nhiêu gam muối clorua khan?
Đáp án : D Phương pháp giải :
- Muối thu được chứa: Na+; K+; Cl− - Tính nCl-, mK+ + mNa+ nCl−= 2nBa2+nBa2+=nBaCO3↓= nCO32− mhh=mNa++ mK+ + mCO32−=>mNa++mK+ - Tính mmuối clorua khan =>mmuối clorua=mNa++ mK+ + mCl− Lời giải chi tiết :
- Muối thu được chứa: Na+; K+; Cl− −nBaCO3↓= 0,2(mol) =>nBa2+= nCO32−= 0,2 (mol) =>nCl−= 2nBa2+= 0,4 (mol) −mhh=mNa++ mK+ + mCO32− =>mNa++mK+= 2,24−0,2.60 = 10,4 (g) =>mmuối clorua= 10,4+0,4.35,5 = 24,6 (g)
Câu 17 :
Cho hỗn hợp X gồm x mol FeS2 và y mol Cu2S tác dụng vừa đủ với HNO3 loãng, đun nóng thu được dung dịch chỉ chứa muối sunfat của các kim loại. Và giải phóng khí NO duy nhất. Mối liện hệ giữa x và y là:
Đáp án : B Phương pháp giải :
- Áp dụng bảo toàn nguyên tố → dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 2y; SO42-: (2x + y) mol - Áp dụng định luật bảo toàn điện tích : 3nFe3++2nCu2+=2nSO42− => Mối liên hệ giữa x và y Lời giải chi tiết :
- Áp dụng bảo toàn nguyên tố → dung dịch sau phản ứng chứa: Fe3+: x mol; Cu2+: 2y; SO42-: (2x + y) mol - Áp dụng định luật bảo toàn điện tích : 3nFe3++2nCu2+=2nSO42− => 3x + 2.2y = 2.(2x + y) → x = 2y
Câu 18 :
Dung dịch B chứa ba ion K+; Na+; PO43-. 1 lít dung dịch B tác dụng với CaCl2 dư thu được 31 gam kết tủa. Mặt khác nếu cô cạn 1 lít dung dịch B thu được 37,6 gam chất rắn khan. Nồng độ của 3 ion K+; Na+; PO43- lần lượt là:
Đáp án : C Phương pháp giải :
- Tính nồng độ PO43− nPO43−=2nCa3(PO4)2 => CM - Tính nNa+ và nK+ BTĐT:nK++nNa+=3nPO43−BTKL:mrankhan=mK++mNa++mPO43− => {n_{{K^ + }}}\, và \,\,{n_{N{a^ + }}} => CM Lời giải chi tiết :
-{n_{C{a_3}{{(P{O_4})}_2}}}{\text{ }} = {\text{ }}0,1{\text{ }}(mol){\text{ }} = > {\text{ }}{n_{P{O_4}^{3 - }}}{\text{ }} = {\text{ }}0,2{\text{ }}(mol){\text{ }} = > {\text{ }}{C_M}{\text{ }} = {\text{ }}0,2{\text{ }}M - Áp dụng BTĐT và BTKL ta có \left\{ \begin{gathered} {n_{{K^ + }}} + \,{n_{N{a^ + }}} = 3{n_{P{O_4}^{3 - }}} \hfill \\ m{\,_{ran\,khan}} = {m_{{K^ + }}} + {m_{N{a^ + }}} + {m_{P{O_4}^{3 - }}} \hfill \\ \end{gathered} \right. =>\left\{ {\begin{array}{*{20}{c}}{1.x + 1.y{\text{ }} = {\text{ }}3.0,2} \\ {39x + 23y + 95.0,2{\text{ }} = {\text{ }}37,6} \end{array}} \right.{\text{ }} = > {\text{ }}\left\{ {\begin{array}{*{20}{c}}{x{\text{ }} = {\text{ }}0,3{\text{ }} = {\text{ }}{n_{{K^ + }}} = > {\text{ }}{C_M} = {\text{ }}0,3{\text{ }}M} \\ {y{\text{ }} = {\text{ }}0,3{\text{ }} = {\text{ }}{n_{N{a^ + }}}{\text{ }} = >{\text{ }}{C_M} = {\text{ }}0,3{\text{ }}M} \end{array}} \right.
Câu 19 :
Phản ứng nào sau đây không phải là phản ứng trao đổi?
Đáp án : D Phương pháp giải :
Phản ứng trao đổi là phản ứng hóa học, trong đó các chất trao đổi cho nhau thành phần cấu tạo của nó mà không làm thay đổi số oxi hóa. Từ sự trao đổi này, tạo ra các sản phẩm mới. Lời giải chi tiết :
Phản ứng: 2FeCO3 + 4H2SO4 → Fe2(SO4)3 + SO2 + 2CO2+ 4H2O là phản ứng oxi hóa khử, không phải pư trao đổi, vì số oxi hóa của các nguyên tố trước và sau phản ứng thay đổi
Câu 20 :
Cặp chất nào sau đây không thể tồn tại trong một dung dịch?
Đáp án : D Phương pháp giải :
Điều kiện để các chất cùng tồn tại trong một dung dịch là chúng không được phản ứng với nhau. Lời giải chi tiết :
Ba(OH)2 và AlCl3 không thể cùng tồn tại trong một dung dịch vì chúng phản ứng với nhau: 3Ba(OH)2 + 2AlCl3 → 3BaCl2 + 2Al(OH)3↓
Câu 21 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
Đáp án : C Lời giải chi tiết :
Phản ứng trao đổi ion trong dung dịch các chất điện ly chỉ xảy ra khi có ít nhất một trong các điều kiện: tạo thành chất kết tủa, chất khí hoặc chất điện ly yếu. \to Phản ứng trao đổi ion trong dung dịch các chất điện ly chỉ xảy ra khi một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng
Câu 22 :
Phương trình ion rút gọn của phản ứng cho biết
Đáp án : C Lời giải chi tiết :
Phương trình ion thu gọn cho biết bản chất của phản ứng trong dung dịch các chất điện ly
Câu 23 :
Ion CO_3^{2 - } cùng tồn tại với các ion sau trong một dung dịch:
Đáp án : A Lời giải chi tiết :
Đáp án B: C{u^{2 + }} + CO_3^{2 - } \to CuC{{\text{O}}_3} M{g^{2 + }} + CO_3^{2 - } \to MgC{O_3} 2{\text{A}}{l^{3 + }} + 3CO_3^{2 - } + 3{H_2}O \to 2{\text{A}}l{(OH)_3} + 3C{O_2} Đáp án C: 2F{{\text{e}}^{3 + }} + 3CO_3^{2 - } + 3{H_2}O \to 2F{\text{e}}{(OH)_3} + 3C{O_2} Z{n^{2 + }} + CO_3^{2 - } \to ZnC{O_3} 2{\text{A}}{l^{3 + }} + 3CO_3^{2 - } + 3{H_2}O \to 2{\text{A}}l{(OH)_3} + 3C{O_2} Đáp án D: 2F{{\text{e}}^{3 + }} + 3CO_3^{2 - } + 3{H_2}O \to 2F{\text{e}}{(OH)_3} + 3C{O_2} CO_3^{2 - } + 2H{\text{S}}O_4^ - \to C{O_2} + {H_2}O + SO_4^{2 - }
Câu 24 :
Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
Đáp án : A Lời giải chi tiết :
B. AgNO3 + H2O + 3NH3 → NH4NO3 + (Ag(NH3)2)OH C. Na2ZnO2 + 2HCl → 2NaCl + Zn(OH)2 Nếu HCl dư : Zn(OH)2 + 2HCl → ZnCl2 + 2H2O D. NaHCO3 + NaHSO4 → H2O + Na2SO4 + CO2
Câu 25 :
Trong các dung dịch: HNO3, NaCl, Na2SO4, Ca(OH)2, KHSO4, Mg(NO3)2, có bao nhiêu chất tác dụng được với dung dịch Ba(HCO3)2?
Đáp án : A Lời giải chi tiết :
Các chất phản ứng: HNO3, Na2SO4, Ca(OH)2, KHSO4 2HN{O_3} + Ba{(HC{O_3})_2} \to Ba{(N{O_3})_2} + C{O_2} + {H_2}O N{a_2}S{O_4} + Ba{(HC{O_3})_2} \to BaS{O_4} + 2NaHC{O_3} Ca{(OH)_2} + Ba{(HC{O_3})_2} \to CaC{{\text{O}}_3} + BaC{{\text{O}}_3} + {H_2}O 2KH{\text{S}}{O_4} + Ba{(HC{O_3})_2} \to {K_2}S{O_4} + BaS{O_4} + C{O_2} + {H_2}O
Câu 26 :
Trộn các cặp dung dịch các chất sau với nhau: 1) NaHSO4 + NaHSO3 2) Na3PO4 + K2SO4 3) AgNO3 + Fe(NO3)2 4) C6H5ONa + H2O 5) CuS + HNO3 6) BaHPO4 + H3PO4 7) NH4Cl + NaNO2 (đun nóng) 8) Ca(HCO3)2 + NaOH 9) NaOH + Al(OH)3 10) MgSO4 + HCl. Số phản ứng xảy ra là
Đáp án : B Lời giải chi tiết :
Các phản ứng xảy ra: (1); (3); (7); (8); (9)
Câu 27 :
Cho dãy các chất: H2SO4,KOH, Ca(NO3)2, SO3, NaHSO4, Na2SO3, K2SO4. Số chất trong dãy tạo thành kết tủa khi phản ứng với dung dịch BaCl2 là
Đáp án : D Lời giải chi tiết :
Các phản ứng tạo kết tủa: H2SO4 + BaCl2 → BaSO4↓ + 2 HCl H2O + SO3 + BaCl2 → BaSO4↓ + 2 HCl NaHSO4 + BaCl2 → BaSO4↓ + NaCl + HCl Na2SO3 + BaCl2 → BaSO3↓ + 2 NaCl K2SO4 + BaCl2 → BaSO4 ↓ + 2 KCl
Câu 28 :
Phương trình phân tử: BaHPO4 + H2SO4 →BaSO4 ↓+ H3PO4 tương ứng với phương trình ion thu gọn nào sau đây?
Đáp án : B Lời giải chi tiết :
Phương trình ion đầy đủ: B{a^{2 + }} + HPO_4^{2 - } + 2{H^ + } + SO_4^{2 - } \to BaS{O_4} + {H_3}P{O_4} Phương trình ion thu gọn: B{a^{2 + }} + HPO_4^{2 - } + 2{H^ + } + SO_4^{2 - } \to BaS{O_4} + {H_3}P{O_4}
Câu 29 :
Dung dịch NaHSO4 tác dụng được với tất cá các chất có trong nhóm nào sau đây?
Đáp án : C Lời giải chi tiết :
A. NaHSO4 không phản ứng với AlCl3; NaNO3 B. NaHSO4 không phản ứng với FeCl3, Fe(NO3)3 , KCl. C. Tất cả các chất đều phản ứng với NaHSO4 D. NaHSO4 không phản ứng với NaNO3, FeCl2
Câu 30 :
Cho sơ đồ sau: X + Y → CaCO3 + BaCO3 + H2O X,Y có thể là
Đáp án : B Lời giải chi tiết :
A. không có phản ứng B. Ba(OH)2 + Ca(HCO3)2 → CaCO3 + BaCO3 +2 H2O C. Ba{(OH)_2} + C{O_2} \to BaC{{\text{O}}_3} + {H_2}O Hoặc Ba{(OH)_2} + C{O_2} \to Ba{(HC{O_3})_2} D. không có phản ứng
Câu 31 :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
Đáp án : B Lời giải chi tiết :
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
Câu 32 :
Dung dịch nào sau đây không tác dụng với dung dịch HCl loãng?
Đáp án : A Phương pháp giải :
Điều kiện xảy ra phản ứng trao đổi: Phản ứng trao đổi xảy ra khi thỏa mãn ít nhất 1 trong 3 điều kiện sau: 1. Tạo chất khí 2. Tạo kết tủa 3. Tạo chất điện li yếu Lời giải chi tiết :
A. KNO3 không phản ứng vì không thỏa mãn điều kiện của phản ứng trao đổi. B. AgNO3 có phản ứng vì tạo kết tủa (AgCl). C. NaOH có phản ứng vì tạo chất điện li yếu (H2O). D. Na2CO3 có phản ứng vì tạo ra khí (CO2).
Câu 33 :
Một dung dịch chứa x mol Na+, y mol Ca2+, z mol HCO3-, t mol Cl-. Hệ thức quan hệ giữa x, y , z, t được xác định là:
Đáp án : D Phương pháp giải :
Áp dụng định luật bảo toàn điện tích. Lời giải chi tiết :
Áp dụng định luật bảo toàn điện tích trong một dung dịch ta có: n (+) = n (-) => {n_{N{a^ + }}} + 2{n_{C{a^{2 + }}}} = {n_{HCO_3^ - }} + {n_{C{l^ - }}} => x + 2y = z + t
Câu 34 :
Thể tích (ml) của dung dịch NaOH 0,3M cần để trung hòa 3 lít dung dịch HCl 0,01M là
Đáp án : D Phương pháp giải :
Tính theo PTHH: NaOH + HCl → NaCl + H2O Lời giải chi tiết :
nHCl = 3.0,01 = 0,03 mol PTHH: NaOH + HCl → NaCl + H2O nNaOH = nHCl = 0,03 mol => V dd NaOH = n : CM = 0,03 : 0,3 = 0,1 lít = 100 ml
Câu 35 :
Cặp chất nào sau đây tác dụng với nhau tạo ra sản phẩm đều là chất khí?
Đáp án : D Lời giải chi tiết :
Ta có: C + H2O → CO + H2 hoặc C + 2H2O → CO2 + 2H2 => Sản phẩm đều là chất khí
Câu 36 :
Phương trình hóa học nào viết sai so với phản ứng xảy ra?
Đáp án : A Phương pháp giải :
Một phản ứng trao đổi xảy ra khi thỏa mãn ít nhất 1 trong số các điều kiện sau: + Tạo chất khí + Tạo chất kết tủa + Tạo chất điện li yếu (Trong đó các chất sau phản ứng không phản ứng được với nhau) Lời giải chi tiết :
Phản ứng A không xảy ra do CaCO3 lại tan được trong HCl
Câu 37 :
Cho phản ứng NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
Đáp án : C Phương pháp giải :
Nắm được cách chuyển đổi từ phương trình phân tử sang phương trình ion rút gọn Lời giải chi tiết :
Phương trình ion rút gọn của phản ứng NaOH + HCl → NaCl + H2O là: OH- + H+ → H2O A. 2OH- + Fe2+ → Fe(OH)2 B. OH- + NH4+ → NH3 + H2O C. OH- + H+ → H2O D. OH- + HCO3- → CO32- + H2O
Câu 38 :
Trung hòa 10 ml dung dịch HCl 1M cần 20 ml dung dịch KOH nồng độ a mol/l. Giá trị của a là
Đáp án : A Phương pháp giải :
Từ nHCl → nH+ H+ + OH- → H2O → nOH- Lời giải chi tiết :
nHCl = 0,01 mol → nH+ H+ + OH- → H2O → nOH- = → nH+ = 0,01 mol → a = 0,01 : 0,02 = 0,5M
Câu 39 :
Cần thêm ít nhất bao nhiêu lít NH3 (đktc) vào 250 ml dung dịch Al2(SO4)3 0,2M để làm kết tủa hoàn toàn ion nhôm dưới dạng Al(OH)3.
Đáp án : D Phương pháp giải :
Tính theo PTHH: 6NH3 + 6H2O + Al2(SO4)3 → 2Al(OH)3 + 3(NH4)2SO4 Lời giải chi tiết :
6NH3 + 6H2O + Al2(SO4)3 → 2Al(OH)3 + 3(NH4)2SO4 0,3 mol ← 0,05 mol → VNH3 = 0,3 .22,4 = 6,72 lít
Câu 40 :
Dung dịch X được tạo ra từ 2 muối chứa đồng thời các ion: Al3+, Fe2+, Cl-, SO42-. Cho dung dịch BaCl2 dư vào dung dịch chứa 200 ml dung dịch X thu được 13,98 gam kết tủa. Mặt khác, cho dung dịch Ba(OH)2 đến dư vào 200 ml dung dịch X thu được 21,18 gam kết tủa. Nồng độ mol/l của Cl- là?
Đáp án : D Phương pháp giải :
200 ml X + BaCl2 có Ba2+ + SO42-→ BaSO4 nBaSO4 → nSO42- 200 ml X + Ba(OH)2 thì Ba2+ + SO42-→ BaSO4 Fe2+ + 2OH- → Fe(OH)2 → mkết tủa = mBaSO4 + mFe(OH)2 → mFe(OH)2 → mFe(OH)2 → nFe(OH)2 → nFe2+ So sánh số mol Fe2+ và SO42- Nếu số mol 2 ion bằng nhau thì có muối FeSO4 và muối còn lại AlCl3 Nếu số mol 2 ion khác nhau thì có muối FeCl2 và Al2(SO4)3 Lời giải chi tiết :
*Cho 200 ml X tác dụng với BaCl2 dư: nBaSO4 = 0,06 mol Ba2+ + SO42-→ BaSO4 0,06 ← 0,06 *200 ml X tác dụng với Ba(OH)2 dư: Ba2+ + SO42-→ BaSO4 Fe2+ + 2OH- → Fe(OH)2 → mkết tủa = mBaSO4 + mFe(OH)2 → 0,06.233 + mFe(OH)2 = 21,18 → mFe(OH)2 = 7,2 gam → nFe(OH)2 = 0,08 mol → nFe2+ = 0,08 mol Vì số mol Fe2+ và số mol SO42- khác nhau nên muối ban đầu cho vào X không có FeSO4 → 2 muối là FeCl2 và Al2(SO4)3 → nCl-= 2nFe2+ = 2.0,08 = 0,16 mol → [Cl-] = 0,16 : 0,2 = 0,8M
Câu 41 :
Nhỏ từ từ 0,125 lít dung dịch Ba(OH)2 1M vào dung dịch gồm 0,024 mol FeCl3; 0,016 mol Al2(SO4)3 và 0,04 mol H2SO4 thu được m gam kết tủa. Tính giá trị m?
Đáp án : C Phương pháp giải :
Các phản ứng giữa các ion: OH- + H+ → H2O Fe3+ + 3OH- → Fe(OH)3 Al3+ + 3OH- → Al(OH)3 → nếu nOH- dư → Al(OH)3 hòa tan một phần OH- + Al(OH)3 → AlO2- + 2H2O Ba2+ +SO42- → BaSO4 Lời giải chi tiết :
Ta có: nBa(OH)2 = 0,125 mol → Ba2+: 0,125 mol và OH-: 0,25 mol Dung dịch còn lại có Fe3+: 0,024 mol; Al3+: 0,032 mol; SO42-: 0,088 mol; Cl-: 0,072 mol và H+: 0,08 mol Khi nhỏ từ từ Ba(OH)2 vào thì OH- + H+ → H2O 0,08 ← 0,08 Fe3+ + 3OH- → Fe(OH)3 0,024 → 0,072 → 0,072 Al3+ + 3OH- → Al(OH)3 0,032 → 0,096 → 0,032 → nOH- dư = 0,25 - 0,08 - 0,072 - 0,096 = 0,002 mol → Al(OH)3 hòa tan một phần OH- + Al(OH)3 → AlO2- + 2H2O 0,002 → 0,002 mol Ba2+ + SO42- → BaSO4 0,088 ← 0,088 → 0,088 → Kết tủa tạo ra có 0,024 mol Fe(OH)3; 0,03 mol Al(OH)3 và 0,088 mol BaSO4 → m = 25,412 gam
Câu 42 :
Cho 7,65 gam hỗn hợp Al và Mg tan hoàn toàn trong 500 ml dung dịch HCl 1,04M và H2SO4 0,28M, thu được dung dịch X và khí H2. Cho 850 ml dung dịch NaOH 1M vào X, sau khi các phản ứng xảy ra hoàn toàn thu được 16,5 gam kết tủa gồm 2 chất. Mặt khác cho từ từ dung dịch hỗn hợp KOH 0,8M và Ba(OH)2 0,1M vào X đến khi thu được lượng kết tủa lớn nhất, lọc kết tủa đem nung đến khối lượng không đổi, thu được m gam chất rắn. Giá trị của m gần nhất với giá trị nào sau đây?
Đáp án : B Phương pháp giải :
- Đặt n Al là x mol; n Mg là y mol - Biện luận OH- có tham gia phản ứng hòa tan Al(OH)3 - Gọi n OH- có tham gia phản ứng hòa tan Al(OH)3 là z * Áp dung BTDT, BTKL lập hệ tìm ra x,y,z Đặt V dung dịch chứa KOH, Ba(OH)2 là a lít *Khi cho dung dịch chứa 0,8a mol KOH, 0,1a mol Ba(OH)2 vào dung dịch X để thu được lượng kết tủa lớn nhất: Trường hợp 1: Kết tủa là Al(OH)3 cực đại, Mg(OH)2, BaSO4 Trường hợp 2: Kết tủa là BaSO4 cực đại, Mg(OH)2 Ta tính lượng kết tủa thu được trong 2 trường hợp để tìm ra trường hợp kết tủa cực đại. Từ đó tính được khối lượng chất rắn thu được sau khi nung đến khối lượng không đổi. Lời giải chi tiết :
Đặt số mol Al là x mol; số mol Mg là y mol Ta có: nHCl = 0,52 mol; nH2SO4 = 0,14 mol Dung dịch X chứa {Al3+ (x mol); Mg2+ (y mol); H+ dư (0,8-3x-2y mol); Cl-, SO42-} *Khi cho 0,85 mol NaOH vào dung dịch X: Đặt nAl(OH)3 (4)= z mol Ta thấy: +) nH+ dư + 3nAl3+ + 2nMg2+ = (0,8-3x-2y) + 3x + 2y = 0,8 mol +) nOH- = 0,85 mol => nOH- > nH+ dư + 3nAl3+ + 2nMg2+ => OH- dư, đã có sự hòa tan Al(OH)3 OH- + H+ → H2O (1) (0,8-3x-2y) (0,8-3x-2y) mol 3OH- + Al3+ → Al(OH)3 ↓ (2) 3x ← x x mol 2OH-+ Mg2+ → Mg(OH)2 (3) 2y ← y y mol Al(OH)3 + OH- → Al(OH)3 (4) z → z mol Kết tủa thu được sau phản ứng có y mol Mg(OH)2 và (x-z) mol Al(OH)3 Ta có hệ: (1) m hh = 27x + 24y = 7,65 (2) m kết tủa = 58y + 78(x - z) = 16,5 (3) nOH-= 0,8 - 3x - 2y + 3x + 2y + z = 0,85 mol Giải hệ trên ta có: x = 0,15; y =0,15 và z = 0,05 mol Vậy dung dịch X có chứa 0,05 mol H+, 0,15 mol Al3+, 0,15 mol Mg2+, 0,14 mol SO42-, 0,52 mol Cl- Đặt thể tích dung dịch chứa KOH, Ba(OH)2 là a lít *Khi cho dung dịch chứa 0,8a mol KOH, 0,1a mol Ba(OH)2 vào dung dịch X để thu được lượng kết tủa lớn nhất: - Trường hợp 1: Kết tủa là Al(OH)3 cực đại, Mg(OH)2, BaSO4 OH- + H+ → H2O (5) 3OH-+ Al3+ → Al(OH)3 ↓ (6) 2OH-+ Mg2+ → Mg(OH)2 ↓ (7) → nOH-= 0,05 + 3.0,15 + 2.0,15 = 0,8 mol → 0,8a + 2.0,1a = 0,8 mol → a = 0,8 lít → nBa(OH)2 = 0,1a = 0,08 mol Ba2+ + SO42- → BaSO4↓ 0,08 0,14 0,08 mol → mkết tủa = mBaSO4 + mAl(OH)3 + mMg(OH)2 = 0,08.233 + 0,15.78 + 0,15.58 = 39,04 gam Khi nung kết tủa đến khối lượng không đổi thu được: BaSO4, Al2O3 và MgO → mchất rắn = mAl2O3 + mMgO + mBaSO4 = 0,075.102 + 0,15.40 + 0,08.233 = 32,29 gam Trường hợp 2: Kết tủa là BaSO4 cực đại, Mg(OH)2 → nBa2+ max = nSO4(2-) = 0,14 mol → 0,1a = 0,14 → a =1,4 → nOH- = 0,8a + 2.0,1a = a =1,4 mol Khi đó Al(OH)3 tan hết. Kết tủa thu được có 0,14 mol BaSO4 và 0,15 mol Mg(OH)2 → mkết tủa = 0,14.233 + 0,15.58 = 41,32 gam > 39,04 gam Do đó ta chọn trường hợp 2 sẽ cho khối lượng kết tủa cực đại Khi đó: mchất rắn = mBaSO4 + mMgO = 0,14.233 + 0,15.40 = 38,62 gam Vậy giá trị của m gần nhất với giá trị 38,6
Câu 43 :
Dung dịch X gồm 0,25 mol Ba2+; 1,3 mol Na+; a mol OH- và b mol Cl-. Cho 400 ml dung dịch Y gồm H2SO4 0,25M; HCl 0,25M và ZnSO4 1M vào dung dịch X. Sau khi các phản ứng kết thúc, thu được kết tủa G. Nung toàn bộ G đến khối lượng không đổi thu được 69,59 gam chất rắn H. Giá trị của b là:
Đáp án : D Phương pháp giải :
Áp dụng định luật bảo toàn điện tích dung dịch X. Xét Y: {{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}}}{\rm{ = 0,5 mol}};{\rm{ }}{{\rm{n}}_{{H^{\rm{ + }}}}}{\rm{ = 0,3 mol; }}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}}{\rm{ = 0,4 mol;}} Khi cho X + Y => {{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}{{\rm{n}}_{B{a^{{\rm{2 + }}}}}}{\rm{ = 0,25 mol}} Sau khi nung thu được H. ta có: {{\rm{m}}_{\rm{H}}}{\rm{ = }}{{\rm{m}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ + }}{{\rm{m}}_{{\rm{ZnO}}}} \Rightarrow {{\rm{n}}_{{\rm{ZnO}}}} = {{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,14 mol}} Xét 2 trường hợp : Trường hợp 1: Tạo kết tủa và kết tủa không tan Trường hợp 2: Kết tủa tan một phần Lời giải chi tiết :
Xét X: Theo ĐLBTĐT ta có: 0,25.2 + 1,3 = a + b = 1,8 mol Xét Y: {{\rm{n}}_{{\rm{S}}{{\rm{O}}_{\rm{4}}}^{{\rm{2 - }}}}}{\rm{ = 0,5 mol}};{\rm{ }}{{\rm{n}}_{{H^{\rm{ + }}}}}{\rm{ = 0,3 mol; }}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}}{\rm{ = 0,4 mol;}} Khi cho X + Y => {{\rm{n}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ = }}{{\rm{n}}_{B{a^{{\rm{2 + }}}}}}{\rm{ = 0,25 mol}} Sau khi nung thu được H. ta có: {{\rm{m}}_{\rm{H}}}{\rm{ = }}{{\rm{m}}_{{\rm{BaS}}{{\rm{O}}_{\rm{4}}}}}{\rm{ + }}{{\rm{m}}_{{\rm{ZnO}}}} \Rightarrow {{\rm{n}}_{{\rm{ZnO}}}} = {{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,14 mol}} Trường hợp 1: Tạo kết tủa và kết tủa không tan => OH- hết \Rightarrow a = {{\rm{n}}_{{H^ + }}}{\rm{ + 2}}{{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 0,58 mol; b = 1,22 mol}} Trường hợp 2: Kết tủa tan một phần \Rightarrow a = {{\rm{n}}_{{H^ + }}}{\rm{ + 4}}{{\rm{n}}_{{\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}}} - {\rm{2}}{{\rm{n}}_{{\rm{Zn(OH}}{{\rm{)}}_{\rm{2}}}}}{\rm{ = 1,62 mol; b = 0,18 mol}}
Câu 44 :
Dung dịch X gồm NaOH 0,2M và Ba(OH)2 0,05M. Dung dịch Y gồm Al2(SO4)3 0,4M và H2SO4 xM. Trộn 0,1 lít dung dịch Y với 1 lít dung dịch X thu được 16,33 gam kết tủa. Giá trị của x là:
Đáp án : B Phương pháp giải :
Tính được n BaSO4 => nAl(OH)3 => Trong dung dịch còn Al3+ nên có 2 trường hợp xảy ra: TH1: Kết tủa không bị hòa tan TH2: Kết tủa bị hòa tan 1 phần Khi đó ta tìm được hai giá trị của x. Lời giải chi tiết :
nNaOH = 0,2 mol ; nBa(OH)2 = 0,05 mol; nOH- = 0,3 mol nAl2(SO4)3 = 0,04 mol; nH2SO4 = 0,1.x mol; nH+ = 0,2x mol H+ + OH- → H2O 0,2x 0,2x mol Ba2+ + SO42- → BaSO4 0,05 0,12 0,05 Suy ra nAl(OH)3 = 0,06 mol < nAl3+ nên có 2 trường hợp xảy ra: TH1: Kết tủa không bị hòa tan Al3+ + 3OH- → Al(OH)3 0,08 0,18← 0,06 mol nOH- tổng = 0,22x + 0,18 = 0,3 suy ra x = 0,6M TH2: Kết tủa bị hòa tan 1 phần Al3+ + 3OH- → Al(OH)3 0,08 0,24 0,08 Al(OH)3 + OH- → AlO2- + 2H2O 0,02 0,02 nOH- tổng = 0,2x + 0,24 + 0,02 = 0,3 suy ra x = 0,2 M
Câu 45 :
Dung dịch X chứa các cation gồm Mg2+, Ba2+, Ca2+ và các anion gồm Cl- và NO3-. Thêm từ từ 250 ml dung dịch Na2CO3 1M vào dung dịch X thì thu được lượng kết tủa lớn nhất. Tổng số mol các anion có trong dung dịch X là:
Đáp án : D Phương pháp giải :
Viết các PTHH xảy ra và áp dụng định luật bảo toàn điện tích để tìm tổng số mol các anion trong X. Lời giải chi tiết :
Mg2+ + CO32- → MgCO3 Ba2+ + CO32- → BaCO3 Ca2+ + CO32- → CaCO3 Ta có: nMg2+ + nBa2+ + nCa2+ = nCO3 2- = nNa2CO3= 0,25 mol Áp dụng định luật bảo toàn điện tích với dung dịch X ta có: 2. (nMg2+ + nBa2+ + nCa2+)= nCl- + nNO3- → nCl- + nNO3- = 0,5 mol
Câu 46 :
Trộn lẫn hỗn hợp các ion sau: (I) K+, CO32-, S2- với H+, Cl-, NO3- (II) Na+, Ba2+, OH- với H+, Cl-, SO42- (III) NH4+, H+, SO42- với Na+, Ba2+, OH- (IV) H+, Fe2+, SO42- với Ba2+, K+, OH- (V) K+, Na+, HSO3- với Ba2+, Ca2+, OH- (VI) Cu2+, Zn2+, Cl- với K+, Na+, OH- Trường hợp có thể xảy ra 3 phản ứng là :
Đáp án : B Phương pháp giải :
Dựa vào điều kiện phản ứng xảy ra trong dung dịch để tìm các trường hợp xảy ra phản ứng, chú ý một số hiđroxit lưỡng tính. Lời giải chi tiết :
(III) NH4+, H+, SO42- với Na+, Ba2+, OH- H+ + OH- → H2O Ba2+ + SO42- → BaSO4 NH4+ + OH- → NH3 + H2O (IV) H+, Fe2+, SO42- với Ba2+, K+, OH- H+ + OH- → H2O Ba2+ + SO42- → BaSO4 Fe2+ + 2OH- → Fe(OH)2 (V) K+, Na+, HSO3- với Ba2+, Ca2+, OH- HSO3- + OH- → SO32- + H2O Ba2+ + SO32- → BaSO3 Ca2+ + SO32- → CaSO3 (VI) Cu2+, Zn2+, Cl- với K+, Na+, OH- Cu2+ + 2OH- → Cu(OH)2 Zn2+ + 2OH- → Zn(OH)2 Zn(OH)2 + 2OH- → ZnO22- + 2H2O
Câu 47 :
Có 2 dung dịch chứa 2 cation và 2 anion không trùng nhau trong các ion sau: K+ (0,15 mol), Mg2+ (0,1 mol), NH4+ (0,25 mol), H+ (0,25 mol), Cl- (0,1 mol), SO42- (0,075 mol), NO3- (0,25 mol), CO32- (0,15 mol). Một trong 2 dung dịch trên chứa các ion nào dưới đây?
Đáp án : B Phương pháp giải :
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn điện tích được thỏa mãn. Lời giải chi tiết :
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn điện tích được thỏa mãn. - Xét đáp án A: Tổng số mol điện tích dương không bằng tổng số mol điện tích âm nên không tồn tại dung dịch này. - Xét đáp án B: Dung dịch tồn tại vì các ion không phản ứng với nhau và định luật bảo toàn điện tích được thỏa mãn. - Xét đáp án C: Tổng số mol điện tích dương không bằng tổng số mol điện tích âm nên không tồn tại dung dịch này. - Xét đáp án D: Tổng số mol điện tích dương không bằng tổng số mol điện tích âm nên không tồn tại dung dịch này.
Câu 48 :
Cho dãy các ion sau: (a) H+, Fe3+, NO3-, SO42- (b) Ag+, Na+, NO3-, Cl- (c) Al3+, NH4+, Br-+, OH- (d) Mg2+, K+, SO42-, PO43- (e) K+, HPO42-, Na+, OH- (g) Fe2+, Na+, HSO4-, NO3- (h) Ag+, NH4+, SO42-, I- (i) Mg2+, Na+, SO42- Số dãy gồm các ion cùng tồn tại trong 1 dung dịch là:
Đáp án : A Phương pháp giải :
Các ion cùng tồn tại trong 1 dung dịch là các ion không phản ứng với nhau tạo chất kết tủa, chất khí hoặc chất điện li yếu. Lời giải chi tiết :
(a) Các ion không phản ứng với nhau tạo chất kết tủa, chất khí hoặc chất điện li yếu nên các ion này cùng tồn tại trong 1 dung dịch. (b) Ag+ + Cl- → AgCl ↓ nên các ion không cùng tồn tại trong 1 dung dịch. (c) NH4+ + OH- → NH3 ↑ + H2O nên các ion không cùng tồn tại trong 1 dung dịch. (d) 3Mg2+ + 2PO43- → Mg3(PO4)2 ↓ nên các ion không cùng tồn tại trong 1 dung dịch. (e) HPO42- + OH- → PO43- + H2O nên các ion không cùng tồn tại trong 1 dung dịch. (g) 4HSO4- + NO3- + 3Fe2+ → 3Fe3+ + 4SO42- + NO + 2H2O nên các ion không cùng tồn tại trong 1 dung dịch. (h) Ag+ + I- → AgI↓ nên các ion không cùng tồn tại trong 1 dung dịch. (i) Các ion không phản ứng với nhau tạo chất kết tủa, chất khí hoặc chất điện li yếu nên các ion này cùng tồn tại trong 1 dung dịch. Vậy các ion cùng tồn tại trong 1 dung dịch là: (a), (i) (Có 2 dãy thỏa mãn).
Câu 49 :
Trộn 150 ml dung dịch MgCl2 0,5M với 50 ml dung dịch NaCl 1M thì nồng độ ion Cl- trong dung dịch mới là
Đáp án : C Phương pháp giải :
MgCl2 và NaCl là các chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion: MgCl2 → Mg2+ + 2Cl- NaCl → Na+ + Cl- Lời giải chi tiết :
nMgCl2 = 0,15.0,5 = 0,075 mol; nNaCl = 0,05.1 = 0,05 mol MgCl2 và NaCl là các chất điện li mạnh, khi hòa tan vào nước phân li hoàn toàn thành các ion: MgCl2 → Mg2+ + 2Cl- 0,075 → 0,15 (mol) NaCl → Na+ + Cl- 0,05 → 0,05 (mol) => nCl- = 0,15 + 0,05 = 0,2 mol => [Cl-] = n : V = 0,2 : (0,15 + 0,05) = 1M
Câu 50 :
Cho các ion sau : K+( 0,15 mol) ; Fe2+(0,1 mol) ; NH4+(0,2mol) ; H+(0,2 mol) ; Cl-(0,1 mol); SO42-(0,15 mol) ; NO3-(0,05 mol) ; CO32-(0,15 mol). Có 2 dung dịch mỗi dung dịch chứa 2 cation và 2 anion trong các ion trên không trùng nhau. 2 dung dịch đó là :
Đáp án : A Lời giải chi tiết :
H+ và CO32- không thể cùng tồn tại trong cùng một dung dịch Tương tự với Fe2+ ; H+ ; NO3- cũng không thể cùng tồn tại trong một dung dịch H+ + CO32- → HCO3- 3Fe2+ + 4H+ + NO3- → 3Fe3+ NO + 2H2O
Câu 51 :
Hỗn hợp X gồm Na và Ba có tỉ lệ mol 1 : 1. Hòa tan một lượng X vào nước được 3,36 lít H2 (đktc) và dung dịch Y. Cho 4,48 lít CO2 hấp thụ hết vào dung dịch Y thì thu được m gam kết tủa. Giá trị của m là:
Đáp án : C Phương pháp giải :
- Tính được nNa , nBa => nOH- - Từ n OH-, n CO2 => Sau phản ứng tạo ra cả 2 muối axit và trung hòa (Viết phương trình ion thu gọn) - Gọi n HCO3-, n CO32- lần lượt là b, a mol => a, b => Khối lượng kết tủa Lời giải chi tiết :
Đặt số mol mỗi kim loại là x (mol). Na + H2O → NaOH + ½ H2 x → x → 0,5x Ba + 2H2O → Ba(OH)2 + H2 x → x → x => nH2 = 0,5x + x = 0,15 => x = 0,1 mol => nOH- = x + 2x = 0,3 mol *Hấp thụ 0,2 mol CO2 vào {0,3 mol OH-; 0,1 mol Ba2+; Na+}: Ta thấy: nOH- : nCO2 = 0,3 : 0,2 = 1,5 => Phản ứng tạo CO32- (a mol) và HCO3- (b mol) CO2 + 2OH- → CO32- + H2O CO2 + OH- → HCO3- + nCO2 = nCO32- + nHCO3- => a + b = 0,2 (1) + nOH- = 2nCO32- + nHCO3- => 2a + b = 0,3 (2) Giải hệ (1) và (2) được a = b = 0,1 Ta thấy: nBa2+ (0,1 mol) = nCO32- (0,1 mol) => nBaCO3 = 0,1 mol => mBaCO3 = 0,1.197 = 19,7g
Câu 52 :
Hòa tan hoàn toàn hỗn hợp X gồm 0,12 mol FeS2 và a mol Cu2S vào dung dịch HNO3 đặc (đủ) sau phản ứng thu được dung dịch A chỉ chứa muối sunfat và khí NO2. Giá trị của a là:
Đáp án : B Phương pháp giải :
Bảo toàn điện tích. Lời giải chi tiết :
Dung dịch sau phản ứng gồm Fe3+ ; Cu2+ ; SO42- Bảo toàn điện tích: 3{{n}_{F{{e}^{3+}}}}+\text{ }2{{n}_{C{{u}^{2+}}}}=2{{n}_{S{{O}_{4}}^{2-}}} => 3.0,12 + 2.2a = 2.(2.0,12 + a) => a = 0,06 mol
Câu 53 :
Cho dung dịch KOH 1 M tới dư vào dung dịch X sau phản ứng thu được kết tủa. Dung dịch X có thể chứa đồng thời các chất
Đáp án : C Lời giải chi tiết :
- Vì Zn(OH)2 và Al(OH)3 đều tan trong KOH nên loại A, B, D. - Cu(OH)2 không tan trong KOH nên thỏa mãn đề bài
Câu 54 :
Các dung dịch riêng biệt: Na2CO3, BaCl2, MgCl2, H2SO4, NaOH được đánh số ngẫu nhiên (1), (2), (3), (4), (5). Tiến hành một số thí nghiệm, kết quả được ghi lại trong bảng sau:
Các dung dịch (1), (3), (5) lần lượt là
Đáp án : A Phương pháp giải :
Bước 1: Đọc đề bài và các đáp án xác định các khả năng loại trừ, loại đáp án nhiễu Lời giải chi tiết :
(1) không phản ứng với (5) ⟹ B ; C ; D loại. Chất (2) tạo kết tủa 2 lần + tạo khí 1 lần nên (2) là Na2CO3 Chất (1) tạo khí với chất (2) —> (1) là H2SO4 Chất (4) tạo kết tủa với (1) và (2) —> (4) là BaCl2 Chất (5) tạo kết tủa với (2) —> (5) là MgCl2 —> Còn lại (3) là NaOH (1) không phản ứng với (5) ⟹ B ; C ; D loại. Các dung dịch (1), (3), (5) lần lượt là H2SO4, NaOH, MgCl2.
Câu 55 :
Thực hiện các thí nghiệm sau: (a) Cho dung dịch Ba(HCO3)2 vào dung dịch NaHSO4. (b) Cho Na vào dung dịch FeCl2 dư. (c) Cho dung dịch (NH4)2SO4 vào dung dịch Ba(OH)2. (d) Sục khí CO2 dư vào dung dịch hỗn hợp NaOH và Ba(OH)2. (e) Cho dung dịch AgNO3 vào dung dịch Fe(NO3)2. Sau khi các phản ứng kết thúc, số thí nghiệm thu được cả kết tủa và khí là
Đáp án : C Phương pháp giải :
Viết các PTHH, xác định số thí nghiệm sau phản ứng thu được kết tủa và khí.
Lời giải chi tiết :
(a) Ba(HCO3)2 + 2NaHSO4 → BaSO4↓+ Na2SO4 + 2H2O + 2CO2 ↑ (b) 2Na + 2H2O → 2NaOH + H2↑ FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl (c) (NH4)2SO4 + Ba(OH)2 → BaSO4↓ + 2NH3↑ + 2H2O (d) CO2 dư nên không thu được kết tủa. (e) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag↓ Vậy có 3 phản ứng vừa thu được khí và kết tủa là (a), (b), (c).
|