Trắc nghiệm Bài 31. Phản ứng cộng của ankin - Hóa 11Đề bài
Câu 1 :
Cho etin phản ứng với dung dịch brom dư thu được sản phẩm là
Câu 2 :
Cho propin qua nước có HgSO4 ở 80oC tạo ra sản phẩm là
Câu 3 :
Cho hỗn hợp but-1-in và hiđro dư qua xúc tác Pd/PbCO3 đun nóng, sản phẩm tạo ra là
Câu 4 :
Cho phản ứng C2H2 + H2O → A. Chất A là
Câu 5 :
Cho propen, propin, đivinyl tác dụng với HCl (tỉ lệ 1 : 1), số sản phẩm thu được lần lượt là
Câu 6 :
Khi cho brom hóa hoàn toàn 0,3 mol hỗn hợp gồm một ankin và một anken cần vừa đủ 0,4 mol Br2. Thành phần phần trăm về số mol của ankin trong hỗn hợp là:
Câu 7 :
Hỗn hợp X gồm một ankan và một ankin. Cho hỗn hợp X qua dung dịch Br2 dư thấy thể tích hỗn hợp giảm đi một nửa. Tính thể tích O2 (đktc) cần dùng để đốt cháy hết 3,5 gam hỗn hợp X?
Câu 8 :
Cho 28,2 gam hỗn hợp X gồm 3 ankin đồng đẳng kế tiếp qua một lượng dư H2 (to, Ni) để phản ứng xảy ra hoàn toàn. Sau phản ứng thể tích thể tích khí H2 giảm 26,88 lít (đktc). CTPT của 3 ankin là
Câu 9 :
Hỗn hợp X gồm 3 khí C3H4, C2H2 và H2 cho vào bình kín dung tích 8,96 lít (đktc) chứa bột Ni, nung nóng bình một thời gian thu được hỗn hợp khí Y. Biết tỉ khối của X so với Y là 0,75. Số mol H2 tham gia phản ứng là:
Câu 10 :
Hỗn hợp X gồm ankin B và H2 có tỉ khối hơi so với CH4 là 0,6. Nung X với Ni xúc tác để phản ứng xảy ra hoàn toàn thu được hỗn hợp Y có tỉ khối hơi so với CH4 là 1. Cho Y qua dung dịch Br2 dư thì khối lượng bình đựng sẽ:
Câu 11 :
Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là
Câu 12 :
Hỗn hợp X gồm 0,1 mol C2H2, 0,15 mol C2H4, 0,2 mol C2H6 và 0,3 mol H2. Đun nóng với Ni xúc tác một thời gian thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được số gam CO2 và H2O lần lượt là:
Câu 13 :
Đun nóng m gam hỗn hợp X gồm C2H2, C2H4, Và H2 với xúc tác Ni đến phản ứng xảy ra hoàn toàn, thu được 8,96 lít (đktc) hỗn hợp Y (có tỉ khối so với H2 bằng 8). Đốt cháy hoàn toàn cùng lượng hỗn hợp X trên, rồi cho sản phẩm cháy hấp thụ hoàn toàn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa tạo thành là
Câu 14 :
Hỗn hợp X gồm C2H2 và H2 lấy cùng số mol. Lấy một lượng hỗn hợp X cho đi qua chất xúc tác thích hợp, đun nóng được hỗn hợp Y gồm 4 chất. Dẫn Y qua bình đựng nước brom thấy khối lượng bình tăng 10,8 gam và thoát ra 4,48 lít khí Z (đktc) có tỉ khối so với H2 là 8. Thể tích O2 (đktc) cần để đốt cháy hoàn toàn hỗn hợp Y là
Câu 15 :
Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol vinylaxetilen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với không khí là 1. Nếu cho toàn bộ Y sục từ từ vào dung dịch brom (dư) thì có m gam brom tham gia phản ứng. Giá trị của m là
Câu 16 :
Hỗn hợp khí A gồm 0,4 mol H2 và 0,2 mol ankin X. Nung A một thời gian với xúc tác Ni thu được hỗn hợp B có tỉ khối so với H2 bằng 12. Dẫn hỗn hợp B qua dung dịch brom dư, sau khi phản ứng xảy ra hoàn toàn, khối lượng brom tham gia phản ứng là 8 gam. Công thức phân tử của X là
Câu 17 :
Hỗn hợp X gồm một ankan và một ankin có tỷ lệ mol 1 : 1. Cho 4,48 lít hỗn hợp X (đktc) qua dung dịch Br2, thấy dung dịch mất màu, khối lượng dung dịch tăng 1,6 gam và khí thoát ra có tỷ khối so với H2 là 12,5. Vậy công thức của các chất trong hỗn hợp X là:
Câu 18 :
Một hỗn hợp X gồm 1 ankan A và 1 ankin B có cùng số nguyên tử cacbon. Trộn 6,72 lít khí X với 4,48 lít H2 để được hỗn hợp Y. Khi cho Y qua Pt nung nóng đến phản ứng hoàn toàn thì thu được khí Z có tỉ khối đối với CO2 bằng 1. CTPT và số mol A, B trong hỗn hợp X là (Các thể tích khí đo ở đkc)
Câu 19 :
Hỗn hợp ban đầu gồm 1 ankin, 1 anken, 1 ankan và H2 với áp suất 4 atm. Đun nóng bình với Ni xúc tác để thực hiện phản ứng cộng sau đó đưa bình về nhiệt độ ban đầu được hỗn hợp Y, áp suất hỗn hợp Y là 3 atm. Tỉ khối hỗn hợp X và Y so với H2 lần lượt là 24 và x. Giá trị của x là
Câu 20 :
Cho hỗn hợp X gồm 0,1 mol C2H4, 0,2 mol C2H2 và 0,7 mol H2. Nung X trong bình kín, xúc tác Ni. Sau một thời gian thu được 0,8 mol hỗn hợp Y. Cho Y phản ứng vừa đủ với 100 ml dd Br2 a mol/l. Giá trị a là
Câu 21 :
Cho 22,4 lít (đktc) hỗn hợp E gồm x mol C2H4, z mol C2H2, y mol H2 (dE/He = 3,6) qua bình đựng Ni nung nóng, sau một thời gian phản ứng thì thu được 15,68 lít hỗn hợp khí G (đktc). Dẫn toàn bộ khí G lội chậm vào bình đựng dung dịch brom dư thấy có 80 gam brom phản ứng. Giá trị x và y lần lượt là
Câu 22 :
Trong một bình kín chứa 0,35 mol C2H2; 0,65 mol H2 và một ít bột Ni. Nung nóng bình một thời gian, thu được hỗn hợp khí X có tỉ khối so với H2 bằng 8. Sục X vào lượng dư dung dịch AgNO3 trong NH3 đến phản ứng hoàn toàn, thu được hỗn hợp khí Y và 12 gam kết tủa. Hỗn hợp khí Y phản ứng vừa đủ với bao nhiêu mol Br2 trong dung dịch?
Câu 23 :
Dẫn V lít (ở đktc) hỗn hợp X gồm axetilen và hiđro đi qua ống sứ đựng bột niken nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3 thu được 12 gam kết tủa. Khí đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam brom và còn lại khí Z. Đốt cháy hoàn toàn khí Z được 2,24 lít khí CO2 (đktc) và 4,5 gam H2O. Giá trị của V bằng
Câu 24 :
Cho hỗn hợp X gồm CH4, C2H4 và C2H2. Lấy 8,6 gam X tác dụng hết với dung dịch brom dư thì khối lượng brom phản ứng là 48 gam. Mặt khác, nếu cho 13,44 lít (ở đktc) hỗn hợp khí X tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 36 gam kết tủa. Phần trăm thể tích của CH4 có trong X là
Câu 25 :
Đốt cháy hoàn toàn m gam hidrocacbon ở thể khí, nhẹ hơn không khí, mạch hở thu được 7,04 gam CO2. Sục m gam hidrocacbon này vào nước brom dư đến phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là
Lời giải và đáp án
Câu 1 :
Cho etin phản ứng với dung dịch brom dư thu được sản phẩm là
Đáp án : B Lời giải chi tiết :
CH≡CH + 2Br2 → CHBr2 – CHBr2
Câu 2 :
Cho propin qua nước có HgSO4 ở 80oC tạo ra sản phẩm là
Đáp án : B Lời giải chi tiết :
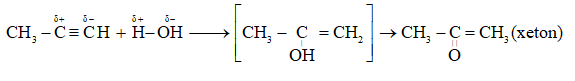
Câu 3 :
Cho hỗn hợp but-1-in và hiđro dư qua xúc tác Pd/PbCO3 đun nóng, sản phẩm tạo ra là
Đáp án : B Lời giải chi tiết :
CH≡C–CH2–CH3 + H2 Pd/PbCO3→ CH2=CH–CH2–CH3
Câu 4 :
Cho phản ứng C2H2 + H2O → A. Chất A là
Đáp án : B Lời giải chi tiết :
C2H2 + H2O HgSO4,to→ CH3–CHO
Câu 5 :
Cho propen, propin, đivinyl tác dụng với HCl (tỉ lệ 1 : 1), số sản phẩm thu được lần lượt là
Đáp án : B Phương pháp giải :
Xem lại lí thuyết phản ứng cộng ankin, cộng anken và ankađien Lời giải chi tiết :
Propen: CH2=CH-CH3 + HCl → CH3-CHCl-CH3 + CH2Cl-CH2-CH3 Propin: CH≡C-CH3 + HCl → CH2=CCl-CH3 + CHCl=CH-CH3 (có đphh) => propin thu được 3 sản phẩm Đivinyl: CH2=CH-CH=CH2 có 2 kiểu cộng 1,2 và cộng 1,4 (xem lại lí thuyết ankađien) CH2=CH-CH=CH2 + HCl → CH2=CH-CH2-CH2Cl + CH2=CH-CHCl-CH3 CH2=CH-CH=CH2 + HCl → CH3-CH=CH-CHCl (có đphh) => đivinyl thu được 4 sản phẩm
Câu 6 :
Khi cho brom hóa hoàn toàn 0,3 mol hỗn hợp gồm một ankin và một anken cần vừa đủ 0,4 mol Br2. Thành phần phần trăm về số mol của ankin trong hỗn hợp là:
Đáp án : C Phương pháp giải :
+) Gọi n anken = a mol, n ankin = b mol => PT (1) +) nBr2 = nanken + 2. nankin => PT (2) Lời giải chi tiết :
Gọi n anken = a mol, n ankin = b mol => a + b = 0,3 (1) Ta có: nBr2 = nanken + 2. nankin => a + 2b = 0,4 (2) Từ (1) và (2) => a = 0,2 mol; b = 0,1 mol => % n ankin = 0,1.100/0.3 = 33,33%
Câu 7 :
Hỗn hợp X gồm một ankan và một ankin. Cho hỗn hợp X qua dung dịch Br2 dư thấy thể tích hỗn hợp giảm đi một nửa. Tính thể tích O2 (đktc) cần dùng để đốt cháy hết 3,5 gam hỗn hợp X?
Đáp án : D Phương pháp giải :
+) thể tích hỗn hợp giảm 1 nửa khi nankan = nankin => đốt cháy hỗn hợp X thu được nCO2 = nH2O +) Ta có: mX = mC + mH = 12.nCO2 + 2.nH2O +) Bảo toàn O: 2.nO2 = 2.nCO2 + nH2O Lời giải chi tiết :
+) Vì thể tích hỗn hợp qua dung dịch Br2 giảm 1 nửa => nankan = nankin => đốt cháy hỗn hợp X thu được nCO2= nH2O= x mol +) Ta có: mX=mC+mH=12.nCO2+2.nH2O=> 12x+2x=3,5 => x = 0,25 mol +) Bảo toàn O: 2.nO2=2.nCO2+nH2O=> nO2=0,375 mol => V = 8,4 lít
Câu 8 :
Cho 28,2 gam hỗn hợp X gồm 3 ankin đồng đẳng kế tiếp qua một lượng dư H2 (to, Ni) để phản ứng xảy ra hoàn toàn. Sau phản ứng thể tích thể tích khí H2 giảm 26,88 lít (đktc). CTPT của 3 ankin là
Đáp án : D Phương pháp giải :
+) Số mol khí giảm = số mol H2 tham gia phản ứng +) nankin=12nH2pu => ¯M =>CTPT của 3 ankin Lời giải chi tiết :
- Ta có: số mol khí giảm = số mol H2 tham gia phản ứng = 1,2 => tổng số mol hỗn hợp = 1,2 / 2 = 0,6 => ¯M = 28,2 / 0,6 = 47 => ¯n = 3,5 => Hỗn hợp có thể là C2H2, C3H4, C4H6 hoặc C3H4, C4H6, C5H8
Câu 9 :
Hỗn hợp X gồm 3 khí C3H4, C2H2 và H2 cho vào bình kín dung tích 8,96 lít (đktc) chứa bột Ni, nung nóng bình một thời gian thu được hỗn hợp khí Y. Biết tỉ khối của X so với Y là 0,75. Số mol H2 tham gia phản ứng là:
Đáp án : C Phương pháp giải :
+) ¯MX¯MY=nYnX +) nH2phản ứng = ngiảm = nX – nY Lời giải chi tiết :
nX = 0,4 mol Ta có: dX/Y=¯MX¯MY=nYnX=nY0,4=0,75⇒nY=0,3(mol) => nH2phản ứng = ngiảm = nX – nY = 0,4 – 0,3 = 0,1 mol
Câu 10 :
Hỗn hợp X gồm ankin B và H2 có tỉ khối hơi so với CH4 là 0,6. Nung X với Ni xúc tác để phản ứng xảy ra hoàn toàn thu được hỗn hợp Y có tỉ khối hơi so với CH4 là 1. Cho Y qua dung dịch Br2 dư thì khối lượng bình đựng sẽ:
Đáp án : D Phương pháp giải :
¯MY= 1.16 = 16 => H2 dư => ankin phản ứng hết, Y chỉ chứa ankan và H2 dư Khối lượng bình brom tăng chính là khối lượng của hiđrocacbon không no Lời giải chi tiết :
Do phản ứng hoàn toàn, mà ¯MY= 1.16 = 16 => H2 dư => ankin phản ứng hết, Y chỉ chứa ankan và H2 dư Khối lượng bình brom tăng chính là khối lượng của hiđrocacbon không no => Bình không tăng
Câu 11 :
Đun nóng hỗn hợp khí gồm 0,06 mol C2H2 và 0,04 mol H2 với xúc tác Ni, sau một thời gian thu được hỗn hợp khí Y. Dẫn toàn bộ hỗn hợp Y lội từ từ qua bình đựng dung dịch brom (dư) thì còn lại 0,448 lít hỗn hợp khí Z (ở đktc) có tỉ khối so với O2 là 0,5. Khối lượng bình dung dịch brom tăng là
Đáp án : D Phương pháp giải :
Bảo toàn khối lượng ta có: mC2H2 + mH2 = mY = mZ + m Lời giải chi tiết :
Bảo toàn khối lượng ta có: mC2H2 + mH2 = mY = mZ + m => 0,06.26 + 0,04.2 = m + 0,02.0,5.32 => m = 1,32 gam
Câu 12 :
Hỗn hợp X gồm 0,1 mol C2H2, 0,15 mol C2H4, 0,2 mol C2H6 và 0,3 mol H2. Đun nóng với Ni xúc tác một thời gian thu được hỗn hợp Y. Đốt cháy hoàn toàn Y thu được số gam CO2 và H2O lần lượt là:
Đáp án : A Phương pháp giải :
Đốt cháy Y cũng chính là đốt cháy X +) Bảo toàn nguyên tố C: nCO2 = 2.nC2H2 + 2.nC2H4 + 2.nC2H6 +) Bảo toàn nguyên tố H: nH2O =nH2 + nC2H2 + 2.nC2H4 + 3.nC2H6 Lời giải chi tiết :
Đốt cháy Y cũng chính là đốt cháy X - Bảo toàn nguyên tố C: nCO2 = 2.nC2H2 + 2.nC2H4 + 2.nC2H6 = 2.0,1 + 2.0,15 + 2.0,2 = 0,9 mol => mCO2 = 39,6 gam - Bảo toàn nguyên tố H: nH2O = nC2H2 + 2.nC2H4 + 3.nC2H6 + nH2 = 1,3 mol => mH2O = 23,4 gam
Câu 13 :
Đun nóng m gam hỗn hợp X gồm C2H2, C2H4, Và H2 với xúc tác Ni đến phản ứng xảy ra hoàn toàn, thu được 8,96 lít (đktc) hỗn hợp Y (có tỉ khối so với H2 bằng 8). Đốt cháy hoàn toàn cùng lượng hỗn hợp X trên, rồi cho sản phẩm cháy hấp thụ hoàn toàn vào dung dịch Ca(OH)2 dư. Khối lượng kết tủa tạo thành là
Đáp án : C Phương pháp giải :
+) Vì phản ứng xảy ra hoàn toàn nên trong Y chứa C2H6 (a mol) và H2 dư (b mol) +) ¯MY=30a+2ba+b=16 (2) +) Đốt cháy X cũng thu được số mol CO2 và H2O như đốt cháy Y +) Bảo toàn nguyên tố C: nCO2 = 2.nC2H6 Lời giải chi tiết :
nY = 0,4 mol ¯MY= 8.2 = 16 => Y chứa H2 dư Vì phản ứng xảy ra hoàn toàn nên trong Y chứa C2H6 (a mol) và H2 dư (b mol) => a + b = 0,4 mol (1) ¯MY=30a+2ba+b=16 (2) Từ (1) và (2) => a = b = 0,2 mol Đốt cháy X cũng thu được số mol CO2 và H2O như đốt cháy Y Bảo toàn nguyên tố C: nCO2 = 2.nC2H6 = 2.0,2 = 0,4 mol => mCaCO3 = 0,4.100 = 40 gam
Câu 14 :
Hỗn hợp X gồm C2H2 và H2 lấy cùng số mol. Lấy một lượng hỗn hợp X cho đi qua chất xúc tác thích hợp, đun nóng được hỗn hợp Y gồm 4 chất. Dẫn Y qua bình đựng nước brom thấy khối lượng bình tăng 10,8 gam và thoát ra 4,48 lít khí Z (đktc) có tỉ khối so với H2 là 8. Thể tích O2 (đktc) cần để đốt cháy hoàn toàn hỗn hợp Y là
Đáp án : A Phương pháp giải :
Coi C2H2 với H2 tác dụng với nhau tạo 4 chất : C2H2, C2H4, C2H6, H2 khi qua bình brom thì chỉ có C2H6 và H2 đi ra. +) Áp dụng bảo toàn khối lượng: mx = my +) Đốt cháy Y cần 1 lượng oxi như đốt cháy X Lời giải chi tiết :
Coi C2H2 với H2 tác dụng với nhau tạo 4 chất : C2H2, C2H4, C2H6, H2 khi qua bình brom thì chỉ có C2H6 và H2 đi ra. Bảo toàn khối lượng: mx = my = 10,8 + 0,2.16 = 2x + 26x => x = 0,5 Đốt cháy Y cũng như đốt cháy X =>nO2=2,5nC2H2+nH2=1,5mol =>V = 3/2 . 22,4 = 33,6 lít
Câu 15 :
Hỗn hợp khí X gồm 0,3 mol H2 và 0,1 mol vinylaxetilen. Nung X một thời gian với xúc tác Ni thu được hỗn hợp khí Y có tỉ khối so với không khí là 1. Nếu cho toàn bộ Y sục từ từ vào dung dịch brom (dư) thì có m gam brom tham gia phản ứng. Giá trị của m là
Đáp án : D Phương pháp giải :
Vinylaxetilen: CH2=CH-C≡CH phân tử có 3 liên kết π +) Bảo toàn khối lượng: mX = mY = 5,8 gam +) nH2 phản ứng = nkhí giảm = nX – nY +) Bảo toàn liên kết π: nBr2 phản ứng = n liên kết π ban đầu – nH2 phản ứng Lời giải chi tiết :
Vinylaxetilen: CH2=CH-C≡CH phân tử có 3 liên kết π ∑nliên kết π = 3.0,1 = 0,3 mol; nX = 0,3 + 0,1 = 0,4 mol Bảo toàn khối lượng: mX = 0,3.2 + 0,1.52 = 5,8 gam => mY = 5,8 gam ˉMY=29⇒nY=5,829=0,2mol => nH2 phản ứng = nkhí giảm = nX – nY = 0,4 – 0,2 = 0,2 mol Bảo toàn liên kết π: nBr2 phản ứng = nliên kết π ban đầu – nH2 phản ứng = 0,3 – 0,2 = 0,1 mol => mBr2 = 0,1.160 = 16 gam
Câu 16 :
Hỗn hợp khí A gồm 0,4 mol H2 và 0,2 mol ankin X. Nung A một thời gian với xúc tác Ni thu được hỗn hợp B có tỉ khối so với H2 bằng 12. Dẫn hỗn hợp B qua dung dịch brom dư, sau khi phản ứng xảy ra hoàn toàn, khối lượng brom tham gia phản ứng là 8 gam. Công thức phân tử của X là
Đáp án : D Phương pháp giải :
+) Gọi công thức phân tử của ankin X là CnH2n-2 +) Ta có : ˉMAˉMB=nBnA=>nB=nA.ˉMAˉMB=mAˉMB=2,8n+0,42.12 +) nH2 phản ứng = nkhí giảm = nA – nB +) Bảo toàn liên kết π: nπ trong A = nH2 phản ứng + nBr2 phản ứng Lời giải chi tiết :
Gọi công thức phân tử của ankin X là CnH2n-2 => mA = mH2 + mankin = 0,4.2 + 0,2.(14n – 2) = 2,8n + 0,4 Ta có : ˉMAˉMB=nBnA=>nB=nA.ˉMAˉMB=mAˉMB=2,8n+0,42.12 => nH2 phản ứng = nkhí giảm = nA – nB = 0,6−2,8n+0,42.12 (1) Bảo toàn liên kết π: nπ trong A = nH2 phản ứng + nBr2 phản ứng => nH2 phản ứng = 0,2.2 – 0,05 = 0,35 mol (2) Từ (1) và (2) => 0,6−2,8n+0,42.12=0,35=>n=2 Vậy CTPT của ankin X là C2H2
Câu 17 :
Hỗn hợp X gồm một ankan và một ankin có tỷ lệ mol 1 : 1. Cho 4,48 lít hỗn hợp X (đktc) qua dung dịch Br2, thấy dung dịch mất màu, khối lượng dung dịch tăng 1,6 gam và khí thoát ra có tỷ khối so với H2 là 12,5. Vậy công thức của các chất trong hỗn hợp X là:
Đáp án : B Phương pháp giải :
+) Từ ˉM => CTPT ankan +) ˉM=16.0,1+a.Mankin0,1+a=> PT (1) +) Khối lượng dung dịch brom tăng = khối lượng ankin phản ứng => PT(2) Lời giải chi tiết :
nankan = nankin = 0,1 mol Khí thoát ra gồm ankan và ankin dư. Gọi nankin dư = a mol ˉM=12,5.2=25 => ankan là CH4 (vì MCH4 = 16 < 25) ˉM=16.0,1+Mankin.a0,1+a=12,5.2=25 (1) Khối lượng dung dịch brom tăng = khối lượng ankin phản ứng => mankin phản ứng = 1,6 gam => Mankin.(0,1 – a) = 1,6 (2) Từ (1) và (2) => M = 40; a = 0,06 => ankin là C3H4
Câu 18 :
Một hỗn hợp X gồm 1 ankan A và 1 ankin B có cùng số nguyên tử cacbon. Trộn 6,72 lít khí X với 4,48 lít H2 để được hỗn hợp Y. Khi cho Y qua Pt nung nóng đến phản ứng hoàn toàn thì thu được khí Z có tỉ khối đối với CO2 bằng 1. CTPT và số mol A, B trong hỗn hợp X là (Các thể tích khí đo ở đkc)
Đáp án : D Phương pháp giải :
+) Phản ứng cộng hiđro hoàn toàn và chỉ thu được 1 khí Z => Z là ankan; ankin B và H2 ban đầu đều hết +) MZ = 44 => Z là C3H8 +) nAnkin = 1/2.nH2 Lời giải chi tiết :
Phản ứng cộng hiđro hoàn toàn và chỉ thu được 1 khí Z => Z là ankan; ankin B và H2 ban đầu đều hết MZ = 44 => Z là C3H8 => ankan A là C3H8 và ankin B là C3H4 nH2 = 0,2 => nAnkin = 0,1 => nankan = 0,3 – 0,1 = 0,2
Câu 19 :
Hỗn hợp ban đầu gồm 1 ankin, 1 anken, 1 ankan và H2 với áp suất 4 atm. Đun nóng bình với Ni xúc tác để thực hiện phản ứng cộng sau đó đưa bình về nhiệt độ ban đầu được hỗn hợp Y, áp suất hỗn hợp Y là 3 atm. Tỉ khối hỗn hợp X và Y so với H2 lần lượt là 24 và x. Giá trị của x là
Đáp án : D Phương pháp giải :
+) PXPY=dYdX=MYMX => tỉ lệ MX và MY +) Từ d(x)/H2 = 24 => MX +) Tính MY => d(x)/H2 Lời giải chi tiết :
Theo bài ra, ta có: PXPY=dYdX=MYMX Mà d(x)/H2 = 24 => MX = 48 => MY = (4 . 48) / 3 = 64 => dY/H2 = 64 : 2 = 32
Câu 20 :
Cho hỗn hợp X gồm 0,1 mol C2H4, 0,2 mol C2H2 và 0,7 mol H2. Nung X trong bình kín, xúc tác Ni. Sau một thời gian thu được 0,8 mol hỗn hợp Y. Cho Y phản ứng vừa đủ với 100 ml dd Br2 a mol/l. Giá trị a là
Đáp án : B Phương pháp giải :
+) C2H4 chứa 1 liên kết π; C2H2 chứa 2 liên kết π => Tính ∑nliên kết π +) nH2 phản ứng = nkhí giảm = nX – nY +) Bảo toàn liên kết π: nH2 phản ứng + nBr2 phản ứng = n liên kết π ban đầu Lời giải chi tiết :
C2H4 chứa 1 liên kết π; C2H2 chứa 2 liên kết π => ∑nliên kết π = 1.0,1 + 2.0,2 = 0,5 mol nH2 phản ứng = nX – nY = 0,7 + 0,1 + 0,2 - 0,8 = 0,2 mol Bảo toàn liên kết π: nH2 phản ứng + nBr2 phản ứng = nliên kết π ban đầu => nBr2 phản ứng = n liên kết π ban đầu – nH2 phản ứng = 0,5 – 0,2 = 0,3 mol => a = 0,3 / 0,1 = 3M
Câu 21 :
Cho 22,4 lít (đktc) hỗn hợp E gồm x mol C2H4, z mol C2H2, y mol H2 (dE/He = 3,6) qua bình đựng Ni nung nóng, sau một thời gian phản ứng thì thu được 15,68 lít hỗn hợp khí G (đktc). Dẫn toàn bộ khí G lội chậm vào bình đựng dung dịch brom dư thấy có 80 gam brom phản ứng. Giá trị x và y lần lượt là
Đáp án : B Phương pháp giải :
+) Từ nE => PT(1) +)ˉME/He=28x+2y+26zx+y+z=>PT(2) +) nH2 phản ứng = nkhí giảm = nE – nG +) ∑nliên kết π = nC2H4 + 2.nC2H2 +) Bảo toàn liên kết π: ∑nliên kết π = nH2 pư + nBr2 pư => PT (3) Lời giải chi tiết :
nE = x + y + z = 1 (1) ˉME/He=28x+2y+26zx+y+z=3,6.4(2) nG = 0,7 mol => nH2 phản ứng = nkhí giảm = nE – nG = 1 – 0,7 = 0,3 mol n Br2 = 0,5 mol ∑nliên kết π = nC2H4 + 2.nC2H2 = x + 2z Bảo toàn liên kết π: ∑nliên kết π = nH2 pư + nBr2 pư => x + 2z = 0,8 (3) Từ (1), (2), (3) => x = 0,2 ; y = 0,5 ; z = 0,3 Chú ý
Đề bài sắp xếp thứ tư, mol x, z, y => dễ chọn nhầm đáp án
Câu 22 :
Trong một bình kín chứa 0,35 mol C2H2; 0,65 mol H2 và một ít bột Ni. Nung nóng bình một thời gian, thu được hỗn hợp khí X có tỉ khối so với H2 bằng 8. Sục X vào lượng dư dung dịch AgNO3 trong NH3 đến phản ứng hoàn toàn, thu được hỗn hợp khí Y và 12 gam kết tủa. Hỗn hợp khí Y phản ứng vừa đủ với bao nhiêu mol Br2 trong dung dịch?
Đáp án : C Phương pháp giải :
+) Bảo toàn khối lượng: mhh ban đầu = mhh X +) n khí giảm = nH2 phản ứng +) n C2H2 dư = nAg2C2 +) Bảo toàn liên kết π: n π trong Y = np ban đầu – nH2 – 2.nC2H2 dư +) n Br2 pư với Y = nπ trong Y Lời giải chi tiết :
Số mol hỗn hợp ban đầu = 0,35 + 0,65 = 1 mol Khối lượng hỗn hợp ban đầu = 0,35. 26 + 0,65.2 = 10,4 gam Số mol liên kết π = 0,35.2 = 0,7 mol Bảo toàn khối lượng: mhh ban đầu = mhh X =10,4 gam => nX = 10,4/16 = 0,65 mol n khí giảm = nH2 phản ứng = 0,35 mol Ta có: n C2H2 dư = nAg2C2 = 0,05 mol Bảo toàn liên kết π : n π trong Y = np ban đầu – nH2 – 2.nC2H2 dư = 0,7 – 0,35 – 0,05.2 = 0,25 mol => nBr2 pư với Y = nπ trong Y = 0,25 mol Chú ý
+ tính số π trong Y quên không trừ π của C2H2 dư => chọn nhầm A + Trừ nhầm số π của C2H2 dư => chọn nhầm D
Câu 23 :
Dẫn V lít (ở đktc) hỗn hợp X gồm axetilen và hiđro đi qua ống sứ đựng bột niken nung nóng, thu được khí Y. Dẫn Y vào lượng dư AgNO3 trong dung dịch NH3 thu được 12 gam kết tủa. Khí đi ra khỏi dung dịch phản ứng vừa đủ với 16 gam brom và còn lại khí Z. Đốt cháy hoàn toàn khí Z được 2,24 lít khí CO2 (đktc) và 4,5 gam H2O. Giá trị của V bằng
Đáp án : A Phương pháp giải :
C2H2 + 2AgNO3 + 2NH3→ C2Ag2 + 2NH4NO3 => nC2H2 dư = 0,05 mol +) nC2H4 = nBr2 phản ứng +)Bảo toàn C: nC2H6 = ½.nCO2 +) Bảo toàn H: nH2O = 3.nC2H6 + nH2 +) Bảo toàn nguyên tố C trong hỗn hợp X: nC2H2 ban đầu = nC2H2 dư + nC2H2 pứ = nC2H2 dư + nC2H4 + nC2H6 +) nH2 bđ = nH2 pứ + nH2 dư = nC2H4 + 2.nC2H6 + nH2 dư Lời giải chi tiết :
hh X gồm C2H2 + H2 → hh Y gồm C2H2 dư, C2H4, C2H6, H2 dư C2H2 + 2AgNO3 + 2NH3→ C2Ag2 + 2NH4NO3 0,05 <------------------------------ 0,05 => nC2H2 dư = 0,05 mol Khí đi ra khỏi bình là C2H4, C2H6, H2 => nC2H4 = nBr2 phản ứng = 0,1 mol Khí Z: C2H6 và H2 Bảo toàn C: nC2H6 = ½.nCO2 = 0,05 mol Bảo toàn H: nH2O = 3.nC2H6 + nH2 => nH2 = 0,25 – 3.0,05 = 0,1 mol Bảo toàn nguyên tố C trong hỗn hợp X: nC2H2 ban đầu = nC2H2 dư + nC2H2 pứ = nC2H2 dư + nC2H4 + nC2H6 => nC2H2= 0,05 + 0,1+ 0,05 = 0,2 mol nH2 bđ = nH2 pứ + nH2 dư = nC2H4 + 2.nC2H6 + nH2 dư = 0,3 mol => V = (0,2 + 0,3).22,4 = 11,2 (l) Chú ý
Chọn nhầm B vì quên tính số mol C2H2 dư
Câu 24 :
Cho hỗn hợp X gồm CH4, C2H4 và C2H2. Lấy 8,6 gam X tác dụng hết với dung dịch brom dư thì khối lượng brom phản ứng là 48 gam. Mặt khác, nếu cho 13,44 lít (ở đktc) hỗn hợp khí X tác dụng với lượng dư dung dịch AgNO3 trong NH3, thu được 36 gam kết tủa. Phần trăm thể tích của CH4 có trong X là
Đáp án : D Phương pháp giải :
Trong 8,6g X chứa a mol C2H4; b mol C2H2; c mol CH4 +) mhh X = PT(1) +) nBr2 phản ứng = nπ trong X = nC2H4 + 2.nC2H2 => PT(2) +) nC2Ag2 = nC2H2 => %nC2H2 trong X => trong 8,6 gam X % số mol C2H2 cũng là 25% => PT(3) Lời giải chi tiết :
Trong 8,6g X chứa a mol C2H4; b mol C2H2; c mol CH4 mhh X = 28a + 26b + 16c = 8,6 (1) nBr2 phản ứng = nπ trong X = nC2H4 + 2.nC2H2 => a + 2b = 0,3 (2) C2H2 + 2AgNO3 + 2NH3 → C2Ag2 + 2NH4NO3 nC2Ag2 = 0,15 (mol) => nC2H2 = 0,15 (mol) => %nC2H2 trong X = 0,15/0,6 = 25% => trong 8,6 gam X % số mol C2H2 cũng là 25% => b = 25%.(a + b + c) (3) Từ (1), (2) và (3) => a = 0,1; b = 0,1; c = 0,2 ==>%n CH4 trong X = 50%
Câu 25 :
Đốt cháy hoàn toàn m gam hidrocacbon ở thể khí, nhẹ hơn không khí, mạch hở thu được 7,04 gam CO2. Sục m gam hidrocacbon này vào nước brom dư đến phản ứng hoàn toàn, thấy có 25,6 gam brom phản ứng. Giá trị của m là
Đáp án : B Phương pháp giải :
Đặt CTPT : CnH2n+2-2k ( k là số liên kết pi) CnH2n+2-2k + k Br2 → CnH2n+2-2k Br2k Bảo toàn C có nhc = nCO2n=0,16n mol → nBr2 = 0,16n.k = 0,16 → k = n → biện luận với n ≤ 4 Lời giải chi tiết :
Đặt CTPT : CnH2n+2-2k ( k là số liên kết pi) CnH2n+2-2k + k Br2 → CnH2n+2-2k Br2k Bảo toàn C có nhc = nCO2n=0,16n mol → nBr2 = 0,16n.k = 0,16 → k = n → Hidrocacbon là CnH2 Với k = n = 1 thì HC là : CH2 loại Với k = n = 2 thì HC là C2H2 → m = 0,08 . 26 =2,08 g Với k = n = 3 thì HC là C3H2 ( không có CTHH thỏa mãn ) Với k = n =4 thì HC là C4H2 → m = 0,04.50 = 2 g
|












