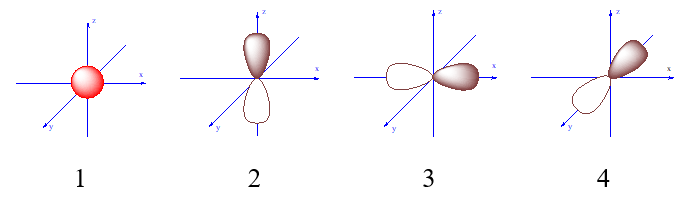Đề thi học kì 1 Hóa 10 Kết nối tri thức - Đề số 5Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa... Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X làĐề bài
Câu 1 :
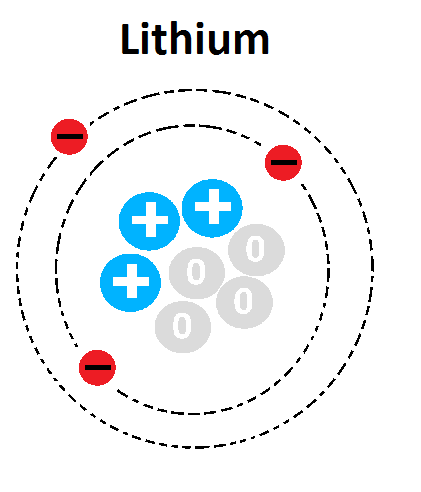
Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X là
Mô hình cấu tạo nguyên tử X
Câu 2 :
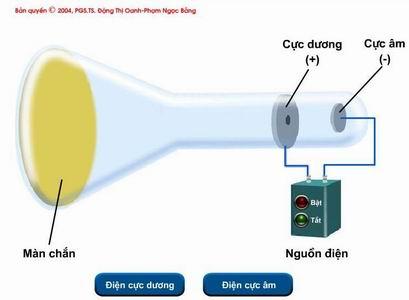
Hình vẽ sau mô tả thí nghiệm tìm ra hạt A – là một trong những thành phần cấu tạo nên nguyên tử. Đó là
Thí nghiệm tìm ra hạt A
Câu 3 :
Hạt nhân của nguyên tử nào có số hạt neutron là 28?
Câu 4 :
Cho các phát biểu sau đây về các hạt cấu tạo nên nguyên tử (i) Hạt nhân của tất cả các nguyên tử đều chứa neutron. (ii) Có những nguyên tử chứa nhiều neutron hơn proton. (iii) Các proton và neutron có cùng khối lượng. (iv) Electron không có khối lượng. Các phát biểu đúng là
Câu 5 :
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là:
Câu 7 :
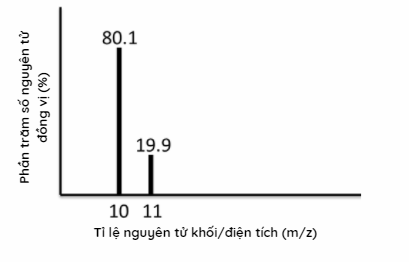
Phổ khối lượng của nguyên tố X được cho ở hình 1.34. Nguyên tử khối trung bình của nguyên tố này là bao nhiêu?
Câu 8 :
Nguyên tử M có cấu hình electron 1s2s22p4. Cấu hình electron theo ô orbital là
Câu 9 :
Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
Câu 10 :
Trong cùng 1 nhóm A (trừ He), khi đi từ trên xuống dưới, nhìn chung:
Câu 11 :
Nguyên tố M thuộc chu kì 3, nhóm VIIA của bảng tuần hoàn các nguyên tố hóa học. Công thức oxide cao nhất của M là:
Câu 12 :
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
Câu 13 :
X, Y và Z là các nguyên tố thuộc cùng chu kì của bảng tuần hoàn. Oxide của X tan trong nước tạo thành dung dịch làm hồng giấy quỳ tím. Oxide của Y phản ứng với nước tạo thành dung dịch làm xanh quỳ tím. Oxide của Z phản ứng được với cả acid lẫn base. Cách phân loại X,Y,Z nào sau đây là đúng ?
Câu 14 :
Hợp chất khí với H của một nguyên tố ứng với công thức RH4. Oxide cao nhất của nó chứa 53,3% O. Nguyên tố R là:
Câu 15 :
Cho các phát biểu sau: (a) Nguyên tố hóa học là tập hợp những nguyên tử có cùng số electron. (b) Vỏ nguyên tử được chia thành 7 lớp, các electron trong cùng một lớp có năng lượng bằng nhau. (c) Có 3 nguyên tố đều có cấu hình electron lớp ngoài cùng là 4s1. (d) Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron. (e) Trong bảng tuần hoàn, các nguyên tố s, p thuộc nhóm A, các nguyên tố d, f thuộc nhóm B. Số phát biểu đúng là
Câu 16 :
Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là:
Câu 17 :
Cho các nguyên tố A (ns1), B (ns2), X (ns2np5) đều thuộc chu kì nhỏ, n ≠ 1. Chọn phát biểu không đúng trong các phát biểu dưới đây.
Câu 18 :
Dãy các chất trong dãy nào sau đây chỉ có liên kết cộng hóa trị phân cực?
Câu 19 :
Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion?
Câu 20 :
M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxide cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây ?
Câu 21 :
Các chất trong phân tử chỉ có liên kết cộng hóa trị là:
Câu 22 :
Cho các phát biểu về các loại liên kết? (a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hoá trị. (b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị. (c) Tương tác van der Waals yếu hơn liên kết hydrogen. (d) Tương tác van der Waals mạnh hơn liên kết cộng hóa trị Số phát biểu đúng là
Câu 23 :
Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
Câu 24 :
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
Câu 25 :
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
Lời giải và đáp án
Câu 1 :
Nguyên tử X có mô hình cấu tạo như hình bên dưới. Số hiệu nguyên tử của X là
Mô hình cấu tạo nguyên tử X
Đáp án : B Phương pháp giải :
Dựa vào mô hình cấu tạo nguyên tử X Lời giải chi tiết :
Nguyên tử X có 3 electron => Z= E = P = 3 Đáp án B
Câu 2 :
Hình vẽ sau mô tả thí nghiệm tìm ra hạt A – là một trong những thành phần cấu tạo nên nguyên tử. Đó là
Thí nghiệm tìm ra hạt A
Đáp án : A Phương pháp giải :
Dựa vào hình ảnh thí nghiệm Lời giải chi tiết :
Thí nghiệm tìm ra hạt electron Đáp án A
Câu 3 :
Hạt nhân của nguyên tử nào có số hạt neutron là 28?
Đáp án : B Phương pháp giải :
Số N = A – P
Lời giải chi tiết :
Số N của Fe là 54 – 26 = 28 Đáp án B
Câu 4 :
Cho các phát biểu sau đây về các hạt cấu tạo nên nguyên tử (i) Hạt nhân của tất cả các nguyên tử đều chứa neutron. (ii) Có những nguyên tử chứa nhiều neutron hơn proton. (iii) Các proton và neutron có cùng khối lượng. (iv) Electron không có khối lượng. Các phát biểu đúng là
Đáp án : C Phương pháp giải :
Dựa vào kiến thức về cấu tạo nguyên tử Lời giải chi tiết :
(i) sai vì hạt nhân của hydrogen không chứa neutron (ii) đúng (iii) đúng (iv) electron vẫn có khối lượng sấp sỉ bằng 0,00055amu Đáp án C
Câu 5 :
Số electron tối đa chứa trong các phân lớp s, p, d, f lần lượt là:
Đáp án : D Phương pháp giải :
Dựa vào số electron trong các phân lớp Lời giải chi tiết :
Phân lớp s chứa tối đa 2 electron Phân lớp p chứa tối đa 6 electron Phân lớp d chứa tối đa 10 electron Phân lớp f chứa tối đa 14 electron Đáp án D
Đáp án : C Phương pháp giải :
Dựa vào hình ảnh của các AO Lời giải chi tiết :
Hình 3 chứa AOpx Đáp án C
Câu 7 :
Phổ khối lượng của nguyên tố X được cho ở hình 1.34. Nguyên tử khối trung bình của nguyên tố này là bao nhiêu?
Đáp án : C Phương pháp giải :
Dựa vào phổ khối lượng của nguyên tố X Lời giải chi tiết :
\({\bar M_X} = \frac{{80,1.10 + 11.19,9}}{{100}} = 10,2\) Đáp án C
Câu 8 :
Nguyên tử M có cấu hình electron 1s2s22p4. Cấu hình electron theo ô orbital là
Đáp án : A Phương pháp giải :
Dựa vào cấu hình electron theo ô orbital Lời giải chi tiết :
Mỗi ô orbital chứa tối đa 2 electron, biểu diễn bằng 2 mũi tên ngược chiều nhau. Các electron điền đủ vào các ô orbital Đáp án A
Câu 9 :
Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
Đáp án : B Phương pháp giải :
Ion R3+ đã nhường 3 electron, có phân lớp cuối cùng là 3d5 Lời giải chi tiết :
Cấu hình của R là: 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
Câu 10 :
Trong cùng 1 nhóm A (trừ He), khi đi từ trên xuống dưới, nhìn chung:
Đáp án : B Phương pháp giải :
Dựa vào xu hướng biến đổi trong bảng tuần hoàn trong cùng 1 nhóm A Lời giải chi tiết :
Đáp án B
Câu 11 :
Nguyên tố M thuộc chu kì 3, nhóm VIIA của bảng tuần hoàn các nguyên tố hóa học. Công thức oxide cao nhất của M là:
Đáp án : C Phương pháp giải :
Dựa vào vị trí của nguyên tố M Lời giải chi tiết :
Nguyên tố M thuộc nhóm VIIA => có 7 electron lớp ngoài cùng Công thức oxide cao nhất là M2O7
Câu 12 :
Cation R+ có cấu hình electron 1s22s22p63s23p6. Vị trí của nguyên tố R trong bảng tuần hoàn các nguyên tố hóa học là
Đáp án : A Phương pháp giải :
Cation R+ đã nhường đi 1 electron Lời giải chi tiết :
Cấu hình của R là 1s22s22p63s23p64s1 => chu kì 4, nhóm IA Đáp án A
Câu 13 :
X, Y và Z là các nguyên tố thuộc cùng chu kì của bảng tuần hoàn. Oxide của X tan trong nước tạo thành dung dịch làm hồng giấy quỳ tím. Oxide của Y phản ứng với nước tạo thành dung dịch làm xanh quỳ tím. Oxide của Z phản ứng được với cả acid lẫn base. Cách phân loại X,Y,Z nào sau đây là đúng ?
Đáp án : D Phương pháp giải :
Dựa vào dung dịch sau khi hòa tan các hợp chất của X, Y, Z vào nước Lời giải chi tiết :
Oxide X hòa tan trong nước thu được dung dịch làm hồng quỳ tìm => Oxide X là oxide acid => X là phi kim Oxide Y hòa tan trong nước thu được dung dịch làm xanh quỳ tím => oxide Y là oxide base tan => Y là kim loại Oxide Z phản ứng được cả acid và base => Z phản ứng được với cả dung dịch acid và base Đáp án D
Câu 14 :
Hợp chất khí với H của một nguyên tố ứng với công thức RH4. Oxide cao nhất của nó chứa 53,3% O. Nguyên tố R là:
Đáp án : C Lời giải chi tiết :
Vì công thức ứng với H của R là RH4 => Công thức oxide của R là RO2 \(\begin{array}{l}\% O = \frac{{16.2}}{{16.2 + R}}.100\% = 53,3\% \\ \to {M_R} = 28\end{array}\) Đáp án C
Câu 15 :
Cho các phát biểu sau: (a) Nguyên tố hóa học là tập hợp những nguyên tử có cùng số electron. (b) Vỏ nguyên tử được chia thành 7 lớp, các electron trong cùng một lớp có năng lượng bằng nhau. (c) Có 3 nguyên tố đều có cấu hình electron lớp ngoài cùng là 4s1. (d) Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron. (e) Trong bảng tuần hoàn, các nguyên tố s, p thuộc nhóm A, các nguyên tố d, f thuộc nhóm B. Số phát biểu đúng là
Đáp án : D Phương pháp giải :
Dựa vào cấu tạo của nguyên tố hóa học Lời giải chi tiết :
(a) đúng (b) sai, vì vỏ nguyên tử của mỗi nguyên tố có số lớp khác nhau, nguyên tử có tối đa 7 lớp, các electron cùng lớp có năng lượng gần bằng nhau (c) đúng vì có nguyên tố K, Cr, Cu (d) đúng (e) đúng Đáp án D
Câu 16 :
Nguyên tử X có 11 electron p, còn nguyên tử Y có 5 electron s. Liên kết giữa X và Y là:
Đáp án : A Phương pháp giải :
Xác định nguyên tử X và nguyên tử Y Lời giải chi tiết :
Nguyên tử X có 11 electron p => cấu hình của X là: 1s22s22p63s23p5 => X có 17 electron (Cl) Nguyên tử Y có 5 electron s => cấu hình của Y là: 1s22s22p63s1 => Y có 11 electron (Na) Vậy liên kết giữa Na và Cl là liên kết ion Đáp án A
Câu 17 :
Cho các nguyên tố A (ns1), B (ns2), X (ns2np5) đều thuộc chu kì nhỏ, n ≠ 1. Chọn phát biểu không đúng trong các phát biểu dưới đây.
Đáp án : B Phương pháp giải :
Dựa vào số electron lớp ngoài cùng của các nguyên tố Lời giải chi tiết :
Nguyên tố A, B là kim loại, X là phi kim Liên kết giữa A hoặc B và X là liên kết ion A, B không liên kết với nhau Đáp án B
Câu 18 :
Dãy các chất trong dãy nào sau đây chỉ có liên kết cộng hóa trị phân cực?
Đáp án : D Phương pháp giải :
Dựa vào hiệu độ âm điện của các hợp chất Lời giải chi tiết :
Đáp án D
Câu 19 :
Cho độ âm điện: Be (1,5), Al (1,5), Mg (1,2), Cl (3,0), N (3,0), H (2,1), S (2,5), O (3,5). Chất nào sau đây có liên kết ion?
Đáp án : C Phương pháp giải :
Dựa vào hiệu độ âm điện của các hợp chất Liên kết ion có hiệu độ âm điện >1,7 Lời giải chi tiết :
Đáp án C
Câu 20 :
M thuộc nhóm IIA, X thuộc nhóm VIA. Trong oxide cao nhất M chiếm 71,43% khối lượng, còn X chiếm 40% khối lượng. Liên kết giữa X và M trong hợp chất thuộc loại liên kết nào sau đây ?
Đáp án : A Phương pháp giải :
Dựa vào % khối lượng M, X trong hợp chất oxide Lời giải chi tiết :
Công thức hợp chất oxide của M là: MO \(\begin{array}{l}\% M = \frac{M}{{M + 16}}.100\% = 71,43\% \\ \to M = 40(Ca)\end{array}\) Công thức hợp chất oxide của X là XO3 \(\begin{array}{l}\% X = \frac{X}{{X + 16.3}}.100\% = 40\% \\ \to X = 32(S)\end{array}\) Liên kết giữa Ca và S là liên kết ion
Câu 21 :
Các chất trong phân tử chỉ có liên kết cộng hóa trị là:
Đáp án : D Phương pháp giải :
Liên kết cộng hóa trị thường được hình thành giữa phi kim và phi kim Lời giải chi tiết :
Đáp án D
Câu 22 :
Cho các phát biểu về các loại liên kết? (a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hoá trị. (b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hoá trị. (c) Tương tác van der Waals yếu hơn liên kết hydrogen. (d) Tương tác van der Waals mạnh hơn liên kết cộng hóa trị Số phát biểu đúng là
Đáp án : B Phương pháp giải :
Dựa vào kiến thức về liên kết hóa học Lời giải chi tiết :
(a) đúng (b) sai (c) đúng (d) sai Đáp án B
Câu 23 :
Thứ tự nào sau đây thể hiện độ mạnh giảm dần của các loại liên kết?
Đáp án : A Lời giải chi tiết :
Đáp án A
Câu 24 :
Nguyên tử nào sau đây có khuynh hướng đạt cấu hình electron bền của khí hiếm neon khi tham gia hình thành liên kết hóa học?
Đáp án : C Phương pháp giải :
Dựa vào cấu hình electron của mỗi nguyên tử nguyên tố. Lời giải chi tiết :
Cl: 1s2 2s2 2p6 3s2 3p5 ⟶ có xu hướng nhận 1e thành 1s2 2s2 2p6 3s2 3p6 (cấu hình electron Ar). S: 1s2 2s2 2p6 3s2 3p4 ⟶ có xu hướng nhận 2e thành 1s2 2s2 2p6 3s2 3p6 (cấu hình electron Ar). O: 1s2 2s2 2p4 ⟶ có xu hướng nhận 2e thành 1s2 2s2 2p6 (cấu hình electron Ne). H: 1s1 ⟶ có xu hướng nhận 1e thành 1s2 (cấu hình electron He). Chọn C.
Câu 25 :
Trong phân tử HBr, nguyên tử hydrogen và bromine đã lần lượt đạt cấu hình electron bền của các khí hiếm nào dưới đây?
Đáp án : D Phương pháp giải :
Dựa vào cấu hình electron của mỗi nguyên tử nguyên tố. Lời giải chi tiết :
H: 1s1 ⟶ có xu hướng nhận 1e thành 1s2 (cấu hình electron He). Br: 1s2 2s2 2p6 3s2 3p6 3d104s2 4p5 ⟶ có xu hướng nhận 1e thành 1s2 2s2 2p6 3s2 3p6 3d104s2 4p6 (cấu hình electron Kr). Chọn D.
|