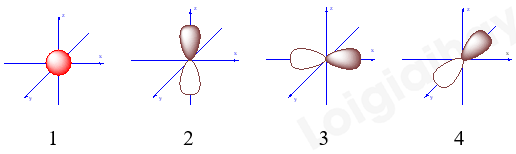
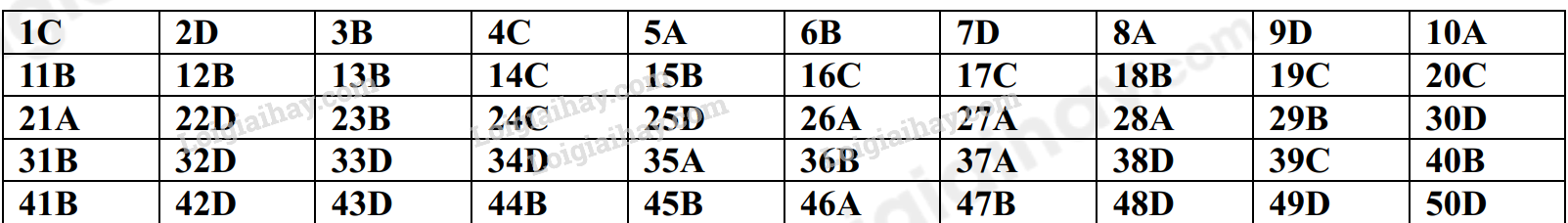
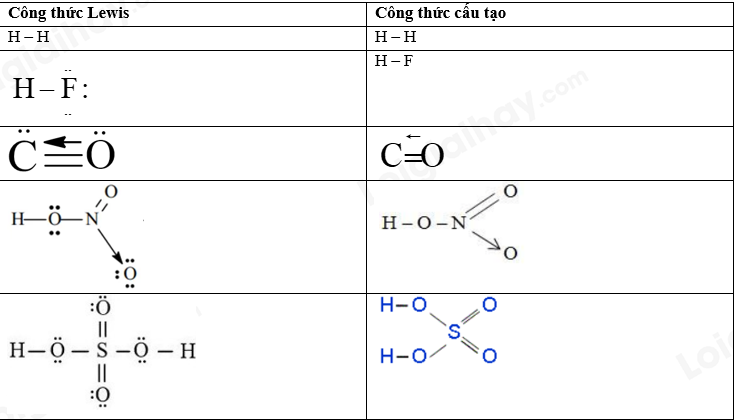
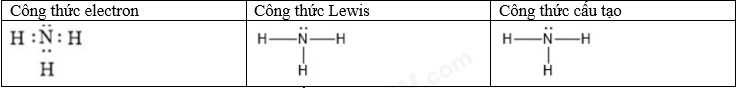
Đề cương ôn tập học kì 1 Hóa 10Tải vềTrình bày được thành phần của nguyên tử, mô hình nguyên tử Rutherford – Bohr Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa... A. NỘI DUNG ÔN TẬPChủ đề 1: Cấu tạo nguyên tử- Trình bày được thành phần của nguyên tử, mô hình nguyên tử Rutherford – Bohr và mô hình hiện đại; hình dạng của AO; số lượng electron trong một AO; - So sánh được khối lượng của electron với proton và với neutron; kích thước của hạt nhân với nguyên tử - Các khái niệm: nguyên tố hóa học, số hiệu nguyên tử, số khối, kí hiệu nguyên tử, đồng vị, nguyên tử khối, orbital nguyên tử, lớp, phân lớp electron - Tính được nguyên tử khối trung bình dựa vào khối lượng nguyên tử và phần trăm só nguyên tử các đồng vị theo phổ khối lượng được cung cấp - Viết được cấu hình electron nguyên tử theo lớp, phân lớp electron và theo ô orbital khi biết số hiệu nguyên tử Z của 20 nguyên tử đầu tiên trong bảng tuần hoàn - Dựa vào đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử, dự đoán được tính chất hóa học cơ bản của nguyên tố tương ứng. Chủ đề 2: Bảng tuần hoàn các nguyên tố hóa học- Mô tả được cấu tạo của bảng tuần hoàn các nguyên tố hóa học và nêu được các khái niệm liên quan: ô, chu kì, nhóm - Nguyên tắc sắp xếp của bảng tuần hoàn các nguyên tố hóa học - Phân loại được nguyên tố hóa học (dựa theo cấu hình các nguyên tố hóa học s, p, d, f dựa vào tính chất hóa học: kim loại, phi kim, khí hiếm) - Các quy luật biến đổi độ âm điện, tính kim loại, tính phi kim, tính acid, tính base của các oxide và các hydroxide - Phát biểu được định luật tuần hoàn các nguyên tố hóa hộc - Trình bày được ý nghĩa của bảng tuần hoàn các nguyên tố hóa học, mối liên hệ giữa vị trí với tính chất và ngược lại Chủ đề 3: Liên kết hóa học- Khái niệm: quy tắc octet, liên kết ion, liên kết cộng hóa trị, liên kết cho – nhận, liên kết hydrogen và tương tác van der Waals - Tính chất của các hợp chứa liên kết ion, liên kết cộng hóa trị - Phân biệt được các loại liên kết dựa theo độ âm điện - Giải thích được sự hình thành liên kết sigma và liên kết pi qua sự xen phủ AO - Vận dụng để giải thích được sự xuất hiện liên kết hydrogen - Nêu được vai trò, ảnh hưởng của liên kết hydrogen với tính chất vật lí, nhiệt độ nóng chảy, nhiệt độ sôi của các chất. B. BÀI TẬPĐề bàiI. Trắc nghiệmCâu 1: Các hạt cấu tạo nên hầu hết các hạt nhân nguyên tử là A. Electron và neutron B. Electron và proton C. Neutron và proton D. Electron, neutron và proton Câu 2: Chọn định nghĩa đúng về đồng vị : A. Đồng vị là những nguyên tố có cùng số khối. B. Đồng vị là những nguyên tố có cùng điện tích hạt nhân. C. Đồng vị là những nguyên tử có cùng điện tích hạt nhân và cùng số khối. D. Đồng vị là những nguyên tử có cùng số proton, khác nhau số nơtron. Câu 3: Cho bảng thông tin sau về nguyên tử nguyên tố Fluorine.
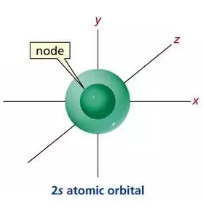
Thông tin về một nguyên tử của nguyên tố Fluorine. Số neutron và số electron của nguyên tử Fluorine trên lần lượt là A. 9 và 19. B. 10 và 9. C. 10 và 19. D. 9 và 10. Câu 4: Một nguyên tử của nguyên tố X có 75 electron và 110 neutron. Kí hiệu nguyên tử của nguyên tố X là A. \(_{110}^{185}X\). B. \(_{185}^{185}X\). C. \(_{75}^{185}X\). D. \(_{185}^{{\rm{ }}75}X\). Câu 5: Trong các AO sau, AO nào là AOs ? A. Chỉ có 1 B. Chỉ có 2 C. Chỉ có 3 D. Chỉ có 4 Câu 6: Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p64s1. Số hiệu nguyên tử của X là A. 20 B. 19 C. 39 D. 18 Câu 7: Số electron tối đa trên orbital 2s là bao nhiêu? A. 8. B. 6. C. 3. D. 2.
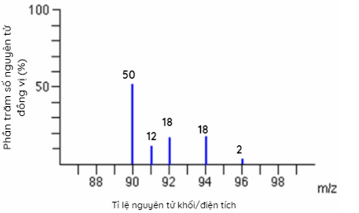
Orbital 2s Câu 8: Cấu hình electron của nguyên tử một nguyên tố là 1s22s22p63s23p64s2. Nguyên tố đó là A. Ca B. Ba C. Sr D. Mg Câu 9: Nguyên tố hóa học nào sau đây thuộc khối nguyên tố p ? A. Fe (Z = 26) B. Na (Z=11) C. Ca (Z=20) D. Cl (Z=17) Câu 10: Cho phổ khối của nguyên tố A được biểu diễn tại hình bên dưới. Nguyên tử khối trung bình của A là
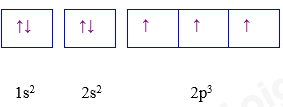
Phổ khối của nguyên tố A. A. 91,32. B. 91,40. C. 90,00. D. 94,23. Câu 11: Cho cấu hình electron nguyên tử của các nguyên tố sau: X. 1s2 2s2 2p6 3s2; Y. 1s2 2s2 2p6 3s2 3p6 4s1; Z. 1s2 2s2 2p6 3s2 3p3; T. 1s2 2s2 2p6 3s2 3p6 3d8 4s2. Dãy cấu hình electron của các nguyên tử nguyên tố kim loại là A. X, Y, Z. B. X, Y, T. C. Y, Z, T. D. X, Z, T. Câu 12: Biết rằng nguyên tố argon có ba đồng vị khác nhau, ứng với số khối 36; 38 và A. Phần trăm các đồng vị tương ứng lần lượt bằng: 0,34% ; 0,06% và 99,6%. Số khối của đồng vị A của nguyên tố argon là bao nhiêu? (cho biết nguyên tử khối trung bình của argon bằng 39,98). A. 39. B. 40. C. 41. D. 42. Câu 13: Cấu hình của nguyên tử sau biểu diễn bằng ô lượng tử. Thông tin nào không đúng khi nói về cấu hình đã cho?
A. Nguyên tử có 7 electron B. Lớp ngoài cùng có 3 electron C. Nguyên tử có 3 electron độc thân D. Nguyên tử có 2 lớp electron Câu 14: Mỗi chu kì (trừ chu kì 1) lần lượt bắt đầu từ loại nguyên tố nào và kết thúc ở nguyên tố nào? A. Kim loại kiềm và halogen. B. Kim loại kiềm thổ và khí hiếm. C. Kim loại kiềm và khí hiếm. D. Kim loại kiềm thổ và halogen Câu 15: Nguyên tố ở chu kì 5, nhóm VIIA có cấu hình electron hoá trị là. A. 4s24p5 B. 5s25p5 C. 4d45s2 D. 7s27p3. Câu 16: Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn là A. 3 và 3. B. 4 và 3. C. 3 và 4. D. 4 và 4. Câu 17: Nguyên tử X có cấu hình electron 1s22s22p63s23p3. X thuộc nhóm A. IIIA. B. IIIB. C. VA. D. VB. Câu 18: Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân A. tính base của các oxide và hyđroxide giảm dần. B. tính base của các oxide và hyđroxide tăng dần C. tính acid của các oxide và hyđroxide không đổi. D. tính acid của các oxide và hyđroxide tăng dần. Câu 19: Trong mỗi chu kỳ, từ trái sang phải theo chiều tăng dần của điện tích hạt nhân thì A. tính kim loại tăng, tính phi kim tăng B. tính kim loại tăng, tính phi kim giảm C. tính kim loại giảm, tính phi kim tăng D. tính kim loại giảm, tính phi kim giảm Câu 20: Cho 4 acid : H2SiO3, HClO4, H2SO4, H3PO4. Hãy chọn acid mạnh nhất : A. H2SiO3 . B. H2SO4. C. HClO4. D. H3PO4. Câu 21: Các nguyên tố: \({}_9^{19}F,{\rm{ }}{}_{14}^{28}Si{\rm{ }},{\rm{ }}{}_{15}^{31}P{\rm{ }},{\rm{ }}{}_8^{16}O\) được sắp xếp theo thứ tự giảm dần hoá trị trong hợp chất khí với hydrogen. Đó là: A. Si , P , O, F. B. F, Si , P , O. C. F, Si , O, P. D. O, F, Si , P. Câu 22: Nguyên tử X có cấu hình electron [Ne]3s23p1. Vị trí của X trong bảng hệ thống tuần hoàn là A. số thứ tự 3, chu kì 3, nhóm IIIA. B. số thứ tự 11, chu kì 3, nhóm IIIA. C. số thứ tự 13, chu kì 2, nhóm IA. D. số thứ tự 13, chu kì 3, nhóm IIIA. Câu 23: Hợp chất khí với H của R có dạng RH4, công thức oxide cao nhất của R có dạng: A. R2O5. B. RO2. C. R2O3. D. R2O7 Câu 24: Sắp xếp các hydroxide NaOH, Al(OH)3, Mg(OH)2 theo chiều tăng dần tính base A. NaOH, Mg(OH)2, Al(OH)3. B. Mg(OH)2, Al(OH)3, NaOH. C. Al(OH)3, Mg(OH)2, NaOH. D. NaOH, Al(OH)3, Mg(OH)2. Câu 25: Nguyên tố X thuộc nhóm VA của bảng tuần hoàn các nguyên tố hóa học. Công thức hydroxide của X có dạng A. HXO. B. HXO3. C. H2XO4. D. H3XO4. Câu 26: Độ âm điện đặc trưng cho khả năng A. hút electron của nguyên tử trong phân tử. B. nhường electron của nguyên tử này cho nguyên tử khác. C. tham gia phản ứng mạnh hay yếu. D. nhường proton của nguyên tử này cho nguyên tử khác. Câu 27: Nguyên tắc nào để sắp xếp các nguyên tố trong bảng tuần hoàn sau đây là sai? A. Các nguyên tố được sắp xếp theo chiều tăng dần của khối lượng nguyên tử. B. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân. C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành 1 hàng. D. Các nguyên tố có cùng số electron hoá trị trong nguyên tử được xếp thành một cột. Câu 28: Số thứ tự ô nguyên tố trong bảng hệ thống tuần hoàn bằng A. số hiệu nguyên tử B. số khối C. số nơtron D. khối lượng nguyên tử Câu 29: Chỉ ra nội dung sai khi nói về các nguyên tố trong cùng một nhóm : A. Có tính chất hoá học gần giống nhau. B. Nguyên tử của chúng có cấu hình electron tương tự nhau. C. Nguyên tử của chúng có số electron hoá trị bằng nhau. D. Được sắp xếp thành một hàng. Câu 30: Phát biểu nào sau đây không đúng? Trong bảng hệ thống tuần hoàn, các nguyên tố: A. được sắp xếp theo chiều tăng dần điện tích hạt nhân. B. có cùng số lớp electron trong nguyên tử được xếp thành một hàng. C. có cùng số electron ở lớp vỏ ngoài cùng được xếp thành một cột. D. được chia thành 8 nhóm, mỗi nhóm gồm 8 - 18 nguyên tố. Câu 31: Chọn phát biểu không đúng A. Nguyên tử của các nguyên tố trong cùng chu kì đều có số lớp electron bằng nhau. B. Tính chất hóa học của các nguyên tố trong cùng chu kì nhìn chung tương tự nhau. C. Nguyên tử của các nguyên tố trong cùng nhóm có số electron lớp ngoài cùng nhìn chung bằng nhau. D. Tính chất của các nguyên tố trong cùng nhóm là tương tự nhau. Câu 32: Ba nguyên tố với số hiệu nguyên tử Z =11; Z =12; Z =13 có hydroxide tương ứng là X,Y,T. Chiều tăng dần tính base của các hydroxide này là A. X,Y,T B.X,T,Y C. T,X,Y D. T,Y,X Câu 33: Anion X- có cấu hình electron của phân lớp ngoài cùng là 2p6.Vị trí của X trong bảng tuần hoàn A. Chu kì 3, nhóm IIA B. Chu kì 3,nhóm IVA C. Chu kì 2,nhóm IVA D. Chu kì 2, nhóm VIIA Câu 34: Một nguyên tố R có cấu hình electron: 1s22s22p3, công thức oxide cao nhất và hợp chất khí với hydrogen và lần lượt là: A. R2O5, RH5. B. R2O3, RH. C. R2O7, RH. D. R2O5, RH3 Câu 35: Chọn phát biểu không đúng A. Nguyên tử có bán kính nhỏ nhất có Z =1 B. Kim loại yếu nhất trong nhóm IA có Z =3 C. Nguyên tố có độ âm điện lớn nhất có Z =9 D. Phi kim mạnh nhất trong nhóm VA có Z =7. Câu 36: Liên kết cộng hóa trị không phân cực thường là liên kết giữa: A. Hai kim loại giống nhau. B. Hai phi kim giống nhau. C. Một kim loại mạnh và một phi kim mạnh. D. Một kim loại yếu và một phi kim yếu. Câu 37: Cho giá trị độ âm điện của các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion? A. NaF. B. CO2. C. CH4. D. H2O. Câu 38: Liên kết hóa học giữa các nguyên tử trong phân tử H2S là loại liên kết nào sau đây (biết độ âm điện của nguyên tử H là 2,2 và S là 2,58): A. Liên kết ion. B. Liên kết cộng hóa trị phân cực. C. Liên kết hiđro. D. Liên kết cộng hóa trị không phân cực. Câu 39: Phân tử KF có kiểu liên kết : A. cộng hóa trị B. cộng hóa trị phân cực C. ion D. cho – nhận Câu 40: Các chất mà phân tử không phân cực là: A. HBr, CO2, CH4. B. Cl2, CO2, C2H2. C. NH3, Br2, C2H4. D. HCl, C2H2, Br2. Câu 41: Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là A. 2. B. 3. C. 4. D. 5. Câu 42: Nhóm chất nào sau đây có liên kết “cho – nhận”? A. NaCl, CO2. B. HCl, MgCl2. C. H2S, HCl. D. NH4NO3, HNO3. Câu 43: Cho các chất sau: CO, O3, CO2, HNO3, PCl5, NH4Cl, NaNO3, H2O2. Số chất có chứa liên kết cho – nhận ( liên kết phối – trí ) là: A. 4. B. 3. C. 6. D. 5. Câu 44: Tính chất nào sau đây là tính chất của hợp chất ion? A. Hợp chất ion có nhiệt độ nóng chảy thấp. B. Hợp chất ion có nhiệt độ nóng chảy cao. C. Hợp chất ion dễ hoá lỏng. D. Hợp chất ion có nhiệt độ sôi không xác định. Câu 45: Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của A. các nguyên tử trong phân tử. B. các electron trong phân tử. C. các proton trong hạt nhân. D. các neutron và proton trong hạt nhân Câu 46: Sơ đồ nào sau đây thể hiện đúng liên kết giữa 2 phân tử hydrogen fluoride (HF)?
Câu 47: Công thức electron nào sau đây không đủ electron theo quy tắc octet?
Câu 48: Vì sao các nguyên tử lại liên kết với nhau thành phân tử? A. Để mỗi nguyên tử trong phân tử đều đạt 8 electron ở lớp ngoài cùng. B. Để tổng số electron ngoài cùng của các nguyên tử trong phân tử là 8. C. Để lớp ngoài cùng của mỗi nguyên tử trong phân tử có nhiều electron độc thân nhất. D. Để mỗi nguyên tử trong phân tử đạt được cấu hình electron ổn định, bền vững. Câu 49: Nguyên tử nào trong các nguyên tử sau đây không có xu hướng nhường electron để đạt lớp vỏ thỏa mãn quy tắc octet? A. Calcium. B. Magnesium. C. Potassium. D. Chlorine. Câu 50: Liên kết hydrogen là loại liên kết hóa học được hình thành giữa các nguyên tử nào sau đây? A. Phi kim và hydrogen trong hai phân tử khác nhau. B. Phi kim và hydrogen trong cùng một phân tử. C. Phi kim có độ âm điện lớn và nguyên tử hydrogen. D. F, O, N,… có độ âm điện lớn, đồng thời có cặp electron hóa trị chưa liên kết và nguyên tử hydrogen linh động. II. Tự luậnCâu 1: Nguyên tử của nguyên tố X có tổng số hạt p, n, e là 40, trong đó số hạt không mang điện hơn số hạt mang điện dương là 1 hạt. (a) Xác định số p, n, e và viết kí hiệu nguyên tử của nguyên tố X. (b) Viết cấu hình electron của X và cho biết vị trí của X trong bảng tuần hoàn. Câu 2: Hai nguyên tố X và Y (ZX < ZY) ở hai nhóm A liên tiếp trong bảng tuần hoàn và thuộc cùng chu kì. Tổng số proton trong hạt nhân nguyên tử của X và Y là 33. Xác định tên hai nguyên tố X, Y. Câu 3: Cho 2 gam hỗn hợp hai kim loại X, Y ở hai chu kì liên tiếp và thuộc nhóm IIA tác dụng với dung dịch H2SO4 10%. Sau phản ứng thu được dung dịch Z và 1,568 lít khí H2 (đktc). (a) Xác định hai kim loại X, Y. (b) Tính khối lượng dung dịch H2SO4 đã dùng biết H2SO4 lấy dư 20% so với lượng phản ứng. Câu 4: Cho biết tổng số electron trong ion XY32- là 42. Trong các hạt nhân của X cũng như Y số proton bằng số nơtron. Xác định số khối của X, Y và công thức của ion trên. Biết số khối của X gấp đôi của Y. Câu 5: Chất X tạo ra từ 3 nguyên tố A, B, C có công thức phân tử là ABC. Tổng số hạt cơ bản (proton, neutron, electron) trong phân tử X là 82, trong đó số hạt mạng điện nhiều hơn số hạt không mang điện là 22. Hiệu số khối giữa nguyên tử B và nguyên tử C gấp 10 lần số khối của nguyên tử A. Tổng số khối của nguyên tử B và nguyên tử C gấp 27 lần số khối của nguyên tử A. Xác định công thức phân tử của chất X. Câu 6: Trong tự nhiên Chlorine có 2 đồng vị bền: \(\,{}_{{\rm{17}}}^{{\rm{35}}}{\rm{Cl}}\) chiếm 75,77% và\(\,{}_{{\rm{17}}}^{{\rm{37}}}{\rm{Cl}}\) chiếm 24,23%. a) Tính nguyên tử khối trung bình của Chlorine b) Tính thể tích của 24,836 gam khí clo ở đkc. c) Tính phần trăm khối lượng đồng vị \(\,{}_{{\rm{17}}}^{{\rm{35}}}{\rm{Cl}}\)trong phân tử HClO4 Câu 7: Cho các nguyên tố X (Z = 17); A (Z = 11); M (Z = 8). (a) Viết cấu hình electron nguyên tử của các nguyên tố đó và cho biết nguyên tố nào là nguyên tố kim loại? nguyên tố nào là nguyên tố phi kim? (b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và M, X và M. Câu 8: Dự đoán kiểu liên kết hóa học và biểu diễn sự hình thành liên kết trong các phân tử sau đây: NaCl, CaO, PH3, H2O, N2, Br2. Câu 9: Viết công thức Lewis và công thức cấu tạo của các phân tử sau: H2, HF, CO, HNO3, H2SO4. Câu 10: Phân tử hợp chất M tạo bởi 4 nguyên tử của 2 nguyên tố phi kim R và Y (số hiệu nguyên tử của R nhỏ hơn số hiệu nguyên tử của Y). Tổng số hạt mang điện trong phân tử M là 20. a) Xác định công thức phân tử của hợp chất M ? b) Viết công thức electron, công thức Lewis và công thức cấu tạo của hợp chất M. c) Các liên kết trong phân tử M hình thành do sự xen phủ nào ? Sự xen phủ đó giữa oribtal s-s, p-p hay s-p ? d) Sắp xếp theo chiều giảm dần nhiệt độ sôi của của hợp chất M với CH4 (methane) và H2O (nước) ? Giải thích ? Lời giải chi tiếtPhần trắc nghiệm
Phần tự luậnCâu 1: Nguyên tử của nguyên tố X có tổng số hạt p, n, e là 40, trong đó số hạt không mang điện hơn số hạt mang điện dương là 1 hạt. (a) Xác định số p, n, e và viết kí hiệu nguyên tử của nguyên tố X. (b) Viết cấu hình electron của X và cho biết vị trí của X trong bảng tuần hoàn. Lời giải chi tiết (a) Tổng số hạt p, n, e : 2Z + N = 40 (1) Số hạt không mang điện hơn số hạt mang điện dương: N - Z = 1 (2) Giải hệ (1), (2) ⇒\(\left\{ \begin{array}{l}Z = P = E = 13\\N = 14\end{array} \right. \Rightarrow A = 13 + 14 = 27\, \Rightarrow \,{}_{13}^{27}Al\) (b) A (Z = 13): 1s22s22p63s23p1: Ô số 13, chu kì 3, nhóm IIIA. Câu 2: Hai nguyên tố X và Y (ZX < ZY) ở hai nhóm A liên tiếp trong bảng tuần hoàn và thuộc cùng chu kì. Tổng số proton trong hạt nhân nguyên tử của X và Y là 33. Xác định tên hai nguyên tố X, Y. Lời giải chi tiết - X, Y thuộc cùng chu kì và 2 nhóm A liên tiếp nên ta có : ZY – ZX = 1 (1) - Tổng số proton của X và Y : ZX + ZY = 33 (2) - Giải hệ (1), (2) ⇒\(\left\{ \begin{array}{l}{Z_X} = 16\, \Rightarrow \,X\,:{\rm{(S)}}{\rm{.}}\\{Z_Y} = 17\, \Rightarrow \,{\rm{Y: (Cl)}}{\rm{.}}\end{array} \right.\) Câu 3: Cho 2 gam hỗn hợp hai kim loại X, Y ở hai chu kì liên tiếp và thuộc nhóm IIA tác dụng với dung dịch H2SO4 10%. Sau phản ứng thu được dung dịch Z và 1,568 lít khí H2 (đktc). (a) Xác định hai kim loại X, Y. (b) Tính khối lượng dung dịch H2SO4 đã dùng biết H2SO4 lấy dư 20% so với lượng phản ứng. Lời giải chi tiết (a) \({n_{{H_2}}} = \frac{{1,568}}{{22,4}} = 0,07\,mol.\) - Gọi công thức chung của hai kim loại X, Y là R (hóa trị II). PTHH: R + H2SO4 → RSO4 + H2↑ 0,07 0,07 0,07 (mol) Theo PTHH ta có: \({n_R} = {n_{{H_2}}} = 0,07\,mol\, \Rightarrow \,\overline {{M_R}} = \frac{2}{{0,07}} = 28,57\)⇒ Hai kim loại cần tìm là \(\left\{ \begin{array}{l}Mg\,(M = 24)\\Ca\,(M = 40)\end{array} \right.\) (b) Theo PTHH ta có : Vì lượng H2SO4 đã dùng dư 20% so với lượng phản ứng nên \({m_{{{\rm{H}}_{\rm{2}}}{\rm{S}}{{\rm{O}}_{\rm{4}}}\,{\rm{ban}}\,dau}} = 6,86 + 20\% .6,86 = 8,232\,gam.\) Khối lượng dung dịch H2SO4 đã dùng là \(\frac{{8,232}}{{10\% }} = 82,32\,gam.\) Câu 4: Cho biết tổng số electron trong ion XY32- là 42. Trong các hạt nhân của X cũng như Y số proton bằng số nơtron. Xác định số khối của X, Y và công thức của ion trên. Biết số khối của X gấp đôi của Y. Lời giải chi tiết Tổng số electron trong ion XY32- là 42 \( \Rightarrow \) Tổng số electron trong XY3là 40 Ta có \(\left\{ \begin{array}{l}{Z_X} + 3{Z_Y} = 40\\{A_X} = 2{A_Y}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{Z_X} + 3{Z_Y} = 40\\2{Z_X} = 4{Z_Y}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{Z_X} = 16\\{Z_Y} = 8\end{array} \right. \Rightarrow \left\{ \begin{array}{l}{A_X} = 32\\{A_Y} = 16\end{array} \right.\) \( \Rightarrow \) X là S, Y là O \( \Rightarrow \) Ion XY32- là SO32- Câu 5: Chất X tạo ra từ 3 nguyên tố A, B, C có công thức phân tử là ABC. Tổng số hạt cơ bản (proton, neutron, electron) trong phân tử X là 82, trong đó số hạt mạng điện nhiều hơn số hạt không mang điện là 22. Hiệu số khối giữa nguyên tử B và nguyên tử C gấp 10 lần số khối của nguyên tử A. Tổng số khối của nguyên tử B và nguyên tử C gấp 27 lần số khối của nguyên tử A. Xác định công thức phân tử của chất X. Lời giải chi tiết Gọi số proton, neutron của A, B, C lần lượt là ZA, ZB, ZC, NA,NB, NC. Theo dữ kiện đề bài ta có hệ 4 phương trình sau: 2(ZA + ZB + ZC) + (NA + NB + NC) = 82 2(ZA + ZB + ZC) - (NA + NB + NC) = 22 (ZB + NB) - (ZC + NC) = 10(ZA + NA) (ZB + NB) + (ZC + NC) = 27(ZA + NA) Giải hệ phương trình trên ta được: ZA + NA = 2; ZB + NB = 37; ZC + NC = 17. Vậy: A là H, B là Cl, C là O. Công thức của X là HClO Câu 6: Trong tự nhiên Chlorine có 2 đồng vị bền: \(\,{}_{{\rm{17}}}^{{\rm{35}}}{\rm{Cl}}\) chiếm 75,77% và\(\,{}_{{\rm{17}}}^{{\rm{37}}}{\rm{Cl}}\) chiếm 24,23%. a) Tính nguyên tử khối trung bình của Chlorine b) Tính thể tích của 24,836 gam khí clo ở đkc. c) Tính phần trăm khối lượng đồng vị \(\,{}_{{\rm{17}}}^{{\rm{35}}}{\rm{Cl}}\)trong phân tử HClO4 Lời giải chi tiết a)\({\mathop A\limits^{\_\_\_} _{Cl}} = \frac{{35.75,77 + 37.24,23}}{{100}} = 35,48\) b) \({n_{C{l_2}}} = \frac{{{m_{C{l_2}}}}}{{{M_{C{l_2}}}}} = \frac{{24,836}}{{35,48.2}} = 0,35\,mol\) => \({V_{C{l_2}}} = {n_{C{l_2}}}.24,79\) = 0,35.24,79 = 8,6765 lít c) \({\rm{\% }}{{\rm{m}}_{^{35}Cl/HCl{O_4}}}{\rm{ = }}\frac{{{\rm{35}}{\rm{.1}}{\rm{.75,77}}}}{{1 + 35,48 + 16.4}}(\% ) = 26,39\% \) Câu 7: Cho các nguyên tố X (Z = 17); A (Z = 11); M (Z = 8). (a) Viết cấu hình electron nguyên tử của các nguyên tố đó và cho biết nguyên tố nào là nguyên tố kim loại? nguyên tố nào là nguyên tố phi kim? (b) Dự đoán liên kết hóa học có thể có giữa các cặp X và A, A và M, X và M. Lời giải chi tiết a) Nguyên tố X có Z = 17 => X là chlorine cấu hình electron: 1s2 2s2 2p6 3s2 3p5 Nguyên tố A có Z = 11 => A là sodium Cấu hình electron: 1s2 2s2 2p6 3s1 Nguyên tố M có Z = 8 => M là oxygen Cấu hình electron: 1s2 2s2 2p4 Nguyên tố kim loại: Na Nguyên tố phi kim: Cl, O b) Liên kết giữa X và A (NaCl) chứa liên kết ion Liên kết giữa A và M (Na2O) chứa liên kết ion Liên kết giữa X và M (Cl2O7) chứa liên kết cộng hóa trị Câu 8: Dự đoán kiểu liên kết hóa học và biểu diễn sự hình thành liên kết trong các phân tử sau đây: NaCl, CaO, PH3, H2O, N2, Br2. Lời giải chi tiết NaCl: Na+ – Cl- => liên kết ion CaO: Ca2+ - O2- => liên kết ion PH3: \(\begin{array}{l}H:P:H\\{\rm{ :}}\\{\rm{ H}}\end{array}\)=> liên kết cộng hóa trị H2O : H : O : H => liên kết cộng hóa trị N2: N \( \equiv \)N => liên kết cộng hóa trị Br2: Br : Br => liên kết cộng hóa trị Câu 9: Viết công thức Lewis và công thức cấu tạo của các phân tử sau: H2, HF, CO, HNO3, H2SO4. Lời giải chi tiết
Câu 10: Phân tử hợp chất M tạo bởi 4 nguyên tử của 2 nguyên tố phi kim R và Y (số hiệu nguyên tử của R nhỏ hơn số hiệu nguyên tử của Y). Tổng số hạt mang điện trong phân tử M là 20. a) Xác định công thức phân tử của hợp chất M ? b) Viết công thức electron, công thức Lewis và công thức cấu tạo của hợp chất M. c) Các liên kết trong phân tử M hình thành do sự xen phủ nào ? Sự xen phủ đó giữa oribtal s-s, p-p hay s-p ? d) Sắp xếp theo chiều giảm dần nhiệt độ sôi của của hợp chất M với CH4 (methane) và H2O (nước) ? Giải thích ? Lời giải chi tiết a) Ta có 2PM = 20 => PM = 10 Vì M có 4 nguyên tử => trung bình 1 nguyên tử có 10: 4 = 2,5 proton => phải có nguyên tử H => Công thức của M: RH3 => PR + 3 = 10 => PR = 7 (N) => R là N => Công thức của M là NH3 b) c) Vì nguyên tử H chỉ có orbital s nên liên kết trong phân tử M hình thành do sự xen phủ s – s d) Nhiệt độ sôi giảm dần là: H2O > NH3 > CH4 Vì NH3, H2O có khả năng liên kết hydrogen liên phân tử nên nhiệt độ sôi cao hơn CH4 O có độ âm điện cao hơn N => nhiệt độ sôi của H2O cao hơn NH3
|