Đề thi học kì 2 Hóa học 10 Kết nối tri thức - Đề 1Tải về Trong phản ứng oxi hóa – khử, chất oxi hóa là chất Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Đề bài Phần trắc nghiệm (7 điểm) Câu 1. Trong phản ứng oxi hóa – khử, chất oxi hóa là chất A. nhận electron. B. nhường proton. C. nhường electron. D. nhận proton. Câu 2. Trong phản ứng hóa học: Fe + H2SO4 → FeSO4 + H2, mỗi nguyên tử Fe đã A. nhường 2 electron. B. nhận 2 electron. C. nhường 1 proton. D. nhận 1 electron. Câu 3. Số oxi hóa của S trong các hợp chất H2S, SO2 lần lượt là A. -2, + 4. B. -4, +2. C. -2, -6. D. -2, -4. Câu 4. Cho phản ứng sau: NH3 + O2 →NO + H2O. NH3 đóng vai trò là A. chất oxi hóa. B. chất khử. C. chất tạo môi trường. D. chất nhận electron. Câu 5. Xét phản ứng: Fe + HNO3 → Fe(NO3)3 + NO + H2O. Tổng hệ số cân bằng của phản ứng (tối giản) là A. 9 B. 10 C. 11 D. 12 Câu 6. Phản ứng giải phóng năng lượng dưới dạng nhiệt gọi là A. phản ứng thu nhiệt. B. phản ứng tỏa nhiệt. C. phản ứng oxi hóa – khử. D. phản ứng phân hủy. Câu 7. Phản ứng xảy ra khi pin được sử dụng trong điện thoại, máy tính, …. giải phóng năng lượng dưới dạng A. nhiệt năng. B. điện năng. C. cơ năng. D. hóa năng. Câu 8. Cho phản ứng: H2 (g) + Cl2 (g) → 2HCl (g). Ở điều kiện chuẩn, cứ 1 mol H2 phản ứng hết sẽ tỏa ra -184,6 kJ. Tính enthalpy tạo thành chuẩn của HCl (g). A. 92,3 kJ.mol-1. B. -92,3 kJ.mol-1. C. 184,6 kJ.mol-1. D. -184,6 kJ.mol-1. Câu 9. Phát biểu nào sau đây là không đúng? A. Biến thiên enthalpy càng âm, phản ứng tỏa ra cành nhiều nhiệt. B. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt. C. Với phản ứng tỏa nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm. D. Với phản ứng thu nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm. Câu 10. Cho phản ứng sau: H2 (g)+ Cl2 (g) → 2HCl = -184,6 kJ. Phản ứng trên là A. phản ứng thu nhiệt. B. phản ứng tỏa nhiệt. C. phản ứng thế. D. phản ứng phân hủy Câu 11. Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây? A. Tốc độ phản ứng. B. Phản ứng một chiều. C. Cân bằng hóa học. D. Phản ứng thuận nghịch. Câu 12. Hoàn thành phát biểu về tốc độ phản ứng sau: “Tốc độ phản ứng được xác định bởi độ biến thiên ..(1)… của (2) trong một đơn vị ..(3)…” A. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thể tích. B. (1) thời gian, (2) một chất sản phẩm, (3) nồng độ. C. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thời gian. D. (1) thời gian, (2) các chất phản ứng, (3) thể tích. Câu 13. Các yếu tố ảnh hưởng đến tốc độ phản ứng là A. nồng độ, nhiệt độ, chất xác tác, áp suất, diện tích bề mặt. B. nồng độ, nhiệt độ, thời gian phản ứng, chất xúc tác. C. nhiệt độ, thời gian phản ứng, chất xúc tác, diện tích bề mặt. D. nồng độ, thời gian phản ứng, áp suất, chất xúc tác. Câu 14. Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ của phản ứng lớn nhất khi dùng nhôm ở dạng nào sau đây? A. Dạng viên nhỏ. B. Dạng tấm mỏng. C. Dạng bột mịn, khuấy đều. D. Dạng nhôm dây. Câu 15. Xét phản ứng đơn giản sau: aA + bB → sản phẩm. Công thức tính tốc độ phản ứng nào sau đây đúng? \[\begin{array}{l}A.v = k.C_A^a.C_B^b\\B.v = k.C_A^2.C_B^2\\C.v = k.C_A^b.C_B^a\\D.v = k.{C_A}.{C_B}\end{array}\] Câu 16. Các nguyên tố halogen thuộc nhóm A. IA B. IIA C. VIIA D. VIA Câu 17. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là A. ns2np4. B. ns2np5. C. ns2np3. D. ns2np6. Câu 18. Trong tự nhiên, halogen tồn tại ở dạng A. đơn chất. B. muối halogenua. C. oxit. D. cả đơn chất và hợp chất Câu 19. Đơn chất halogen tồn tại thể lỏng ở điều kiện thường là A. F2 B. Cl2 C. Br2 D. I2 Câu 20. Liên kết trong các phân tử đơn chất halogen thuộc loại liên kết A. cho – nhận. B. ion. C. cộng hóa trị phân cực. D. cộng hóa trị không phân cực. Câu 21. Phản ứng của khí Cl2 với khí H2 xảy ra ở điều kiện nào sau đây? A. Nhiệt độ thấp dưới 0oC. B. Trong bóng tối, nhiệt độ thường 25oC. C. Trong bóng tối. D. Có chiếu sáng. Câu 22. Phản ứng nào sau đây chứng tỏ HCl có tính khử? A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O. B. 2HCl + Mg(OH)2 → MgCl2 + 2H2O. C. 2HCl + CuO → CuCl2 + H2O. D. 2HCl + Zn → ZnCl2 + H2. Câu 23. Một mol chất nào sau đây tác dụng hết với HCl đặc cho lượng khí Cl2 lớn nhất? A. MnO2 B. KMnO4 C. KClO3 D. CaOCl2 Câu 24. Cho 15,8 gam KMnO4 tác dụng hết với dung dịch HCl đậm đặc. Giả sử hiệu suất phản ứng là 100% thì thể tích (đktc) khí Cl2 thu được là A. 5,6 lít. B. 0,56 lít. C. 2,8 lít. D. 0,28 lít. Câu 25. Trong dãy đơn chất từ F2 đến I2, chất có tính oxi hóa mạnh nhất là A. F2 B. Cl2 C. Br2 D. I2 Câu 26. Đối với phản ứng có chất khí tham gia phản ứng thì A. khi áp suất tăng, tốc độ phản ứng giảm. B. khi áp suất tăng, tốc độ phản ứng tăng. C. khi áp suất giảm, tốc độ phản ứng tăng. D. áp suất không ảnh hưởng đến tốc độ phản ứng. Câu 27. Không sử dụng chai, lọ thủy tinh mà thường dùng chai nhựa để chứa đựng, bảo quản hydrohalic acid nào sau đây? A. HF. B. HCl. C. HBr. D. HI. Câu 28. Phát biểu nào sau đây là không đúng? A. Dung dịch hydrofluoric acid có khả năng ăn mòn thủy tinh. B.NaCl rắn tác dụng với H2SO4 đặc, nóng thu được hydrogen chloride. C. Hydrogen chloride tan nhiều trong nước. D. Lực acid trong dãy hydrohalic acid giảm dần từ HF đến HI. Phần tự luận (3 điểm) Câu 1: Hoàn thành PTHH sau bằng phương pháp thăng bằng electron. 1. Cu + H2SO4 → CuSO4 + SO2 + H2O. 2. MnO2 + HCl MnCl2 + Cl2 + H2O Câu 2: Khí H2 có thể được điều chế bằng cách cho miếng sắt vào dung dịch HCl. Hãy đề xuất các biện pháp khác nhau để làm tăng tốc độ điều chế khí H2 ở trên. Câu 3: Cho từ từ đến hết 10 gam dung dịch X gồm NaF 0,84% và NaCl 1,17% vào dung dịch AgNO3 dư, thu được m gam kết tủa. Tính giá trị của m. -------- Hết -------- Phương pháp giải:
Lời giải chi tiết:
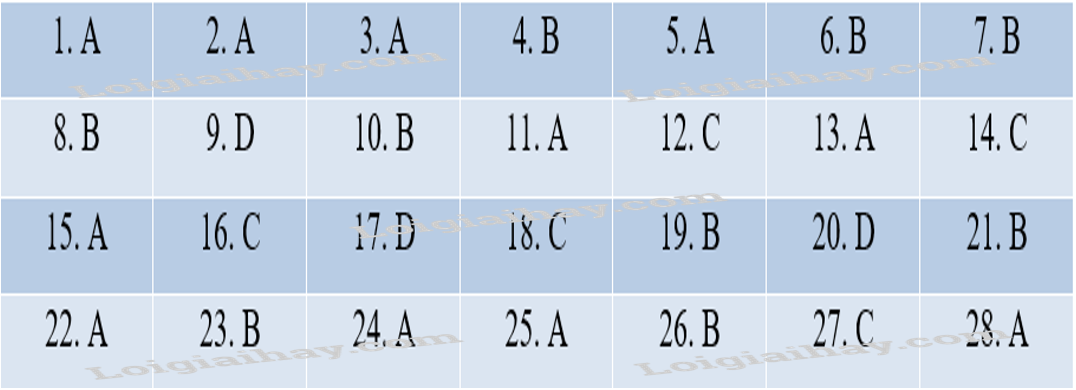
Đáp án Phần trắc nghiệm (7 điểm) Câu 1. Trong phản ứng oxi hóa – khử, chất oxi hóa là chất A. nhận electron. B. nhường proton. C. nhường electron. D. nhận proton. Phương pháp giải: Chất oxi hóa là chất nhận electron. Chất khử là chất nhường electron. Lời giải chi tiết: Đáp án A. Câu 2. Trong phản ứng hóa học: Fe + H2SO4 → FeSO4 + H2, mỗi nguyên tử Fe đã A. nhường 2 electron. B. nhận 2 electron. C. nhường 1 proton. D. nhận 1 electron. Phương pháp giải: Số oxi hóa của Fe = 0; Fe trong FeSO4 = + 2 → Fe nhường 2 electron. Lời giải chi tiết: Đáp án A. Câu 3. Số oxi hóa của S trong các hợp chất H2S, SO2 lần lượt là A. -2, + 4. B. -4, +2. C. -2, -6. D. -2, -4. Phương pháp giải: - Trong hầu hết các hợp chất: + Số oxi hóa của H là + 1. + Số oxi hóa của O là -2. - Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0. - Các kim loại điển hình có số oxi hóa dương và bằng số electron hóa trị. Lời giải chi tiết: Đáp án A. Câu 4. Cho phản ứng sau: NH3 + O2 →NO + H2O. NH3 đóng vai trò là A. chất oxi hóa. B. chất khử. C. chất tạo môi trường. D. chất nhận electron. Phương pháp giải: - Chất khử là chất nhường electron. - Chất oxi hóa là chất nhận electron. Lời giải chi tiết: Đáp án B. Câu 5. Xét phản ứng: Fe + HNO3 → Fe(NO3)3 + NO + H2O. Tổng hệ số cân bằng của phản ứng (tối giản) là A. 9 B. 10 C. 11 D. 12 Phương pháp giải: - Dựa vào phương pháp thăng bằng electron. Lời giải chi tiết: Đáp án A. Câu 6. Phản ứng giải phóng năng lượng dưới dạng nhiệt gọi là A. phản ứng thu nhiệt. B. phản ứng tỏa nhiệt. C. phản ứng oxi hóa – khử. D. phản ứng phân hủy. Phương pháp giải: - Phản ứng tỏa nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt. - Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt. Lời giải chi tiết: Đáp án B. Câu 7. Phản ứng xảy ra khi pin được sử dụng trong điện thoại, máy tính, …. giải phóng năng lượng dưới dạng A. nhiệt năng. B. điện năng. C. cơ năng. D. hóa năng Phương pháp giải: - Khi pin được sử dụng sẽ giải phóng năng lượng dưới dạng điện năng. Lời giải chi tiết: Đáp án B. Câu 8. Cho phản ứng: H2 (g) + Cl2 (g) → 2HCl (g). Ở điều kiện chuẩn, cứ 1 mol H2 phản ứng hết sẽ tỏa ra -184,6 kJ. Tính enthalpy tạo thành chuẩn của HCl (g). A. 92,3 kJ.mol-1. B. -92,3 kJ.mol-1. C. 184,6 kJ.mol-1. D. -184,6 kJ.mol-1. Phương pháp giải: Có: \({\Delta _r}H\)= \({\Delta _f}H\)(sp) - \({\Delta _f}H\)(cđ). Trong tính toàn cần lưu ý đến hệ số của các chất. → -184,6 = (HCl) - (H2) - (Cl2) → -184,6 = (HCl) - 0 - 0 → (HCl) = -92,3 kJ/mol. Lời giải chi tiết: Đáp án B. Câu 9. Phát biểu nào sau đây là không đúng? A. Biến thiên enthalpy càng âm, phản ứng tỏa ra cành nhiều nhiệt. B. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt. C. Với phản ứng tỏa nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm. D. Với phản ứng thu nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm. Phương pháp giải: Với phản ứng thu nhiệt, năng lượng của hệ chất phản ứng thấp hơn năng lượng của hệ sản phẩm, do đó phản ứng diễn ra kèm theo sự hấp thu năng lượng dưới dạng nhiệt. Lời giải chi tiết: Đáp án D. Câu 10. Cho phản ứng sau: H2 (g)+ Cl2 (g) → 2HCl \({\Delta _r}H\)= -184,6 kJ. Phản ứng trên là A. phản ứng thu nhiệt. B. phản ứng tỏa nhiệt. C. phản ứng thế. D. phản ứng phân hủy. Phương pháp giải: \({\Delta _r}H\) > 0: Phản ứng thu nhiệt. \({\Delta _r}H\)< 0: Phản ứng tỏa nhiệt. Lời giải chi tiết: Đáp án B. Câu 11. Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây? A. Tốc độ phản ứng. B. Phản ứng một chiều. C. Cân bằng hóa học. D. Phản ứng thuận nghịch. Phương pháp giải: Tốc độ phản ứng đặc trưng cho sự nhanh chậm của một phản ứng hóa học. Lời giải chi tiết: Đáp án A. Câu 12. Hoàn thành phát biểu về tốc độ phản ứng sau: “Tốc độ phản ứng được xác định bởi độ biến thiên ..(1)… của (2) trong một đơn vị ..(3)…” A. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thể tích. B. (1) thời gian, (2) một chất sản phẩm, (3) nồng độ. C. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thời gian. D. (1) thời gian, (2) các chất phản ứng, (3) thể tích. Phương pháp giải: Tốc độ phản ứng được xác định bởi biến thiên nồng độ của một chất phản ứng hoặc sản phẩm trong một đơn vị thời gian. Lời giải chi tiết: Đáp án C. Câu 13. Các yếu tố ảnh hưởng đến tốc độ phản ứng là A. nồng độ, nhiệt độ, chất xác tác, áp suất, diện tích bề mặt. B. nồng độ, nhiệt độ, thời gian phản ứng, chất xúc tác. C. nhiệt độ, thời gian phản ứng, chất xúc tác, diện tích bề mặt. D. nồng độ, thời gian phản ứng, áp suất, chất xúc tác. Phương pháp giải: 5 yếu tố ảnh hưởng đến tốc độ phản ứng: + Nồng độ. + Nhiệt độ. + Chất xúc tác. + Áp suất. + Diện tích bề mặt. Lời giải chi tiết: Đáp án A. Câu 14. Khi cho cùng một lượng nhôm vào cốc đựng dung dịch axit HCl 0,1M, tốc độ của phản ứng lớn nhất khi dùng nhôm ở dạng nào sau đây? A. Dạng viên nhỏ. B. Dạng tấm mỏng. C. Dạng bột mịn, khuấy đều. D. Dạng nhôm dây. Phương pháp giải: - Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng: Nếu kích thước của hạt càng nhỏ thì tổng diện tích bề mặt càng lớn → Tốc độ phản ứng tăng. Lời giải chi tiết: Đáp án C. Câu 15. Xét phản ứng đơn giản sau: aA + bB → sản phẩm. Công thức tính tốc độ phản ứng nào sau đây đúng? \[\begin{array}{l}A.v = k.C_A^a.C_B^b\\B.v = k.C_A^2.C_B^2\\C.v = k.C_A^b.C_B^a\\D.v = k.{C_A}.{C_B}\end{array}\] Phương pháp giải: Công thức tính tốc độ phản ứng: Lời giải chi tiết: Đáp án A. Câu 16. Các nguyên tố halogen thuộc nhóm A. IA B. IIA C. VIIA D. VIA Phương pháp giải: Các nhóm halogen thuộc nhóm VIIA trong bảng tuần hoàn. Lời giải chi tiết: Đáp án C. Câu 17. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là A. ns2np4. B. ns2np5. C. ns2np3. D. ns2np6. Phương pháp giải: Các nguyên tố halogen thuộc nhóm VIIA → có 7 elelectron lớp ngoài cùng. → Cấu hình electron lớp ngoài cùng: ns2np5. Lời giải chi tiết: Đáp án B. Câu 18. Trong tự nhiên, halogen tồn tại ở dạng A. đơn chất. B. muối halogenua. C. oxit. D. cả đơn chất và hợp chất. Phương pháp giải: Trong tự nhiên, halogen chỉ tồn tại ở dạng hợp chất, phần lớn ở dạng muối halide. Lời giải chi tiết: Đáp án B. Câu 19. Đơn chất halogen tồn tại thể lỏng ở điều kiện thường là A. F2 B. Cl2 C. Br2 D. I2 Phương pháp giải: Trạng thái của đơn chất halogen: + F2 : khí + Cl2: khí + Br2: lỏng + I2: rắn Lời giải chi tiết: Đáp án C. Câu 20. Liên kết trong các phân tử đơn chất halogen thuộc loại liên kết A. cho – nhận. B. ion. C. cộng hóa trị phân cực. D. cộng hóa trị không phân cực. Phương pháp giải: Liên kết trong các phân tử đơn chất halogen thuộc loại liên kết cộng hóa trị không phân cực. Lời giải chi tiết: Đáp án D. Câu 21. Phản ứng của khí Cl2 với khí H2 xảy ra ở điều kiện nào sau đây? A. Nhiệt độ thấp dưới 0oC. B. Trong bóng tối, nhiệt độ thường 25oC. C. Trong bóng tối. D. Có chiếu sáng. Phương pháp giải: Điều kiện xảy ra phản ứng: có chiếu sáng. Lời giải chi tiết: Đáp án D. Câu 22. Phản ứng nào sau đây chứng tỏ HCl có tính khử? A. 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O. B. 2HCl + Mg(OH)2 → MgCl2 + 2H2O. C. 2HCl + CuO → CuCl2 + H2O. D. 2HCl + Zn → ZnCl2 + H2. Phương pháp giải: HCl có tính khử → HCl phải nhường electron. Lời giải chi tiết: Đáp án A. Câu 23. Một mol chất nào sau đây tác dụng hết với HCl đặc cho lượng khí Cl2 lớn nhất? A. MnO2 B. KMnO4 C. KClO3 D. CaOCl2 Phương pháp giải: Mn trong KMnO4 nhận nhiều electron nhất (5 electron) nên lượng khí Cl2 thu được là lớn nhất. Lời giải chi tiết: Đáp án C. Câu 24. Cho 15,8 gam KMnO4 tác dụng hết với dung dịch HCl đậm đặc. Giả sử hiệu suất phản ứng là 100% thì thể tích (đktc) khí Cl2 thu được là A. 5,6 lít. B. 0,56 lít. C. 2,8 lít. D. 0,28 lít. Phương pháp giải: - Viết PTHH - Tính số mol của KMnO4 - Dựa vào PTHH suy ra số mol của Cl2. nKMnO4 = 15,8 : 158 = 0,1 mol 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O 0,1 → 0,25 → nCl2 = 0,25 mol → VCl2 = 0,25.22,4 = 5,6 lít. Lời giải chi tiết: Đáp án A. Câu 25. Trong dãy đơn chất từ F2 đến I2, chất có tính oxi hóa mạnh nhất là A. F2 B. Cl2 C. Br2 D. I2 Phương pháp giải: Tính oxi hóa là khả năng nhận electron của nguyên tử. Tính oxi hóa phụ thuộc vào độ âm điện của nguyên tử. Từ F2 đến I2, độ âm điện giảm dần → Tính oxi hóa giảm dần. Lời giải chi tiết: Đáp án A. Câu 26. Đối với phản ứng có chất khí tham gia phản ứng thì A. khi áp suất tăng, tốc độ phản ứng giảm. B. khi áp suất tăng, tốc độ phản ứng tăng. C. khi áp suất giảm, tốc độ phản ứng tăng. D. áp suất không ảnh hưởng đến tốc độ phản ứng. Phương pháp giải: Ảnh hưởng của áp suất đến tốc độ phản ứng: Áp suất tăng → Tốc độ phản ứng tăng. Lời giải chi tiết: Đáp án B. Câu 27. Không sử dụng chai, lọ thủy tinh mà thường dùng chai nhựa để chứa đựng, bảo quản hydrohalic acid nào sau đây? A. HF. B. HCl. C. HBr. D. HI. Phương pháp giải: Thủy tinh có thành phần là SiO2, HF tác dụng với theo PTHH : SiO2 + HF → SiF4 + H2O Nên không dùng chai thủy tinh để đựng HF. Lời giải chi tiết: Đáp án A. Câu 28. Phát biểu nào sau đây là không đúng? A. Dung dịch hydrofluoric acid có khả năng ăn mòn thủy tinh. B. NaCl rắn tác dụng với H2SO4 đặc, nóng thu được hydrogen chloride. C. Hydrogen chloride tan nhiều trong nước. D. Lực acid trong dãy hydrohalic acid giảm dần từ HF đến HI. Phương pháp giải: Lực acid trong dãy hydrohalic acid tăng dần từ hydrofluoric acid (yếu) đến hydroiodic acid (rất mạnh). Lời giải chi tiết: Đáp án D. Phần tự luận. Câu 1. Hoàn thành PTHH sau bằng phương pháp thăng bằng electron. 1. Cu + H2SO4 → CuSO4 + SO2 + H2O. 2. MnO2 + HCl MnCl2 + Cl2 + H2O Phương pháp giải: Sử dụng phương pháp thăng bằng electron để cân bằng PTHH. Lời giải chi tiết: 1. Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O. \(\begin{array}{l}\mathop {Cu}\limits^o \to \mathop {Cu}\limits^{ + 2} + 2e\\\mathop S\limits^{ + 6} + 2e \to \mathop S\limits^{ + 4} \end{array}\) 2. MnO2 + 4HCl MnCl2 + Cl2 + 2H2O \[\begin{array}{l}\mathop {Mn}\limits^{ + 4} + 2e \to \mathop {Mn}\limits^{ + 2} \\2\mathop {Cl}\limits^{ - 1} \to {\mathop {Cl}\limits^0 _2} + 2e\end{array}\] Câu 2. Khí H2 có thể được điều chế bằng cách cho miếng sắt vào dung dịch HCl. Hãy đề xuất các biện pháp khác nhau để làm tăng tốc độ điều chế khí H2 ở trên. Phương pháp giải: 5 yếu tố ảnh hưởng đến tốc độ phản ứng: + Nồng độ + Áp suất + Diện tích bề mặt tiếp xúc + Chất xúc tác + Nhiệt độ Lời giải chi tiết: Các biện pháp làm tăng tốc độ phản ứng: - Thay sắt miếng bằng sắt bột (khối lượng không đổi). - Năng nồng độ dung dịch HCl. - Tăng nhiệt độ của phản ứng. Câu 3. Cho từ từ đến hết 10 gam dung dịch X gồm NaF 0,84% và NaCl 1,17% vào dung dịch AgNO3 dư, thu được m gam kết tủa. Tính giá trị của m. Phương pháp giải: - Tính số mol NaF và NaCl. - Viết PTHH hoặc dùng bảo toàn nguyên tố để tính kết tủa. Lời giải chi tiết: PTHH: NaF + AgNO3 → không phản ứng NaCl + AgNO3 → AgCl + NaNO3 0,2 mol → 0,2 mol nNaF = 0,2 mol nNaCl = 0,2 mol à nAgCl = 0,2 mol à mAgCl = 0,2 . 143,5 = 28,7 gam Phương pháp giải:
Lời giải chi tiết:
|