Đề thi học kì 2 Hóa 10 Kết nối tri thức - Đề số 8Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa... Phản ứng oxi hóa - khử là phản ứng có sự nhường và nhậnĐề bài
I. Trắc nghiệm
Câu 1 :
Phản ứng oxi hóa - khử là phản ứng có sự nhường và nhận
Câu 2 :
Cho phản ứng: aCu + bHNO3 → cCu(NO3)2 + dNO + eH2O Các hệ số a, b, c, d, e là những số nguyên, đơn giản nhất. Tổng (a + b) bằng:
Câu 4 :
Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P): P(s, đỏ) \( \to \)P (s, trắng) \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 17,6 kJ Điều này chứng tỏ phản ứng:
Câu 5 :
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Câu 6 :
Điều kiện nào sau đây không phải là điều kiện chuẩn ?
Câu 7 :
Vì sao khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò?
Câu 8 :
Tốc độ phản ứng là
Câu 9 :
Trong các trường hợp dưới đây, nếu lượng Fe trong các thí nghiệm đều được lấy bằng nhau thì trường hợp nào tốc độ phản ứng lớn nhất?
Câu 10 :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố ảnh hưởng tới tốc độ phản ứng là
Câu 11 :
Cho 5,6 gam kim loại sắt vào dung dịch hydrochloric acid, sau phản ứng thu được V lít khí ở đkc. Giá trị của V là:
Câu 12 :
Dung dịch chất nào sau đây được dùng để trung hòa môi trường base, hoặc thủy phân các chất trong quá trình sản xuất, tẩy rửa gỉ sắt (thành phần chính là các sắt oxide) bám trên bề mặt của các loại thép?
Câu 13 :
Cho các phát biểu sau: (a) trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa. (b) HF là acid mạnh. (c) trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7. (d) tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-. Trong các phát biểu trên, số phát biểu đúng là:
Câu 14 :
Trong tự nhiên nguyên tố chlorine tồn tại phổ biến nhất ở dạng hợp chất nào sau đây?
Câu 15 :
Phát biểu nào sau đây không đúng khi nói về nguyên tử các nguyên tố nhóm VIIA?
Câu 16 :
Cho 100ml dung dịch FeCl3 1M tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thì khối lượng kết tủa thu được là?
Câu 17 :
Hiện tượng quan sát được khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu là
Câu 18 :
Từ HF đến HI, tính acid của các dung dịch hydrogen halide biến đổi như thế nào?
II. Câu hỏi đúng sai
Câu 1 :
Trong dịch vị dạ dày của người có hydrohalic acid X với nồng độ khoảng 10-4–10-3mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ. a. X là hydrochloric acid.
Đúng
Sai
b. Khi nồng độ của X trong dạ dày vượt mức 0,001 mol/L sẽ dẫn tới tình trạng thừa acid.
Đúng
Sai
c. Người ta thường dùng NaHCO3 để làm giảm cơn đau dạ dày.
Đúng
Sai
d. X là hydrogen chloride.
Đúng
Sai
Câu 2 :
Thuỷ tinh vốn cứng, trơn và khá trơ về mặt hoá học nênviệc chạm khắc là điều không đơn giản. Muốn khắc cáchoa văn, cần phủ lên bề mặt thuỷ tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phầnthuỷ tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp CaF2 và H2SO4 đặc lên lớp paraffin đó, phầnthuỷtinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoavăn trên vật dụng cần trang trí. a) HF là là acid mạnh và có tính chất đặc biệt là ăn mòn thuỷ tinh.
Đúng
Sai
b) Phương trình hoá học của phản ứng ăn mòn thủy tinh là: 4HF + SiO2 \( \to \) SiF4 + 2H2O
Đúng
Sai
c) Để bảo quản hydrofluoric acid, người ta chứa trong bình bằng nhựa.
Đúng
Sai
d) Tất cả các hydrohalic acid đều có khả năng ăn mòn thủy tinh.
Đúng
Sai
Câu 3 :
Chlorine là một nguyên tố halogen điển hình a) Có thể tìm thấy chlorine trong tự nhiên dưới dạng NaCl trong nước biển hoặc muối mỏ.
Đúng
Sai
b) Khi tác dụng với NaOH, chlorine vừa là chất oxi hóa, vừa là chất khử.
Đúng
Sai
c) Chlorine có nhiều ứng dụng trong đời sống như: làm chất tẩy trắng, khử trùng nước, sản xuất các dung môi, …
Đúng
Sai
d) Chlorine có thể oxi hóa tất cả các kim loại tạo muối chloride.
Đúng
Sai
Câu 4 :
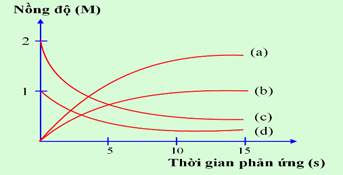
Thực hiện phản ứng: 2ICl + H2\( \to \)I2 + 2HCl. Nồng độ đầu của ICl và H2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
a) Đường (a) nồng độ HCl thay đổi theo thời gian: nồng độ tăng dần lượng tăng gấp đôi I2.
Đúng
Sai
b) Trong quá trình phản ứng nồng độ ICl và H2 tăng dần còn nồng độ I2 và HCl giảm dần.
Đúng
Sai
c) Đường (b) nồng độ I2 thay đổi theo thời gian: nồng độ tăng dần.
Đúng
Sai
d) Đường (c) nồng độ ICl thay đổi theo thời gian: nồng độ giảm dần, lượng giảm gấp đôi H2.
Đúng
Sai
III. Tự luận
160808,160809,160810,160811,160812
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Phản ứng oxi hóa - khử là phản ứng có sự nhường và nhận
Đáp án : A Phương pháp giải :
Dựa vào kiến thức về phản ứng oxi hóa – khử Lời giải chi tiết :
Phản ứng oxi hóa – khử là phản ứng có sự nhường và nhận electron Đáp án A
Câu 2 :
Cho phản ứng: aCu + bHNO3 → cCu(NO3)2 + dNO + eH2O Các hệ số a, b, c, d, e là những số nguyên, đơn giản nhất. Tổng (a + b) bằng:
Đáp án : C Phương pháp giải :
Dựa vào phương pháp thăng bằng electron Lời giải chi tiết :
\(\begin{array}{l}C{u^o} \to C{u^{ + 2}} + 2{\rm{e|x3}}\\{N^{ + 5}} + 3e \to {N^{ + 2}}|x2\end{array}\) 3Cu + 8HNO3 \( \to \)3Cu(NO3)2 + 2NO + 4H2O Tổng hệ số a + b = 3 + 8 = 11 Đáp án C
Đáp án : D Phương pháp giải :
Xác định sự thay đổi số oxi hóa của các nguyên tử Lời giải chi tiết :
Fe thể hiện tính khử, Cu2+ thể hiện số oxi hóa Đáp án D
Câu 4 :
Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P): P(s, đỏ) \( \to \)P (s, trắng) \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 17,6 kJ Điều này chứng tỏ phản ứng:
Đáp án : D Phương pháp giải :
Dựa vào dấu của biến thiên enthalpy Lời giải chi tiết :
Phản ứng trên có \({\Delta _{\rm{r}}}{\rm{H}}_{{\rm{298}}}^{\rm{0}}\) = 17,6 kJ > 0 => phản ứng thu nhiệt, P đỏ bền hơn P trắng Đáp án D
Câu 5 :
Phản ứng nào sau đây có thể tự xảy ra ở điều kiện thường?
Đáp án : C Phương pháp giải :
Phản ứng xảy ra ở nhiệt độ thường là phản ứng tỏa nhiệt Lời giải chi tiết :
Phản ứng giữa Zn và dung dịch H2SO4 Đáp án C
Câu 6 :
Điều kiện nào sau đây không phải là điều kiện chuẩn ?
Đáp án : D Phương pháp giải :
Dựa vào khái niệm điều kiện chuẩn Lời giải chi tiết :
Điều kiện ở áp suất 1 bar và nhiệt độ 25K không phải điều kiện chuẩn Đáp án D
Câu 7 :
Vì sao khi nung vôi, người ta phải xếp đá vôi lẫn với than trong lò?
Đáp án : B Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Xếp đá vôi lẫn với than trong lò vì phản ứng nung vôi là phản ứng thu nhiệt, cần nhiệt từ quá trình đốt cháy than. Đáp án B
Câu 8 :
Tốc độ phản ứng là
Đáp án : C Phương pháp giải :
Dựa vào khái niệm tốc độ phản ứng Lời giải chi tiết :
Tốc độ phản ứng là độ biến thiên nồng độ của một chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian Đáp án C
Câu 9 :
Trong các trường hợp dưới đây, nếu lượng Fe trong các thí nghiệm đều được lấy bằng nhau thì trường hợp nào tốc độ phản ứng lớn nhất?
Đáp án : D Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Tốc độ phản ứng lớn nhất khi Fe tác dụng với dung dịch HCl 1M, vì nồng độ HCl lớn nhất Đáp án D
Câu 10 :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc (trong sản xuất gang), yếu tố ảnh hưởng tới tốc độ phản ứng là
Đáp án : A Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng Lời giải chi tiết :
Dùng không khí nén thổi vào lò cao để đốt cháy than cốc, yếu tố nhiệt độ và áp suất làm ảnh hưởng tới tốc độ phản ứng.
Câu 11 :
Cho 5,6 gam kim loại sắt vào dung dịch hydrochloric acid, sau phản ứng thu được V lít khí ở đkc. Giá trị của V là:
Đáp án : A Phương pháp giải :
Dựa vào số mol của Fe Lời giải chi tiết :
n Fe = 5,6: 56 = 0,1 mol Fe + 2HCl \( \to \)FeCl2 + H2 0,1 0,1 V H2 = 0,1 . 24,79 = 2,479l Đáp án A
Câu 12 :
Dung dịch chất nào sau đây được dùng để trung hòa môi trường base, hoặc thủy phân các chất trong quá trình sản xuất, tẩy rửa gỉ sắt (thành phần chính là các sắt oxide) bám trên bề mặt của các loại thép?
Đáp án : B Phương pháp giải :
Dựa vào tính chất của acid Lời giải chi tiết :
HCl có thể dùng để trung hòa môi trường base, hoặc thủy phân các chất trong quá trình sản xuất Đáp án B
Câu 13 :
Cho các phát biểu sau: (a) trong các phản ứng hóa học, flo chỉ thể hiện tính oxi hóa. (b) HF là acid mạnh. (c) trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7. (d) tính khử của các ion halogenua tăng dần theo thứ tự: F-, Cl-, Br-, I-. Trong các phát biểu trên, số phát biểu đúng là:
Đáp án : C Phương pháp giải :
Dựa vào tính chất của nguyên tố halogen Lời giải chi tiết :
(a) đúng (b) sai, HF là một acid yếu (c) sai, fluorine không có số oxi hóa +1,+3,+5,+7 (d) đúng Đáp án C
Câu 14 :
Trong tự nhiên nguyên tố chlorine tồn tại phổ biến nhất ở dạng hợp chất nào sau đây?
Đáp án : B Phương pháp giải :
Dựa vào tính chất vật lí của nguyên tố halogen Lời giải chi tiết :
Trong tự nhiên, các nguyên tố chlorine tồn tại phổ biến ở dạng hợp chất NaCl
Câu 15 :
Phát biểu nào sau đây không đúng khi nói về nguyên tử các nguyên tố nhóm VIIA?
Đáp án : D Phương pháp giải :
Dựa vào kiến thức về nguyên tố halogen Lời giải chi tiết :
Theo chiều tăng dần điện tích hạt nhân nguyên tử bán kính tăng dần Đáp án D
Câu 16 :
Cho 100ml dung dịch FeCl3 1M tác dụng hoàn toàn với lượng dư dung dịch AgNO3, thì khối lượng kết tủa thu được là?
Đáp án : C Phương pháp giải :
Dựa vào phản ứng FeCl3 + 3AgNO3 \( \to \)Fe(NO3)3 + 3AgCl Lời giải chi tiết :
FeCl3 + 3AgNO3 \( \to \)Fe(NO3)3 + 3AgCl 0,1\( \to \) 0,3 n AgCl = 0,3.143,5 = 43,05g Đáp án C
Câu 17 :
Hiện tượng quan sát được khi cho nước chlorine màu vàng rất nhạt vào dung dịch sodium bromide không màu là
Đáp án : D Phương pháp giải :
Dựa vào tính chất vật lí của nguyên tố halogen Lời giải chi tiết :
Khi cho nước chlorine màu vàng nhạt rất nhạt vào dung dịch sodium bromide không màu tạo ra dung dịch màu vàng nâu (tạo ra Br2) Đáp án D
Câu 18 :
Từ HF đến HI, tính acid của các dung dịch hydrogen halide biến đổi như thế nào?
Đáp án : A Phương pháp giải :
Dựa vào xu hướng biến đổi của tính acid Lời giải chi tiết :
Từ HF đến HI, tính acid tăng dần Đáp án A
II. Câu hỏi đúng sai
Câu 1 :
Trong dịch vị dạ dày của người có hydrohalic acid X với nồng độ khoảng 10-4–10-3mol/L, đóng vai trò quan trọng trong quá trình tiêu hoá, cùng với enzyme và sự co bóp của cơ dạ dày nhằm chuyển hoá thức ăn thành chất dinh dưỡng cho cơ thể dễ hấp thụ. a. X là hydrochloric acid.
Đúng
Sai
b. Khi nồng độ của X trong dạ dày vượt mức 0,001 mol/L sẽ dẫn tới tình trạng thừa acid.
Đúng
Sai
c. Người ta thường dùng NaHCO3 để làm giảm cơn đau dạ dày.
Đúng
Sai
d. X là hydrogen chloride.
Đúng
Sai
Đáp án
a. X là hydrochloric acid.
Đúng
Sai
b. Khi nồng độ của X trong dạ dày vượt mức 0,001 mol/L sẽ dẫn tới tình trạng thừa acid.
Đúng
Sai
c. Người ta thường dùng NaHCO3 để làm giảm cơn đau dạ dày.
Đúng
Sai
d. X là hydrogen chloride.
Đúng
Sai
Lời giải chi tiết :
a) đúng b) đúng c) đúng d) sai, X là hydrochloric acid
Câu 2 :
Thuỷ tinh vốn cứng, trơn và khá trơ về mặt hoá học nênviệc chạm khắc là điều không đơn giản. Muốn khắc cáchoa văn, cần phủ lên bề mặt thuỷ tinh một lớp paraffin, thực hiện chạm khắc các hoa văn lên lớp paraffin, để phầnthuỷ tinh cần khắc lộ ra. Nhỏ dung dịch hydrofluoric acid hoặc hỗn hợp CaF2 và H2SO4 đặc lên lớp paraffin đó, phầnthuỷtinh cần chạm khắc sẽ bị ăn mòn, tạo nên những hoavăn trên vật dụng cần trang trí. a) HF là là acid mạnh và có tính chất đặc biệt là ăn mòn thuỷ tinh.
Đúng
Sai
b) Phương trình hoá học của phản ứng ăn mòn thủy tinh là: 4HF + SiO2 \( \to \) SiF4 + 2H2O
Đúng
Sai
c) Để bảo quản hydrofluoric acid, người ta chứa trong bình bằng nhựa.
Đúng
Sai
d) Tất cả các hydrohalic acid đều có khả năng ăn mòn thủy tinh.
Đúng
Sai
Đáp án
a) HF là là acid mạnh và có tính chất đặc biệt là ăn mòn thuỷ tinh.
Đúng
Sai
b) Phương trình hoá học của phản ứng ăn mòn thủy tinh là: 4HF + SiO2 \( \to \) SiF4 + 2H2O
Đúng
Sai
c) Để bảo quản hydrofluoric acid, người ta chứa trong bình bằng nhựa.
Đúng
Sai
d) Tất cả các hydrohalic acid đều có khả năng ăn mòn thủy tinh.
Đúng
Sai
Lời giải chi tiết :
a) sai, HF là acid yếu b) đúng c) đúng d) sai, chỉ có HF có khả năng ăn mòn thủy tinh
Câu 3 :
Chlorine là một nguyên tố halogen điển hình a) Có thể tìm thấy chlorine trong tự nhiên dưới dạng NaCl trong nước biển hoặc muối mỏ.
Đúng
Sai
b) Khi tác dụng với NaOH, chlorine vừa là chất oxi hóa, vừa là chất khử.
Đúng
Sai
c) Chlorine có nhiều ứng dụng trong đời sống như: làm chất tẩy trắng, khử trùng nước, sản xuất các dung môi, …
Đúng
Sai
d) Chlorine có thể oxi hóa tất cả các kim loại tạo muối chloride.
Đúng
Sai
Đáp án
a) Có thể tìm thấy chlorine trong tự nhiên dưới dạng NaCl trong nước biển hoặc muối mỏ.
Đúng
Sai
b) Khi tác dụng với NaOH, chlorine vừa là chất oxi hóa, vừa là chất khử.
Đúng
Sai
c) Chlorine có nhiều ứng dụng trong đời sống như: làm chất tẩy trắng, khử trùng nước, sản xuất các dung môi, …
Đúng
Sai
d) Chlorine có thể oxi hóa tất cả các kim loại tạo muối chloride.
Đúng
Sai
Lời giải chi tiết :
a) đúng b) đúng c) đúng d) sai, chlorine không tác dụng với vàng, bạc
Câu 4 :
Thực hiện phản ứng: 2ICl + H2\( \to \)I2 + 2HCl. Nồng độ đầu của ICl và H2 được lấy đúng theo tỉ lệ hợp thức. Nghiên cứu sự thay đổi nồng độ các chất tham gia và chất tạo thành trong phản ứng theo thời gian, thu được đồ thị sau:
a) Đường (a) nồng độ HCl thay đổi theo thời gian: nồng độ tăng dần lượng tăng gấp đôi I2.
Đúng
Sai
b) Trong quá trình phản ứng nồng độ ICl và H2 tăng dần còn nồng độ I2 và HCl giảm dần.
Đúng
Sai
c) Đường (b) nồng độ I2 thay đổi theo thời gian: nồng độ tăng dần.
Đúng
Sai
d) Đường (c) nồng độ ICl thay đổi theo thời gian: nồng độ giảm dần, lượng giảm gấp đôi H2.
Đúng
Sai
Đáp án
a) Đường (a) nồng độ HCl thay đổi theo thời gian: nồng độ tăng dần lượng tăng gấp đôi I2.
Đúng
Sai
b) Trong quá trình phản ứng nồng độ ICl và H2 tăng dần còn nồng độ I2 và HCl giảm dần.
Đúng
Sai
c) Đường (b) nồng độ I2 thay đổi theo thời gian: nồng độ tăng dần.
Đúng
Sai
d) Đường (c) nồng độ ICl thay đổi theo thời gian: nồng độ giảm dần, lượng giảm gấp đôi H2.
Đúng
Sai
Lời giải chi tiết :
a) đúng b) sai, vì ICl và H2 là chất tham gia nồng độ sẽ giảm dần c) đúng d) đúng
III. Tự luận
160808,160809,160810,160811,160812
|