Bài 4. Định luật bảo toàn khối lượng và phương trình hóa học trang 23, 24, 25 SGK Khoa học tự nhiên 8 - Chân trời sáng tạoKhi hai chất phản ứng với nhau sẽ tạo thành chất mới do có sự hình thành liên kết mới giữa các nguyên tử trong phân tử. Sự biến đổi hóa học có làm khối lượng các chất bảo toàn không? Làm thế nào để biểu diễn phản ứng hóa học ngắn gọn và thuận tiện? Tổng hợp đề thi học kì 1 lớp 8 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Khoa học tự nhiên
Lựa chọn câu để xem lời giải nhanh hơn
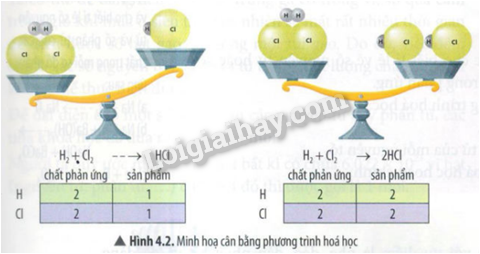
Câu hỏi tr 23 CHMĐ Trả lời câu hỏi mở đầu trang 23 SGK KHTN 8 Chân trời sáng tạo Khi hai chất phản ứng với nhau sẽ tạo thành chất mới do có sự hình thành liên kết mới giữa các nguyên tử trong phân tử. Sự biến đổi hóa học có làm khối lượng các chất bảo toàn không? Làm thế nào để biểu diễn phản ứng hóa học ngắn gọn và thuận tiện? Phương pháp giải: Dựa vào định luật bảo toàn khối lượng. Lời giải chi tiết: Sự biến đổi hóa học có làm khối lượng các chất bảo toàn. Dùng công thức và phương trình hóa học để biểu diễn phản ứng hóa học. Câu hỏi tr 23 CH 1 Trả lời câu hỏi 1 trang 23 SGK KHTN 8 Chân trời sáng tạo Nhận xét màu sắc của dung dịch BaCl2 và dung dịch Na2SO4 ban đầu trong 2 cốc thủy tinh. Phương pháp giải: Dựa vào các hóa chất có trong phòng thí nghiệm. Lời giải chi tiết: Màu sắc dung dịch BaCl2 và dung dịch Na2SO4 không màu, trong suốt. Câu hỏi tr 23 CH 2 Trả lời câu hỏi 2 trang 23 SGK KHTN 8 Chân trời sáng tạo Nêu hiện tượng sau khi rót cốc (1) vào cốc (2) và chỉ ra dấu hiệu có phản ứng hóa học xảy ra. Phương pháp giải: Dựa vào kết quả của thíe nghiệm. Lời giải chi tiết: Hiện tượng sau khi rót cốc (1) vào cốc (2) có vẩn đục trắng xuất hiện. Câu hỏi tr 23 CH 3 Trả lời câu hỏi 3 trang 23 SGK KHTN 8 Chân trời sáng tạo Em có nhận xét gì về tổng khối lượng của 2 cốc trước và sau phản ứng. Phương pháp giải: Dựa vào Hình 4.1 Lời giải chi tiết: Tổng khối lượng của 2 cốc trước và sau phản ứng bằng nhau. Câu hỏi tr 24 LT Trả lời câu hỏi luyện tập trang 24 SGK KHTN 8 Chân trời sáng tạo Giải thích vì sao trong một phản ứng hóa học, tổng khối lượng các chất được bảo toàn. Phương pháp giải: Dựa vào phản ứng hóa học. Lời giải chi tiết: Vì số nguyên tử các nguyên tố không đổi khi phản ứng xảy ra, nên tổng khối lượng các chất được bảo toàn. Câu hỏi tr 24 CH Trả lời câu hỏi trang 24 SGK KHTN 8 Chân trời sáng tạo Phương trình hóa học biểu diễn gì? Gồm công thức hóa học của những chất nào? Phương pháp giải: Dựa vào phương trình hóa học. Lời giải chi tiết: Phương trình hóa học biểu diễn phản ứng hóa học. Gồng công thức hóa học của chất tham gia và chất sản phẩm. Câu hỏi tr 25 LT Trả lời câu hỏi luyện tập trang 25 SGK KHTN 8 Chân trời sáng tạo Viết sơ đồ phản ứng của phản ứng giữa khí hydrogen và khí oxygen tạo ra nước. Phương pháp giải: Dựa vào các bước lập phương trình hóa học. Lời giải chi tiết: H2 + O2 \( \to \) H2O Câu hỏi tr 25 CH Trả lời câu hỏi trang 25 SGK KHTN 8 Chân trời sáng tạo Quan sát Hình 4.2, hãy cho biết phương trình nào đã được cân bằng. Vì sao? Phương pháp giải: Dựa vào Hình 4.2 Lời giải chi tiết: Phương trình (2) đã được cân bằng. Vì số nguyên tử tham gia bằng số nguyên tử sản phẩm. Câu hỏi tr 26 CH 1 Trả lời câu hỏi 1 trang 26 SGK KHTN 8 Chân trời sáng tạo Quan sát sơ đồ phản ứng (*), hãy nhận xét số nguyên tử của nguyên tố P và O ở vế trái và vế phải. Số nguyên tử của nguyên tố nào lớn hơn? Phương pháp giải: Dựa vào phản ứng (*): Lời giải chi tiết: Số nguyên tố P và O ở vế trái bằng vế phải. Số nguyên tử của nguyên tố P nhỏ hơn nguyên tử của nguyên tố O. Câu hỏi tr 26 CH 2 Trả lời câu hỏi 2 trang 26 SGK KHTN 8 Chân trời sáng tạo Để cân bằng, bắt đầu cân bằng từ nguyên tố nào trước? Phương pháp giải: Dựa vào các bước cân bằng phương trình hóa học. Lời giải chi tiết: Để cân bằng, bắt đầu cân bằng từ nguyên tố nhiều hơn. Câu hỏi tr 26 CH 3 Trả lời câu hỏi 3 trang 26 SGK KHTN 8 Chân trời sáng tạo Làm thế nào để cho số nguyên tử của nguyên tố O ở 2 vế bằng nhau? Phương pháp giải: Dựa vào các bước cân bằng phương trình hóa học. Lời giải chi tiết: Thêm 5 vào phân tử O2 và 2 vào phân tử P2O5. Câu hỏi tr 26 CH 4 Trả lời câu hỏi 4 trang 26 SGK KHTN 8 Chân trời sáng tạo Phương trình hóa học cho biết những thông tin gì? Phương pháp giải: Dựa vào ý nghĩa của phương trình hóa học. Lời giải chi tiết: Phương trình hóa học cho biết tỉ lệ về số nguyên tử haowcj số phân tử giữa các chất trong phản ứng. Câu hỏi tr 26 LT Trả lời câu hỏi luyện tập trang 26 SGK KHTN 8 Chân trời sáng tạo Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử và số phân tử của các chất trong mỗi sơ đồ phản ứng sau: a) Na + O2 \( - - > \)Na2O b) Na2CO3 + Ba(OH)2 --> NaOH + BaCO3. c) Fe + O2 ---> Fe3O4. Phương pháp giải: Dựa vào các bước lập phương trình hóa học. Lời giải chi tiết: a) Bước 1: Viết sơ đồ phản ứng: Na + O2 \( \to \)Na2O Bước 2: Cân bằng số nguyên tử của mỗi nguyên tố: Ta thêm 2 vào nguyên tử Na: 2 Na + O2 \( \to \)Na2O Bước 3: Viết phương trình hóa học hoàn chỉnh: 2 Na + O2 \( \to \)Na2O Tỉ lệ số nguyên tử: 2 nguyên tử Na : 1 phân tử O2 : 1 phân tử Na2O b) Na2CO3 + Ba(OH)2 \( \to \)2NaOH + BaCO3 Tỉ lệ: 1 phân tử Na2CO3 : 1 phân tử Ba(OH)2 : 2 phân tử NaOH : 1 phân tử BaCO3. c) 3Fe + 2O2 \( \to \)Fe3O4 Tỉ lệ: 3 nguyên tử Fe : 2 phân tử O2 : 1 phân tử Fe3O4 Câu hỏi tr 26 VD Trả lời câu hỏi vận dụng trang 26 SGK KHTN 8 Chân trời sáng tạo Kim loại nhôm (Al) với ưu điểm là nhẹ, dẻo, dẫn nhiệt tốt và dễ dàng phản ứng với oxygen (O2) tạo lớp màng oxide mỏng (Al2O3) bao phủ bên ngoài giúp cho kim loại nhôm được bảo vệ vững chắc trong không khí. Em hãy lập phương trình hóa học biểu diễn phản ứng giữa kim loại nhôm và khí oxygen và giải thích tại sao người ta thường dùng nhôm để chế tạo đồ dùng và dụng cụ nhà bếp. Phương pháp giải: Xác định các chất tham gia và chất sản phẩm, sau đó lập phương trình hóa học. Lời giải chi tiết: Chất tham gia: Al và O2 Chất sản phẩm: Al2O3 Phương trình hóa học: 4Al + 3O2 \( \to \)2Al2O3 Người ta thường dùng nhôm để chế tạo đồ dùng và dụng cụ nhà bếp vì nhôm dẫn nhiệt tốt, bền, nhẹ, dễ uốn dẻo và có lớp màng oxide mỏng bao phủ giúp nhôm được bảo vệ vững chắc trong không khí.
|