Bài 2. Nguyên tố hóa học trang 17, 18, 19, 20 Hóa 10 Kết nối tri thứcCác nguyên tử có cùng số đơn vị điện tích hạt nhân thì có 1. Cho các nguyên tử sau: B (Z = 8, A = 16), D (Z = 9, A = 19), 2. Kí hiệu một nguyên tử cho biết những thông tin gì? Cho ví dụ 3. Hãy biểu diễn kí hiệu của một số nguyên tử sau: 4. Xác định thành phần nguyên tử (số proton, neutron, electron) của mỗi đồng vị sau: Tổng hợp đề thi học kì 2 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 17 MĐ
Phương pháp giải: - Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân - Một nguyên tử trung hòa về điện có số proton = số electron - Số proton trong hạt nhân nguyên tử bằng số đơn vị điện tích hạt nhân Lời giải chi tiết: - Các nguyên tử có cùng số đơn vị điện tích hạt nhân sẽ thuộc cùng loại nguyên tố hóa học - Một nguyên tử trung hòa về điện có số proton = số electron. Mà số proton trong hạt nhân = số đơn vị điện tích hạt nhân => Số đơn vị điện tích hạt nhân = số proton = số electron CH tr 17 CH
Phương pháp giải: Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân Lời giải chi tiết: - Ta có: + L có Z = 8 + D có Z = 9 + E có Z = 8 + G có Z = 7 => Nguyên tử L và E thuộc cùng 1 nguyên tố hóa học vì có cùng số đơn vị điện tích hạt nhân (Z = 8) CH tr 18 CH
Phương pháp giải:
Lời giải chi tiết:
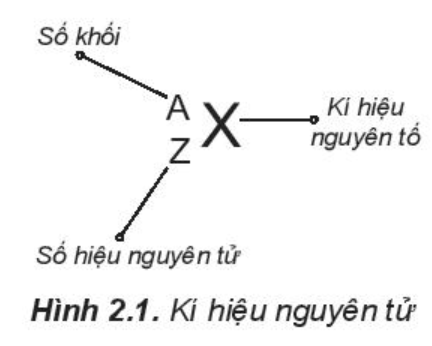
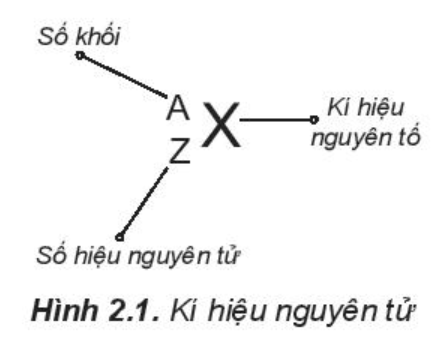
- Kí hiệu một nguyên tử cho biết: + Kí hiệu của nguyên tố đó + Số hiệu nguyên tử => Số proton và số electron + Số khối => Số neutron = Số khối – số proton - Ví dụ: 168O cho biết: + Nguyên tố oxygen, kí hiệu: O + Oxygen có số hiệu nguyên tử = số prtoton = số electron = 8 + Số khối của oxygen = 16 => Số neutron = 16 – 8 = 8 CH tr 18 CH
Phương pháp giải: Trong 1 nguyên tử: + Số proton = số hiệu nguyên tử = Z + Số khối: A = số proton + số neutron Lời giải chi tiết: a) Nitrogen ( số proton = 7 và số neutron = 7) + Nitrogen có kí hiệu nguyên tố: N + Số proton = Z = số hiệu nguyên tử = 7 + Số khối: A = số proton + số neutron = 7 + 7 = 14 => Kí hiệu nguyên tử: 147N b) Phosphorus ( số proton = 15 và số neutron = 16) + Phosphorus có kí hiệu nguyên tố: P + Số proton = Z = số hiệu nguyên tử = 15 + Số khối: A = số proton + số neutron = 15 + 16 = 31 => Kí hiệu nguyên tử: 3115P c) Copper ( số proton = 29 và số neutron = 34) + Copper có kí hiệu nguyên tố: Cu + Số proton = Z = số hiệu nguyên tử = 29 + Số khối: A = số proton + số neutron = 29 + 34 = 63 => Kí hiệu nguyên tử: 6329Cu CH tr 18 CH
Phương pháp giải: - Kí hiệu một nguyên tử cho biết: + Kí hiệu của nguyên tố đó + Số hiệu nguyên tử = số proton = số electron + Số neutron = số khối – số proton Lời giải chi tiết: a)
b)
CH tr 20 CH
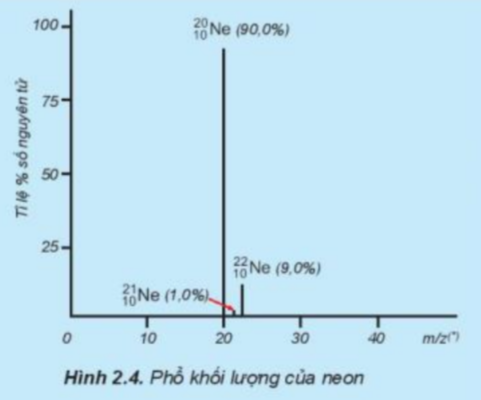
Phương pháp giải: - Nguyên tử khối trung bình của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên. - Nguyên tử khối trung bình: M=aA+bB+cC+dD+...100 Trong đó: A, B, C, D… là số khối của các đồng vị a, b, c, d… là phần trăm của các đồng vị tương ứng Lời giải chi tiết: Ta có: 20Nechiếm 90,0%; 21Nechiếm 1,0%; 22Nechiếm 9,0% => MNe=90.20+1.21+9.22100=20,19 Vậy nguyên tử khối trung bình của Ar là 20,19 CH tr 20 CH
Phương pháp giải: Vì trong tự nhiên, Cr tồn tại ở nhiều loại đồng vị như 40Cr, 51Cr, 52Cr, 53Cr, 54Cr. Lời giải chi tiết: Trong tự nhiên, Cr tồn tại ở nhiều loại đồng vị như 40Cr, 51Cr, 52Cr, 53Cr, 54Cr. => Tính giá trị nguyên tử khối của chromium sẽ không phải là số nguyên mà là 51,996 M=aA+bB+cC+dD+...100 CH tr 20 CH
Phương pháp giải: - Nguyên tử khối trung bình: M=aA+bB+cC+dD+...100 Trong đó: A, B, C, D… là số khối của các đồng vị a, b, c, d… là phần trăm của các đồng vị tương ứng Lời giải chi tiết: - Gọi tỉ lệ đồng vị 63Cu trong tự nhiên là x% => Tỉ lệ đồng vị 65Cu trong tự nhiên là (100-x)% - Nguyên tử khối trung bình của Cu là 63,546 => 63,546=63.x+65.(100−x)100 => x = 72,7 Vậy đồng vị 63Cu chiếm 72,7% trong tự nhiên
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Click để xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
|