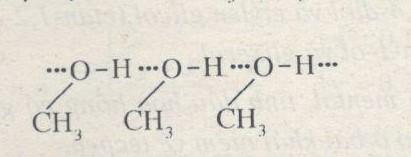Bài 14. Ôn tập chương 3 trang 68, 69 Hóa 10 Kết nối tri thứcDãy các chất nào dưới dây mà tất cả các phân tử đều có liên kết ion? A. Cl2, Br2, I2, HCl. B. Na2O, KCl, BaCl2, Al2O3. C. HCl, H2S, NaCl, N2O C. MgO, H2SO4, H3PO4, HCl. Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hóa trị không phân cực? A. N2, CO2, Cl2, H2. B. N2, Cl2, H2, HCl. C. N2, HI, Cl2, CH4 D. Cl2, O2, N2, F2. Tổng hợp đề thi học kì 2 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
Bài tập 1
Phương pháp giải: Liên kết ion thường là liên kết giữa 1 kim loại điển hình và 1 phi kim điển hình. Hiệu độ âm điện giữa hai nguyên tử lớn hơn hoặc bằng 1,7. Lời giải chi tiết: A. loại do liên kết trong Cl2 là liên kết cộng hóa trị. C. loại do liên kết trong HCl là liên kết cộng hóa trị. D. loại do liên kết trong HCl là liên kết cộng hóa trị. => Đáp án B. Bài tập 2
Phương pháp giải: Liên kết cộng hóa trị được hình thành do sự góp chung electron của 2 nguyên tử, cặp electron đó không lệch về phía nguyên tử nào. Tất cả các phân tử được hình thành từ 2 nguyên tử giống nhau đều tạo liên kết cộng hóa trị không phân cực. Lời giải chi tiết: Đáp án D là các phân tử được tạo bởi các nguyên tử giống nhau => Hiệu độ âm điện = 0 Đáp án D Bài tập 3
Phương pháp giải: - Từ công thức electron, ta thay thế cặp electron chung thành các gạch nối thu được công thức Lewis. Từ công thức Lewis, chỉ giữ lại các gạch nối còn các cặp electron không tham gia liên kết sẽ không viết. - Trong phân tử, khi hai nguyên tử liên kết cộng hóa trị với nhau, liên kết đó sẽ lệch về phía nguyên tử có độ âm điện lớn hơn. Lời giải chi tiết: + PH3 CT Lewis CT cấu tạo + H2O CT Lewis CT cấu tạo + C2H6 CT Lewis CT cấu tạo Giữa 3 phân tử H2O, PH3 và C2H6, nguyên tử O có độ âm điện lớn hơn cả nên liên kết trong H2O là phân cực mạnh nhất. Bài tập 4
Phương pháp giải:
Lời giải chi tiết: - Hiệu độ âm điện của C và H là 2,55 – 2,2 = 0,35 nên liên kết C - H trong phân tử CH4 là liên kết cộng hóa trị không phân cực. - Hiệu độ âm điện của Cl2 và Ca là 3,16 – 1,1 = 2,06 nên liên kết Ca – Cl trong phân tử CaCl2 là liên kết ion. - Hiệu độ âm điện của Br và H là 2,96 – 2,2 = 0,76 nên liên kết H – Br trong phân tử HBr là liên kết cộng hóa trị phân cực . - Hiệu độ âm điện của N và H là 3,04 – 2,2 = 0,84 nên liên kết N – H trong phân tử NH3 là liên kết cộng hóa trị phân cực. Bài tập 5
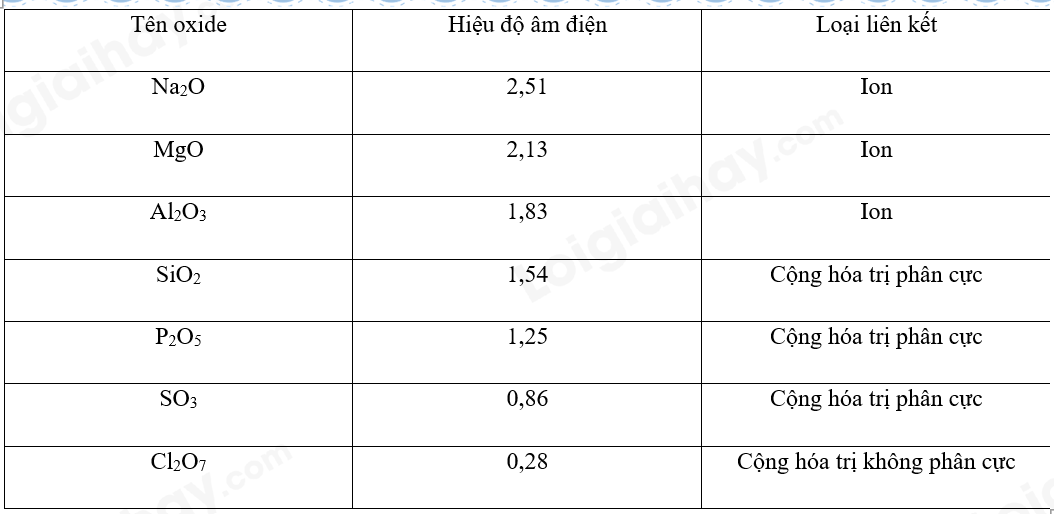
Phương pháp giải: a) Các nguyên tử trong nguyên tố có hiệu độ âm điện càng lớn thì càng phân cực. Đối với các oxide, khi nguyên tố còn lại có độ âm điện càng lớn thì độ phân cực càng mạnh. Trong 1 chu kì, độ âm điện tăng theo chiều tăng của điện tích hạt nhân. b)
Lời giải chi tiết: a) Độ âm điện sắp xếp theo chiều tăng dần của các nguyên tố: Na, Mg, Al, Si, P, S, Cl. => Độ phân cực của các liên kết trong dãy Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7 tăng dần. b)
Bài tập 6
Phương pháp giải: a) Liên kết hydrogen được hình thành dựa trên hai điều kiện: - Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N,… - Nguyên tử F, O, N…. liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết. b) Liên kết hydrogen được biểu diễn bằng dấu ba chấm (…) Lời giải chi tiết: a) Liên kết hydrogen được hình thành dựa trên hai điều kiện: - Nguyên tử hydrogen liên kết với các nguyên tử có độ âm điện lớn như F, O, N,… - Nguyên tử F, O, N…. liên kết với hydrogen phải có ít nhất một cặp electron hóa trị chưa liên kết. Phân tử có thể tạo liên kết hydrogen là CH3OH, NH3 do O và N còn cặp electron hóa trị chưa tham gia liên kết. b)
Liên kết hydrogen giữa các phân tử CH3OH Liên kết hydrogen giữa các phân tử NH3
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Click để xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
|