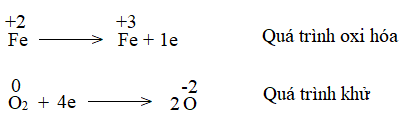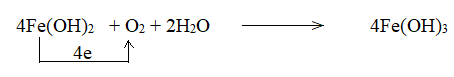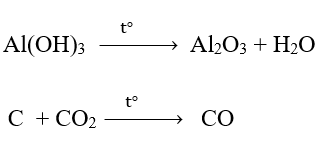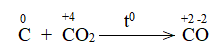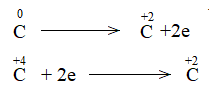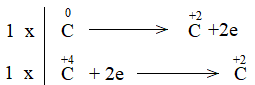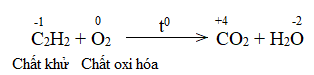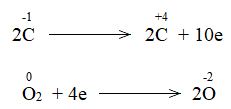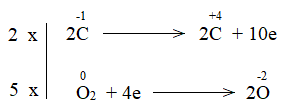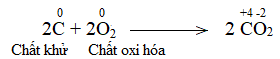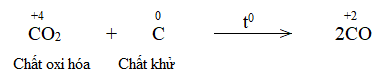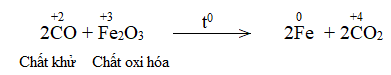Bài 15. Phản ứng oxi hóa - khử trang 71, 72, 73, 74, 75, 76, 77 Hóa 10 Kết nối tri thứcTrong lò luyện gang, xảy ra phản ứng oxi hóa – khử theo sơ đồ: Xác định số oxi hóa của nguyên tử Fe và S trong các chất sau: a) Fe, FeO, Fe2O3, Fe(OH)3, Fe3O4. b) S, H2S, SO2, SO3, H2SO4, Na2SO3. Tổng hợp đề thi học kì 2 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 71 MĐ
Phương pháp giải: - Phản ứng oxi hóa – khử xảy ra đồng thời quá trình nhường và nhận. - Trong phản ứng oxi hóa khử, có sự thay đổi số oxi hóa. - Nguyên tắc lập phương trình hóa học của phản ứng oxi hóa – khử là tổng số electron nhường bằng tổng số electron nhận. Lời giải chi tiết: - Về bản chất, phản ứng oxi hóa – khử là phản ứng xảy ra đồng thời quá trình nhường và quá trình nhận electron. - Dấu hiệu để nhận ra loại phản ứng oxi hóa – khử là có sự thay đổi số oxi của các nguyên tử. - Các bước lập phương trình hóa học của phản ứng oxi hóa – khử: Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử Nguyên tử Fe và C có sự thay đổi số oxi hóa, Fe là chất oxi hóa, C là chất khử Bước 2: Biểu diễn quá trình oxi hóa, quá trình khử Fe+3 + 3e → Fe0 C+2 → C+4 + 2e Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc tổng electron nhường bằng tổng electron nhận. 2x /Fe+3 + 3e → Fe0 3x /C+2 → C+4 + 2e Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng. Fe2O3+ 3CO \(\xrightarrow{{{t^o}C}}\) 2Fe + 3CO2 CH tr 73 CH
Phương pháp giải: Quy tắc xác định số oxi hóa: - Trong đơn chất, số oxi hóa của nguyên tử bằng 0. - Trong hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương bằng số electron hóa trị. - Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0. - Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion. Lời giải chi tiết:
CH tr 73 HĐ
Phương pháp giải: - Chất khử là chất nhường electron - Chất oxi hóa là chất nhận electron Lời giải chi tiết: 1. * Thí nghiệm 1: Fe + CuSO4 → FeSO4 + Cu Quá trình oxi hóa: Fe0 → Fe+2 + 2e Quá trình khử: Cu+2 + 2e → Cu0 * Thí nghiệm 2: Fe + H2SO4 → FeSO4 + H2 Quá trình oxi hóa: Fe0 → Fe+2 + 2e Quá trình khử: 2H+ + 2e → H20 2. * Thí nghiệm 1: - Chất oxi hóa CuSO4 - Chất khử Fe * Thí nghiệm 2: - Chất oxi hóa H2SO4 - Chất khử Fe CH tr 74 CH
Phương pháp giải: - Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron. - Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron. Lời giải chi tiết: a) - Trong Fe(OH)2, iron có số oxi hóa +2 - Trong Fe(OH)3, iron có số oxi hóa +3 => Nguyên tử iron có sự thay đổi số oxi hóa từ +2 lên +3. - Trong O2, oxygen có số oxi hóa 0 - Trong Fe(OH)3, oxygen có số oxi hóa -2 => Nguyên tử oxygen có sự thay đổi số oxi hóa từ 0 xuống -2. b) c) 1 phân tử Fe(OH)2 nhường 1 electron => 4 phân tử Fe(OH)2 nhường 4 electron
CH tr 75 CH
Phương pháp giải: Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử. Lời giải chi tiết: a) Trước phản ứng, các nguyên tử Al, O và H có số oxi hóa lần lượt là +3, -2, +1 Sau phản ứng, các nguyên tử Al, O và H có số oxi hóa lần lượt là +3, -2, +1. => Trong phản ứng, các nguyên tử không có sự thay đổi số oxi hóa => Không là phản ứng oxi hóa – khử. b) Trong phản ứng, C trước phản ứng có số oxi hóa 0. Kết thúc phản ứng, C có số oxi hóa +2 => Phản ứng oxi hóa khử Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
Bước 2: Biểu diễn quá trình oxi hóa – khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số C + CO2 \(\xrightarrow{{{t^o}}}\) 2CO CH tr 76 CH
Phương pháp giải: - Sự cháy là phản ứng oxi hóa - khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa. - Phần lớn các phản ứng hóa học xảy ra trong các quy trình sản xuất là phản ứng oxi hóa – khử. - Sự han gỉ các đồ vật, thiết bị làm bằng kim loại do sự oxi hóa của oxygen. Lời giải chi tiết: Phản ứng oxi hóa – khử có lợi: sự cháy,…  Phản ứng oxi hóa – khử có hại: sự han gỉ các thiết bị, đồ dùng được làm bằng sắt,… 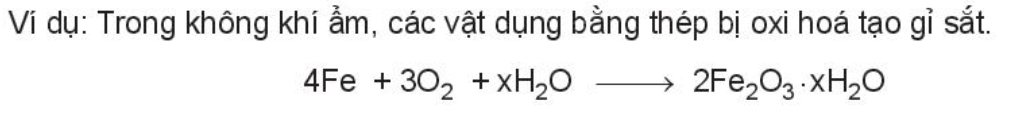 CH tr 76 CH
Phương pháp giải: Dấu hiệu để nhận biết phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của các nguyên tử.
Lời giải chi tiết:
CH tr 76 CH
Phương pháp giải: Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
Lời giải chi tiết: Bước 1: Bước 2: Bước 3: Bước 4: 2C2H2 + 5O2 \(\xrightarrow{{{t^o}}}\) 4CO2 + 2H2O CH tr 77 CH
Phương pháp giải: Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron. Lời giải chi tiết:
|