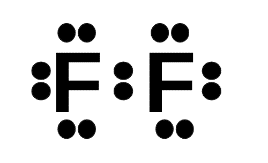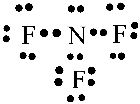Bài 10. Quy tắc octet trang 49, 50 Hóa 10 Kết nối tri thứcKhi các nguyên tử kết hợp với nhau tạo thành phân tử theo một tỉ lệ xác định, 1. Khi nguyên tử fluorine nhận thêm 1 electron thì ion 2. Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng nào? Tổng hợp đề thi học kì 2 lớp 10 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 49 MĐ
Phương pháp giải: Các nguyên tử khi liên kết với nhau có xu hướng đạt tới cấu hình electron bền vững của khí hiếm. Lời giải chi tiết: Hầu hết nguyên tử các nguyên tố trong bảng tuần hoàn đều không đủ 8 electron lớp ngoài cùng nên có xu hướng đạt cấu hình electron bền vững bằng cách kết hợp với các nguyên tử khác theo tỉ lệ nhất định.
CH tr 49 CH
Phương pháp giải: Cấu hình electron của F: 1s22s22p5 Cấu hình electron của F khi nhận thêm 1 electron: 1s22s22p6. Lời giải chi tiết: Khi nguyên tử F nhận thêm 1 electron thì ion tạo thành có cấu hình electron của nguyên tử nguyên tố Ne. CH tr 49 CH
Phương pháp giải: Khi tạo liên kết hóa học thì nguyên tử có xu hướng đạt tới cấu hình electron bền vững.
Lời giải chi tiết: Để giảm năng lượng, các nguyên tử kết hợp lại thành phân tử theo xu hướng đạt tới cấu hình electron bền vững của khí hiếm. CH tr 50 CH
Phương pháp giải: Sử dụng quy tắc octet: Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Lời giải chi tiết: - Khi hình thành liên kết hóa học trong phân tử F2, nguyên tử fluorine có 7 electron hóa trị, mỗi nguyên tử fluorine cần thêm 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử F2 được biểu diễn
Xung quanh mỗi nguyên tử fluorine đều có 8 electron - Khi hình thành liên kết hóa học trong phân tử CCl4, nguyên tử carbon có 4 electron hóa trị, nguyên tử carbon cần thêm 4 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử chlorine góp chung một 1 electron. Phân tử CCl4 được biểu diễn  Xung quanh mỗi nguyên tử carbon và chlorine đều có 8 electron - Khi hình thành liên kết hóa học trong phân tử NF3, nguyên tử nitrogen có 5 electron hóa trị, nguyên tử nitrogen cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử fluorine góp chung một 1 electron. Phân tử NF3 được biểu diễn
Xung quanh mỗi nguyên tử nitrogen và florine đều có 8 electron CH tr 50 CH
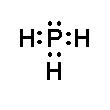
Phương pháp giải: Sử dụng quy tắc octet: Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm. Lời giải chi tiết: - Khi hình thành liên kết hóa học trong phân tử PH3, nguyên tử phosphorus có 5 electron hóa trị, nguyên tử phosphorus cần thêm 3 electron để đạt cấu hình electron bão hòa theo quy tắc octet nên mỗi nguyên tử hydrogen góp chung một 1 electron. Phân tử PH3 được biểu diễn
Xung quanh mỗi nguyên tử phosphorus đều có 8 electron.
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Click để xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
|