Đề thi học kì 1 Hóa 11 Kết nối tri thức - Đề số 6Tổng hợp đề thi học kì 1 lớp 11 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh Cho 2 mol CH3COOH vào 1 mol CH3OH xảy ra phản ứng:Đề bài
Câu 1 :
Cho 2 mol CH3COOH vào 1 mol CH3OH xảy ra phản ứng: CH3COOH(l) + CH3OH(l) ⇌ CH3COOCH3(l) + H2O(l) Sau khi phản ứng đạt trạng thái cân bằng, hiệu suất của phản ứng là 66,67%. Giá trị hằng số cân bằng của phản ứng là
Câu 2 :
Các bước dưới đây mô tả ngắn gọn cách tiến hành chuẩn độ dung dịch sodium hydroxide bằng dung dịch hydrochloric acid. (1) Thêm vài giọt chất chỉ thị thích hợp vào dung dịch. (2) Ghi lại thể tích HCl cuối cùng và lặp lại 3 lần để thu được kết quả phù hợp. (3) Thêm HCl vào burette và ghi thể tích. (4) Lấy 25 mL dung dịch NaOH vào bình tam giác bằng pipet 25 mL. (5) Mở khóa burette, nhỏ từ từ từng giọt dung dịch HCl vào bình tam giác đựng NaOH, lắc đều cho đến khi dung dịch đổi màu. Thứ tự thực hiện lần lượt các bước trên là
Câu 3 :
Cho phản ứng: C(s) + CO2(g) ⇌ 2CO(g) Ở trạng thái cân bằng, hằng số cân bằng của phản ứng có biểu thức:
Câu 4 :
Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N2] = 0,45 (M); [H2] = 0,14 (M); [NH3] = 0,62 (M). Giá trị hằng số cân bằng KC của phản ứng trên gần nhất với
Câu 5 :
Dung dịch nào dưới đây có pH > 7?
Câu 6 :
Cho các phát biểu: (a) Trong bảng tuần hoàn, nguyên tố nitrogen ở ô số 7, chu kì 2, nhóm VA. (b) Trong NH3, nitrogen thể hiện số oxi hóa thấp nhất của nitrogen trong hợp chất. (c) Nitrogen kém hoạt động hóa học trong mọi điều kiện nên được sử dụng tạo môi trường trơ. (d) Nitrogen là chất khí không duy trì sự hô hấp, sự cháy; ít tan trong nước vì phân tử khối nhỏ. (đ) Trong các phản ứng hóa học, nitrogen chỉ thể hiện tính oxi hóa. Số phát biểu đúng là
Câu 7 :
Cho một số ứng dụng: (1) Nguyên liệu tổng hợp ammonia. (2) Khí bảo vệ để hàn kim loại. (3) Làm bóng đèn (4) Bảo quản trái cây và ngũ cốc. Những ứng dụng nào dựa trên cơ sở tính kém hoạt động hoá học của nitrogen?
Câu 8 :
Ca dao Việt Nam có câu thơ: “Lúa chiêm lấp ló đầu bờ Hễ nghe tiếng sấm phất cờ mà lên” Có bao nhiêu giải thích dưới đây đúng về câu ca dao trên thông qua kiến thức đã học? (1) Khí nitrogen khá trơ về mặt hóa học ở nhiệt độ thường nhưng khi có mặt tia lửa điện, nitrogen có thể tham gia phản ứng với khí oxygen trong không khí. (2) Các cơn mưa to thường kèm theo sấm sét sẽ tạo ra tia lửa điện, là điều kiện để xảy ra phản ứng: N2 + O2 \( \to \) 2NO. (3) NO được sinh ra tan vào nước và được cây hấp thụ. (4) Nitrogen được chuyển thành dạng NO3- nên cây có thể dễ dàng hấp thụ. (5) Quy trình chuyển hóa của nitrogen trong quá trình trên là: N2 ⟶ NO ⟶ NO2 ⟶ HNO3.
Câu 9 :
Cho các chất: Cu, CuO, BaSO4, Mg, KOH, C, Na2CO3. Tổng số chất tác dụng với dung dịch H2SO4 đặc, nóng là
Câu 10 :
Cho các phát biểu sau: (a) Khi làm vỡ nhiệt kế thủy ngân, có thể dùng bột sulfur rắc lên thủy ngân rồi gom lại. (b) Trong phản ứng sulfur tác dụng với kim loại, kim loại bị oxi hóa lên số oxi hóa cao nhất. (c) Có thể điều chế sulfur dioxide bằng phản ứng giữa sulfur và oxygen. (d) Sulfur có cả tính oxi hóa và tính khử. (đ) Sulfur là chất rắn, màu vàng, có mùi hắc ở điều kiện thường. Có phát biểu sai là
Câu 11 :
Dung dịch sulfuric acid đặc có thể làm khô khí ẩm nào trong số các khí sau: HCl, HBr, CO2, SO2, SO3, O2 và NH3?
Câu 12 :
Khí nào dưới đây đóng vai trò là nguyên nhân chính gây ra mưa acid?
Câu 13 :
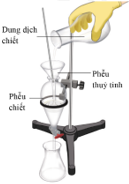
Hình bên mô tả dụng cụ để tách hỗn hợp các chất. Phương pháp nào được sử dụng trong trường hợp này?
Câu 14 :
Aniline được dùng để sản xuất metylendiamiline. Ngoài ra chúng còn được dùng để sản xuất thuốc nhuộm, chế biến cao su, sản xuất thuốc chữa bệnh,… Một trong những giai đoạn điều chế Aniline là nitrate hóa benzene. Do đó, aniline thu được thường lẫn benzene. Sử dụng phương pháp nào để tách riêng aniline ra khỏi hỗn hợp đó? Biết nhiệt độ sôi của benzene là 80,1oC, aniline là 184,1oC.
Câu 15 :
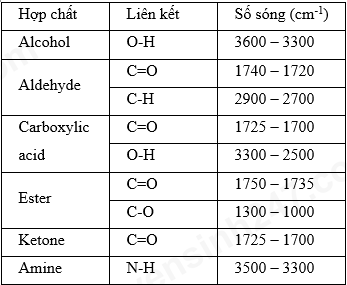
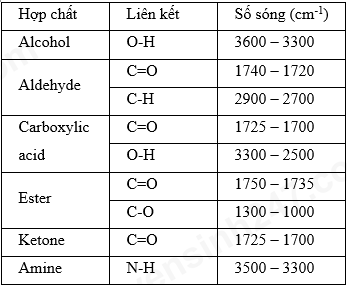
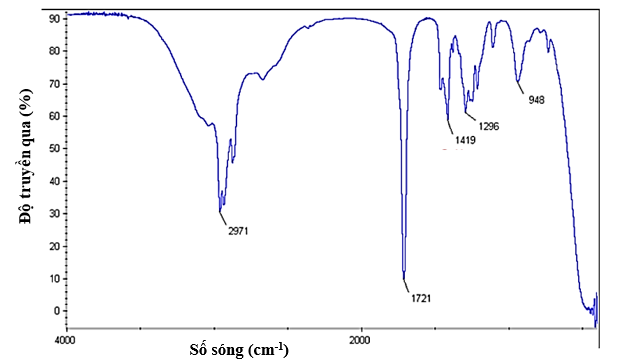
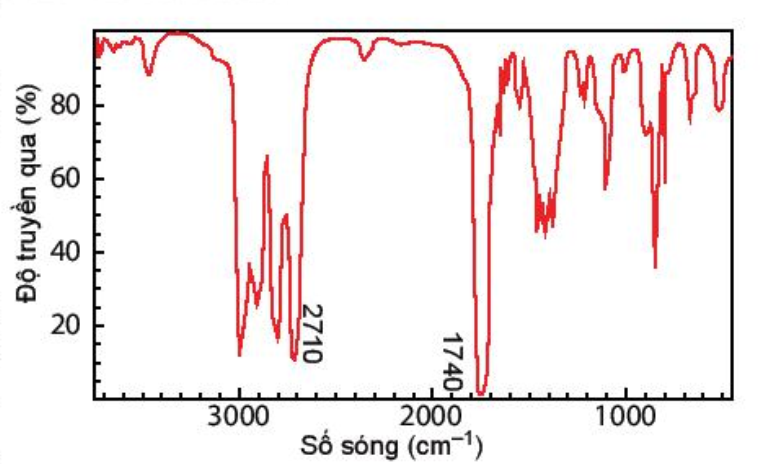
Chất X có công thức phân tử là C6H12O2 và có phổ hồng ngoại (như hình) nhóm chức có trong phân tử chất X.
Nhóm chức có trong phân tử chất X là
Câu 16 :
Hợp chất A có công thức phân tử C3H6O. Khi đo phổ hồng ngoại cho kết quả như hình dưới. Công thức cấu tạo của A là
Câu 17 :
Chất nào dưới đây là dẫn xuất hydrocarbon?
Câu 18 :
Isoamyl acetate còn gọi là dầu chuối, thường được dùng để tạo mùi chuối trong thực phẩm. Do có mùi tạo hưng phấn, có cường độ mạnh và ít độc, isoamyl acetate còn được dùng để kiểm tra hiệu quả của mặt nạ chống độc hoặc mặt nạ khí.
Công thức phân tử của isoamyl acetate là
Câu 19 :
Tính chất vật lí chung của các chất hữu cơ là
Câu 20 :
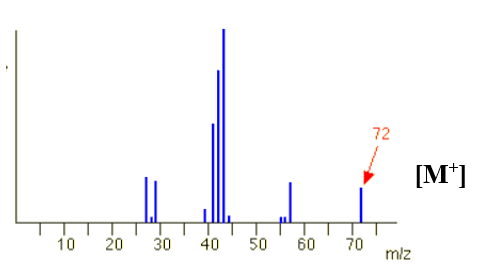
Kết quả phân tích nguyên tố cho thấy thành phần phần trăm về khối lượng của các nguyên tố carbon trong hydrocarbon X là 83,33%. Dựa trên thông tin đã cho và phổ khối lượng của X ở hình bên, lập được công thức phân tử của hydrocarbon X là
Lời giải và đáp án
Câu 1 :
Cho 2 mol CH3COOH vào 1 mol CH3OH xảy ra phản ứng: CH3COOH(l) + CH3OH(l) ⇌ CH3COOCH3(l) + H2O(l) Sau khi phản ứng đạt trạng thái cân bằng, hiệu suất của phản ứng là 66,67%. Giá trị hằng số cân bằng của phản ứng là
Đáp án : C Phương pháp giải :
Sử dụng công thức tính hằng số cân bằng để tìm lượng chất phản ứng. Lời giải chi tiết :
CH3COOH(l) + CH3OH(l) ⇌ CH3COOCH3(l) + H2O(l) Ban đầu: 2 1,5 Phản ứng: 1 ⟵ 1,5.66,67% = 1 ⟶ 1 ⟶ 1 Cân bằng: 1 0,5 1 1 \({K_C} = \frac{{1.1}}{{1.0,5}} = 2\)
Câu 2 :
Các bước dưới đây mô tả ngắn gọn cách tiến hành chuẩn độ dung dịch sodium hydroxide bằng dung dịch hydrochloric acid. (1) Thêm vài giọt chất chỉ thị thích hợp vào dung dịch. (2) Ghi lại thể tích HCl cuối cùng và lặp lại 3 lần để thu được kết quả phù hợp. (3) Thêm HCl vào burette và ghi thể tích. (4) Lấy 25 mL dung dịch NaOH vào bình tam giác bằng pipet 25 mL. (5) Mở khóa burette, nhỏ từ từ từng giọt dung dịch HCl vào bình tam giác đựng NaOH, lắc đều cho đến khi dung dịch đổi màu. Thứ tự thực hiện lần lượt các bước trên là
Đáp án : B Phương pháp giải :
Kiến thức về chuẩn độ acid – base. Lời giải chi tiết :
(4) Lấy 25 mL dung dịch NaOH vào bình tam giác bằng pipet 25 mL. (1) Thêm vài giọt chất chỉ thị thích hợp vào dung dịch. (3) Thêm HCl vào burette và ghi thể tích. (5) Mở khóa burette, nhỏ từ từ từng giọt dung dịch HCl vào bình tam giác đựng NaOH, lắc đều cho đến khi dung dịch đổi màu. (2) Ghi lại thể tích HCl cuối cùng và lặp lại 3 lần để thu được kết quả phù hợp.
Câu 3 :
Cho phản ứng: C(s) + CO2(g) ⇌ 2CO(g) Ở trạng thái cân bằng, hằng số cân bằng của phản ứng có biểu thức:
Đáp án : C Phương pháp giải :
Kiến thức về hằng số cân bằng. Lời giải chi tiết :
Ở trạng thái cân bằng, hằng số cân bằng của phản ứng có biểu thức \({K_C} = \frac{{{{{\rm{[}}CO]}^2}}}{{{\rm{[}}C{O_2}]}}\) .
Câu 4 :
Trong quá trình tổng hợp ammonia, ở trạng thái cân bằng [N2] = 0,45 (M); [H2] = 0,14 (M); [NH3] = 0,62 (M). Giá trị hằng số cân bằng KC của phản ứng trên gần nhất với
Đáp án : B Phương pháp giải :
Công thức tính hằng số cân bằng KC của phản ứng. Lời giải chi tiết :
\({K_C} = \frac{{0,{{62}^2}}}{{0,45.0,{{14}^3}}} = 311,3\)
Câu 5 :
Dung dịch nào dưới đây có pH > 7?
Đáp án : A Phương pháp giải :
Dung dịch có pH > 7 ⟶ Dung dịch có môi trường base. Lời giải chi tiết :
Dung dịch có môi trường base ⟶ NaHCO3.
Câu 6 :
Cho các phát biểu: (a) Trong bảng tuần hoàn, nguyên tố nitrogen ở ô số 7, chu kì 2, nhóm VA. (b) Trong NH3, nitrogen thể hiện số oxi hóa thấp nhất của nitrogen trong hợp chất. (c) Nitrogen kém hoạt động hóa học trong mọi điều kiện nên được sử dụng tạo môi trường trơ. (d) Nitrogen là chất khí không duy trì sự hô hấp, sự cháy; ít tan trong nước vì phân tử khối nhỏ. (đ) Trong các phản ứng hóa học, nitrogen chỉ thể hiện tính oxi hóa. Số phát biểu đúng là
Đáp án : A Phương pháp giải :
Kiến thức về nitrogen và hợp chất của nitrogen. Lời giải chi tiết :
(a) đúng. (b) đúng. (c) sai, vì nitrogen hoạt động hóa học ở nhiệt độ cao. (d) sai, vì khí nitrogen ít tan trong nước do phân tử không phân cực. (đ) sai, vì trong các phản ứng hóa học nitrogen thể hiện cả tính khử và tính oxi hóa. ⟹ Có 2 phương án đúng.
Câu 7 :
Cho một số ứng dụng: (1) Nguyên liệu tổng hợp ammonia. (2) Khí bảo vệ để hàn kim loại. (3) Làm bóng đèn (4) Bảo quản trái cây và ngũ cốc. Những ứng dụng nào dựa trên cơ sở tính kém hoạt động hoá học của nitrogen?
Đáp án : C Phương pháp giải :
Kiến thức về tính chất hóa học của nitrogen. Lời giải chi tiết :
(1) sai, vì N2(g) + 3H2(g) (2) đúng. (3) đúng. (4) đúng.
Câu 8 :
Ca dao Việt Nam có câu thơ: “Lúa chiêm lấp ló đầu bờ Hễ nghe tiếng sấm phất cờ mà lên” Có bao nhiêu giải thích dưới đây đúng về câu ca dao trên thông qua kiến thức đã học? (1) Khí nitrogen khá trơ về mặt hóa học ở nhiệt độ thường nhưng khi có mặt tia lửa điện, nitrogen có thể tham gia phản ứng với khí oxygen trong không khí. (2) Các cơn mưa to thường kèm theo sấm sét sẽ tạo ra tia lửa điện, là điều kiện để xảy ra phản ứng: N2 + O2 \( \to \) 2NO. (3) NO được sinh ra tan vào nước và được cây hấp thụ. (4) Nitrogen được chuyển thành dạng NO3- nên cây có thể dễ dàng hấp thụ. (5) Quy trình chuyển hóa của nitrogen trong quá trình trên là: N2 ⟶ NO ⟶ NO2 ⟶ HNO3.
Đáp án : B Phương pháp giải :
Kiến thức về hợp chất của nitrogen với oxygen. Lời giải chi tiết :
Khí nitrogen khá trơ về mặt hóa học ở nhiệt độ thường nhưng khi có mặt tia lửa điện, nitrogen có thể tham gia phản ứng với khí oxygen trong không khí. Các cơn mưa to thường kèm theo sấm sét sẽ tạo ra tia lửa điện, là điều kiện để xảy ra phản ứng: N2 + O2 Khí NO sinh ra tiếp tục bị chuyển hóa thành NO2 theo phương trình: NO + 1/2O2 ⟶ NO2 NO2 tiếp tục bị oxi hóa thành HNO3 4NO2 + O2 + 2H2O ⟶ 4HNO3 Nitric acid tan vào nước mưa và chuyển hóa thành ion NO3- (một dạng chất đạm) làm cho cây lúa xanh tốt, phát triển hơn vì vậy mà có câu ca dao trên. (1), (2), (4), (5) đúng. (3) sai, vì cây chỉ hấp thụ nitrogen dưới dạng ion NO3-.
Câu 9 :
Cho các chất: Cu, CuO, BaSO4, Mg, KOH, C, Na2CO3. Tổng số chất tác dụng với dung dịch H2SO4 đặc, nóng là
Đáp án : B Lời giải chi tiết :
Cu, CuO, Mg, KOH, C tác dụng được với H2SO4 đặc nóng.
Câu 10 :
Cho các phát biểu sau: (a) Khi làm vỡ nhiệt kế thủy ngân, có thể dùng bột sulfur rắc lên thủy ngân rồi gom lại. (b) Trong phản ứng sulfur tác dụng với kim loại, kim loại bị oxi hóa lên số oxi hóa cao nhất. (c) Có thể điều chế sulfur dioxide bằng phản ứng giữa sulfur và oxygen. (d) Sulfur có cả tính oxi hóa và tính khử. (đ) Sulfur là chất rắn, màu vàng, có mùi hắc ở điều kiện thường. Có phát biểu sai là
Đáp án : B Phương pháp giải :
Lý thuyết về sulfur. Lời giải chi tiết :
(a) đúng. (b) sai, vì sulfur có tính oxi hóa trung bình nên không thể oxi hóa được kim loại lên số oxi hóa cao nhất (đối với kim loại có nhiều số oxi hóa). Fe + S ⟶ FeS. (c) đúng. (d) đúng. (đ) sai, vì sulfur không mùi. ⟹ 2 phát biểu sai.
Câu 11 :
Dung dịch sulfuric acid đặc có thể làm khô khí ẩm nào trong số các khí sau: HCl, HBr, CO2, SO2, SO3, O2 và NH3?
Đáp án : D Phương pháp giải :
Kiến thức về tính hóa nước của sulfuric acid đặc và nguyên tắc làm khô khí. Lời giải chi tiết :
Do sulfuric acid đặc tác dụng được với những chất như: NH3, SO3, HBr. 2NH3 + H2SO4 → (NH4)2SO4 nSO3 + H2SO4 → H2SO4.nSO3 oleum H2SO4 + 2HBr → Br2 + 2H2O + SO2 Dung dịch sulfuric acid đặc được dùng làm khô khí: HCl, CO2, SO2, O2.
Câu 12 :
Khí nào dưới đây đóng vai trò là nguyên nhân chính gây ra mưa acid?
Đáp án : B Phương pháp giải :
Lý thuyết về mưa acid. Lời giải chi tiết :
Sulfur dioxide và các oxide của nitrogen là nguyên nhân chính gây ra mưa acid.
Câu 13 :
Hình bên mô tả dụng cụ để tách hỗn hợp các chất. Phương pháp nào được sử dụng trong trường hợp này?
Đáp án : D Phương pháp giải :
Lý thuyết về phương pháp chiết. Lời giải chi tiết :
Phương pháp chiết được sử dụng trong trường hợp này.
Câu 14 :
Aniline được dùng để sản xuất metylendiamiline. Ngoài ra chúng còn được dùng để sản xuất thuốc nhuộm, chế biến cao su, sản xuất thuốc chữa bệnh,… Một trong những giai đoạn điều chế Aniline là nitrate hóa benzene. Do đó, aniline thu được thường lẫn benzene. Sử dụng phương pháp nào để tách riêng aniline ra khỏi hỗn hợp đó? Biết nhiệt độ sôi của benzene là 80,1oC, aniline là 184,1oC.
Đáp án : B Phương pháp giải :
Ứng dụng phương pháp chưng cất phân đoạn. Lời giải chi tiết :
Do nhiệt độ sôi của benzene và aniline chênh lệch nhau lớn (≈100oC) nên sử dụng phương pháp chưng cất phân đoạn để tách riêng aniline ra khỏi hỗn hợp.
Câu 15 :
Chất X có công thức phân tử là C6H12O2 và có phổ hồng ngoại (như hình) nhóm chức có trong phân tử chất X.
Nhóm chức có trong phân tử chất X là
Đáp án : A Phương pháp giải :
Lời giải chi tiết :
Trên phổ IR của phân tử C6H12O2 ở hình có tín hiệu đặc trưng của nhóm COOH. + Tín hiệu ở 2971 cm-1 là tín hiệu đặc trưng của liên kết O-H trong nhóm -COOH. + Tín hiệu ở 1721 cm-1 là tín hiệu đặc trưng của liên kết C=O trong trong nhóm -COOH. Chất X có công thức phân tử là C6H12O2 có chứa nhóm chức -COOH của carboxylic acid.
Câu 16 :
Hợp chất A có công thức phân tử C3H6O. Khi đo phổ hồng ngoại cho kết quả như hình dưới. Công thức cấu tạo của A là
Đáp án : D Phương pháp giải :
Lời giải chi tiết :
Quan sát phổ hồng ngoại của A thấy A có thể là hợp chất chứa nhóm chức aldehyde. Công thức cấu tạo của A là: CH3–CH2–CHO.
Câu 17 :
Chất nào dưới đây là dẫn xuất hydrocarbon?
Đáp án : C Phương pháp giải :
Dẫn xuất hydrocarbon là hợp chất hữu cơ của nguyên tố carbon với các nguyên tử nguyên tố khác như oxygen, nitrogen, sulfur,… Lời giải chi tiết :
Dẫn xuất hydrocarbon là C3H7ON.
Câu 18 :
Isoamyl acetate còn gọi là dầu chuối, thường được dùng để tạo mùi chuối trong thực phẩm. Do có mùi tạo hưng phấn, có cường độ mạnh và ít độc, isoamyl acetate còn được dùng để kiểm tra hiệu quả của mặt nạ chống độc hoặc mặt nạ khí.
Công thức phân tử của isoamyl acetate là
Đáp án : C Phương pháp giải :
Xác định công thức phân tử từ công thức cấu tạo thu gọn. Lời giải chi tiết :
Công thức phân tử của isoamyl acetate là C7H14O2.
Câu 19 :
Tính chất vật lí chung của các chất hữu cơ là
Đáp án : A Phương pháp giải :
Dựa vào tính chất vật lí của chất hữu cơ Lời giải chi tiết :
Tính chất vật lí chung của các chất hữu cơ là có nhiệt độ nóng chảy và nhiệt độ sôi thấp, tan tốt trong dung môi hữu cơ.
Câu 20 :
Kết quả phân tích nguyên tố cho thấy thành phần phần trăm về khối lượng của các nguyên tố carbon trong hydrocarbon X là 83,33%. Dựa trên thông tin đã cho và phổ khối lượng của X ở hình bên, lập được công thức phân tử của hydrocarbon X là
Đáp án : B Phương pháp giải :
\(C:H:O = \frac{{\% C}}{{12}}:\frac{{\% H}}{1}:\frac{{\% O}}{{16}}\) Xác định CTPT từ CTĐGN và phân tử khối. Lời giải chi tiết :
\(C:H = \frac{{\% C}}{{12}}:\frac{{\% H}}{1} = \frac{{83,33}}{{12}}:\frac{{16,67}}{1} = 6,94:16,67 = 5:12\) CTPT: (C5H12)n M = 72n = 72 ⟹ n = 1 CTPT: C5H12
|













 2NH3(g).
2NH3(g). 2NO.
2NO.