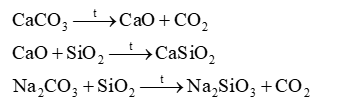Bài 34. Khai thác đá vôi. Công nghiệp silicate trang 92, 93 SBT Khoa học tự nhiên 9 Kết nối tri thứcTrong công nghiệp, đá vôi không được khai thác từ nguồn nào sau đây? Tổng hợp Đề thi vào 10 có đáp án và lời giải Toán - Văn - Anh
Lựa chọn câu để xem lời giải nhanh hơn
34.1 Trong công nghiệp, đá vôi không được khai thác từ nguồn nào sau đây? A. Nước biển B. Núi đá C. Hầm mỏ D. Bãi vỏ sò, ốc. Phương pháp giải: Dựa vào thành phần của đá vôi. Lời giải chi tiết: Trong công nghiệp, đá vôi không được khai thác từ nước biển vì nước biển không chứa nhiều CaCO3. 34.2 Thành phần chính của đá vôi là A. CaSO4 B. CaCO3 C. SiO2 D. MgSiO3 Phương pháp giải: Dựa vào thành phần của đá vôi. Lời giải chi tiết: Thành phần chính của đá vôi là CaCO3. Đáp án B 34.3 Phát biểu nào sau đây là sai? A. Đá vôi nghiền được sử dụng làm chất độn trong cao su. B. Calcium oxide được sử dụng trong sản xuất thủy tinh C. Silion oxide có ứng dụng sản xuất phân bón. D. Calcium hydroxide được sử dụng để khử chua đất trồng. Phương pháp giải: Dựa vào việc khai thác đá vôi. Lời giải chi tiết: C sai, SiO2 được dùng trong sản xuất thủy tinh. Đáp án B 34.4 Cho đoạn câu sau: Silion tinh khiết là vật liệu …(1)…, được sử dụng rộng rãi để chế tạo các vi mạch điện tử, thiết bị quang điện, cảm biến, pin Mặt Trời, …(2)… (SiO2 gần nguyên chất) được sử dụng trong máy phát siêu âm, dụng cụ quang học, sản phẩm thủy tinh chịu nhiệt, sợi cáp quang,… Chọn một trong các cụm từ sau để điền vào chỗ trống được đánh số (1), (2): A. dẫn điện, cát vàng B. xây dựng, xi măng C. chịu nhiệt, cát trắng D. bán dẫn, thạch anh. Phương pháp giải: Dựa vào công nghiệp silicate. Lời giải chi tiết: (1) bán dẫn; (2) thạch anh. 34.5 Nung nóng 10g một mẫu đá chứa 80% CaCO3 (về khối lượng) chỉ xảy ra phản ứng nhiệt phân muối calcium carbonate thành calcium oxide (rắn) và carbon dioxide (khí). Khối lượng chất rắn thu được sau phản ứng là A. 6,48g B. 4,48g C. 5,6g D. 8,00g Phương pháp giải: Dựa vào phản ứng nung đá vôi. Lời giải chi tiết: Khối lượng CaCO3 trong mẫu đá là: 10.80% = 8g m CaCO3 = 8 : 100 = 0,08 mol CaCO3 \( \to \)CaO + CO2 0,08 \( \to \) 0,08 m CaO = 0,08 . 56 = 4,48g Khối lượng chất rắn: 4,48 + 2 = 6,48g Đáp án A 34.6 a) Tại sao calcium hydroxide lại có ứng dụng khử chua đất trồng? b) Tại sao trộn vôi tôi với cát thành vữa để xây nhà, sau một thời gian vữa để trong không khí lại trở nên cứng, chắc? Phương pháp giải: Dựa vào tính chất của base. Lời giải chi tiết: a) Vì calcium hydroxide khi tan trong nước tạo dung dịch base làm giảm lượng H+ có trong đất nên được ứng dụng khử chua đất trồng. b) Vữa để trong không khí xảy ra phản ứng giữa Ca(OH)2 với CO2 trong khhông khí, tạo ra CaCO3 rắn chắc. 34.7 Viết các PTHH của các phản ứng xảy ra khi nấu thủy tinh. Theo em, giữa muối carbonate và muối silicate thì muối nào bền nhiệt hơn? Phương pháp giải: Dựa vào công nghiệp sản xuất thủy tinh. Lời giải chi tiết: Các phương trình hóa học: Dựa vào nhiệt độ nóng chảy của 2 muối, CaSiO3 bền hơn. 34.8 Một loại thủy tinh có thành phần gồm ba oxide CaO, Na2O và SiO2; trong đó O chiếm 46,86%, Ca chiếm 8,37% và Na chiếm 9,62% (về khối lượng). Xác định tỉ lệ mol của ba oxide trên trong thủy tinh. Phương pháp giải: Dựa vào hàm lượng % khối lượng các chất. Lời giải chi tiết: Giả sử có 100g thủy tinh m Na = 100.9,62% = 9,62g \( \to \)n Na = 9,62 : 23 = 0,418 \( \to \) n Na2O = 0,364 : 2 = 0,209 mol m Ca = 100.8,37% = 8,37g \( \to \)n Ca = 8,37 : 40 = 0,209 mol \( \to \)n CaO = 0,209 mol m O = 46,86%.100 = 46,86g \( \to \) n O = 46,86 : 16 = 2,93 mol Bảo toàn nguyên tố O có: n O = n CaO + n Na2O + 2.n SiO2 \( \to \) n SiO2 = 1,256 mol Tỉ lệ mol của ba oxide trên trong thủy tinh là: 0,209 : 0,209 : 1,256 = 1 : 1 : 6
|