Bài 26. Ôn tập chương 7 trang 93, 94, 95 SBT Hóa 12 Kết nối tri thứcTrong nhóm IA và IIA, Tổng hợp đề thi học kì 1 lớp 12 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa
Lựa chọn câu để xem lời giải nhanh hơn
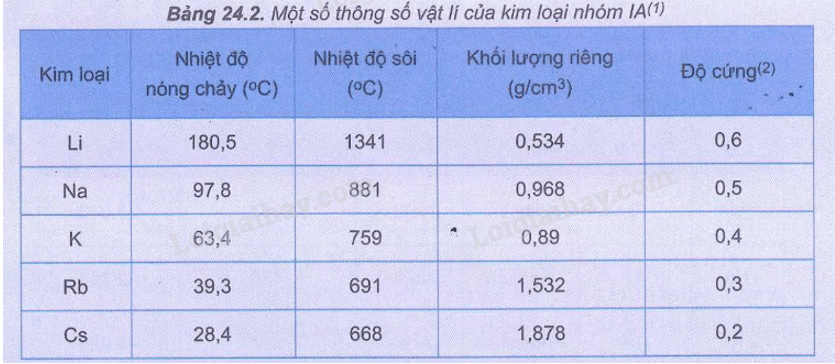
26.1 Trong nhóm IA và IIA, theo chiều từ trên xuống dưới trong mỗi nhóm, tính kim loại biến đổi như thế nào? A. Không đổi. B. Giảm dần. C. Tăng dần. D. Không có quy luật. Phương pháp giải: Dựa vào tính chất vật lí của nhóm IA và IIA. Lời giải chi tiết: Trong 1 nhóm A khi đi từ trên xuống dưới, điện tích hạt nhân nguyên tử tăng dần và số lớp electron cũng tăng. Do đó bán kính nguyên tử tăng ⟶ Khả năng nhường electron tăng⟶ Tính kim loại tăng Đáp án C 26.2 Khi đun nóng nước tự nhiên, muối nào sau đây bị phân huỷ tạo thành cặn đá vôi trong phích nước, ấm đun nước? A. Ca3(PO4)2. B. CaCl2. C. CaSO4. D. Ca(HCO3)2. Phương pháp giải: Dựa vào tính chất hóa học của nguyên tố nhóm IIA. Lời giải chi tiết: PTHH: Ca(HCO3)2 → CaCO3 ↓ + H2O + CO2 ↑ Đáp án D 26.3 Trong quá trình Solvay, NH3 được tái chế khi cho dung dịch NH4C1 tác dụng với A. CaO. B. NaOH. C. KOH. D. Ba(OH)2. Phương pháp giải: Dựa vào quá trình Solvay. Lời giải chi tiết: PTHH: 2NH4Cl + CaO → CaCl2 + H2O + 2NH3 Đáp án A 26.4 Ion Ca2+ (Z = 20) đóng vai trò thiết yếu trong việc phát triển xương, giúp duy trì hoạt động của cơ bắp, kích thích máu lưu thông, điều tiết một số loại hormone,... Tổng số proton và electron của ion Ca2+là A. 40. B. 42. C. 38. D. 18. Phương pháp giải: Dựa vào cấu hình electron của Ca. Lời giải chi tiết: Ion Ca2+có số electron = 18, số proton = 20 => Tổng số proton và electron của ion Ca2+là 38 Đáp án C 26.5 Ở nhiệt độ phòng, muối nào sau đây dễ tan trong nước? A. SrSO4. B. MgSO4. C. CaSO4. D. BaSO4. Phương pháp giải: Dựa vào độ tan của muối nhóm IIA. Lời giải chi tiết: Độ tan trong dãy muối sulfate từ MgSO4 đến BaSO4 giảm dần Dựa vào bảng 25.4 (SGK trang 120) Đáp án B 26.6 Khi đốt nóng tinh thể NaCl trong ngọn lửa đèn khí không màu thì tạo ra ngọn lửa có màu A. đỏ cam. B. tím nhạt. C. vàng. D. đỏ tía. Phương pháp giải: Dựa vào tính chất hóa học của nguyên tố nhóm IA. Lời giải chi tiết: Các ion kim loại nhóm IA cho ngọn lửa màu đặc trưng: ion Li+ màu đỏ tía, ion Na+ màu vàng, ion K+ màu tím nhạt. Đáp án C 26.7 Các đại dương là những kho muối vô tận với nhiều khoáng chất có giá trị dinh dưỡng cao. Trong nước biển, hai nguyên tố kim loại có nhiều nhất là A. sodium và magnesium. B. đồng và kẽm. C. nhôm và sắt. D. vàng và bạc. Phương pháp giải: Dựa vào các trạng thái tự nhiên của kim loại IA, IIA. Lời giải chi tiết: Trong nước biển, hai nguyên tố kim loại có nhiều nhất là sodium và magnesium. Đáp án A 26.8 Kim loại Na ở chu kì 3, nhóm IA trong bảng tuần hoàn, cấu hình electron lớp ngoài cùng của nguyên tử Na ở trạng thái cơ bản là A. 3s23p5. B. 3s2. C. 3s1. D. 3s23p1. Phương pháp giải: Dựa vào cấu hình electron của Na. Lời giải chi tiết: Chu kì 3 => có 3 lớp electron; nhóm IA => có 1 electron ở lớp ngoài cùng. Đáp án C 26.9 Các hợp chất dễ tan của kim loại kiềm, kiềm thổ là thành phần cung cấp dinh dưỡng của nhiều loại phân bón hoá học phổ biến. Hợp chất nào sau đây dễ tan, là thành phần dinh dưỡng chính trong phân bón superphosphate? ; A. KCl. B. CaSO4.2H2O. C. NaNO3. D. Ca(H2PO4)2. Phương pháp giải: Dựa vào tính chất của hợp chất nhóm IIA. Lời giải chi tiết: Thành phần dinh dưỡng chính trong phân bón superphosphate là Ca(H2PO4)2. Đáp án D 26.10 Kim loại nhóm IA nào sau đây dễ mất electron hoá trị nhất, được dùng sản xuất tế bào quang điện? A. Cs. B. Li. C. Na. D. K. Phương pháp giải: Dựa vào tính chất hóa học của nhóm IA. Lời giải chi tiết: Trong 1 nhóm A khi đi từ trên xuống dưới, điện tích hạt nhân nguyên tử tăng dần và số lớp electron cũng tăng. Do đó bán kính nguyên tử tăng ⟶ Khả năng nhường electron tăng. Đáp án A 26.11 Trong các kim loại nhóm IA từ Li đến Cs, nhiệt độ nóng chảy và độ cứng biến đổi như thế nào? A. Không đổi. B. Giảm dần. C. Tăng dần. D. Không có quy luật. Phương pháp giải: Dựa vào bảng 24.2 (SGK trang 110)
Lời giải chi tiết: Trong các kim loại nhóm IA từ Li đến Cs, nhiệt độ nóng chảy và độ cứng giảm dần. Đáp án B 26.12 Thực hiện bốn phản ứng hoá học theo sơ đồ: Biết X, Y, Z, T là các hợp chất của kim loại. Công thức hoá học của T là A. NaOH. B. CaCO3. C.Na2CO3. D. CaO. Phương pháp giải: Dựa vào tính chất hóa học của nguyên tố IA, IIA. Lời giải chi tiết: X là NaHCO3; Y là Na2CO3, Z là CaCO3, T là CaO Đáp án D 26.13 Xét phản ứng phân huỷ muối carbonate của kim loại nhóm IIA: MCO3(s) MO(s) + CO2(g) \({\Delta _r}H_{298}^0\) Từ MgCO3 đến BaCO3, biến thiên enthalpy chuẩn của phản ứng biến đổi như thế nào? A. Không đổi. B. Giảm dần. C. Tăng dần. D. Không có quy luật. Phương pháp giải: Dựa vào bảng biến thiên enthalpy chuẩn. Lời giải chi tiết:
Từ MgCO3 đến BaCO3, biến thiên enthalpy chuẩn của phản ứng tăng dần. Đáp án C 26.14 Ở nhiệt thường, độ tan của các hydroxide tăng dần trong dãy từ Mg(OH)2 đến Ba(OH)2. Từ thông tin này có thể dự đoán được khả năng phản ứng với nước của các kim loại từ Mg đến Ba biến đổi như thế nào? A. Tăng dần. B. Không đổi. C. Không có quy luật. D. Giảm dần. Phương pháp giải: Dựa vào tính chất của nguyên tố nhóm IIA. Lời giải chi tiết: Trong phản ứng của kim loại nhóm IIA với nước, sản phẩm tạo thành càng dễ tan thì càng dễ giải phóng khỏi bề mặt kim loại, tạo điều kiện để kim loại tiếp tục phản ứng với nước. Khả năng phản ứng với nước của các kim loại từ Mg đến Ba tăng dần. Đáp án A 26.15 Nước chứa nhiều các ion nào sau đây có tính cứng toàn phần? A. Mg2+, Ca2+, HCO3-, SO42-. B. Na+, K+, SO42-, Cl-. C. Mg2+, Ca2+, HCO3-. D. Mg2+, Ca2+, SO42-, Cl-. Phương pháp giải: Dựa vào khái niệm về nước cứng. Lời giải chi tiết: Nước có tính cứng toàn phần là nước chứa các ion: Mg2+, Ca2+, HCO3-, SO42-, Cl- Đáp án A 26.16 Phân tích một mẫu nước tự nhiên thấy chứa nhiều các ion: Na+, Ca2+, HCO3-, Cl- và SO42-. Chất nào sau đây có thể làm mềm mẫu nước trên? A. Na2CO3. B. Ca(OH)2. C. NaOH. D. HC1. Phương pháp giải: Dựa vào các biện pháp làm mềm nước cứng. Lời giải chi tiết: Mẫu nước trên là nước có tính cứng toàn phần => Dùng Na2CO3 để tạo kết tủa với Mg2+ và Ca2+ nên có thể làm mềm mẫu nước. Đáp án A 26.17 Một loại nước cứng khi đun sôi thì trở thành nước mềm. Trong loại nước này có hoà tan những hợp chất nào sau đây? A. Ca(HCO3)2 và Mg(HCO3)2. B. Ca(HCO3)2 và MgSO4. C. CaSO4 và MgCl2. D. MgCl2 và CaCl2. Phương pháp giải: Dựa vào cách làm mềm nước cứng. Lời giải chi tiết: Một loại nước cứng khi đun sôi thì mất tính cứng do muối hydrogencarbonate chuyển thành muối carbonate không tan → Nước cứng có tính cứng tạm thời → Trong nước cứng này có hòa tan các chất Ca(HCO3)2 và Mg(HCO3)2 Đáp án A 26.18 Cho sơ đồ chuyển hoá sau: Biết: X, Y, Z, T, E là các hợp chất khác nhau; mỗi mũi tên ứng với một phương trình hoá học. Các chất Z, E thoả mãn sơ đồ trên lần lượt là A. Na2CO3, H2SO4. B. CO2, KHSO4. C. NaHCO3, Na2SO4. D. CO2, BaSO4. Phương pháp giải: Dựa vào tính chất hóa học của nguyên tố nhóm IIA. Lời giải chi tiết: X: H2O; Y: Ca(OH)2; Z: CO2; T: Ca(HCO3)2; E: KHSO4 Đáp án B 26.19 Các dung dịch muối ăn, phèn chua, nước vôi trong được kí hiệu ngẫu nhiên là X, Y, Z. Một số kết quả thí nghiệm được ghi ở bảng dưới đây.
Các dung dịch ban đầu tương ứng với các kí hiệu là A. Y, Z, X. B. Z, X, Y. C. X, Y, Z. D. Y, X, Z. Phương pháp giải: Dựa vào tính chất hóa học của nhóm IIA. Lời giải chi tiết: X: làm dung dịch phenolphthalein chuyển màu hồng => X là nước vôi trong Z: tác dụng với dung dịch BaCl2 tạo kết tủa trắng => Z là phèn chua =>Y là muối ăn Đáp án A 26.20 Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d ở các câu 26.20 - 26.21. Sodium chloride là hợp chất ion. a) Ở trạng thái nóng chảy, sodium chloride có khả năng dẫn điện. b) Sodium chloride có nhiệt độ nóng chảy cao. c) Trong tinh thể sodium chloride, các ion có thể di chuyển tự do. d) Khi dùng búa đập vào hạt muối thì hạt muối bị biến dạng do có tính dẻo. Phương pháp giải: Dựa vào hợp chất nguyên tố nhóm IA. Lời giải chi tiết: a. Đúng vì ở trạng thái nóng chảy hoặc khi hòa tan vào dung dịch, các ion có thể chuyển động khá tự do nên hợp chất NaCl dẫn điện. b. Đúng vì NaCl là hợp chất ion. Trong tinh thể NaCl, giữa các ion có lực hút tĩnh điện rất mạnh nên NaCl nóng chảy ở nhiệt độ cao. c. Sai vì ở trạng thái rắn, các ion không di chuyển tự do được nên NaCl không dẫn điện. d. Sai vì khi dùng búa đập vào hạt muối thì hạt muối bị vỡ vụn do không có tính dẻo. 26.21 Cho độ tan của CaSO4.2H2O trong nước ở các nhiệt độ như sau:
a) Độ tan của CaSO4.2H2O trong nước tăng dần theo nhiệt độ từ 0°C đến 80°C. b) Ở 20°C, dung dịch CaSO4 bão hoà pha chế từ CaSO4.2H2O có nồng độ 0,25%. c) CaSO4.2H2O là hợp chất dễ tan ở nhiệt độ 80°C. d) Calcium sulfate dễ tan nhất trong các muối sulfate của kim loại nhóm IIA. Phương pháp giải: Dựa vào tính tan của hợp chất nhóm IIA. Lời giải chi tiết: a. Sai vì Độ tan của CaSO4.2H2O trong nước tăng dần theo nhiệt độ từ 0°C đến 40°C. b. Đúng. c. Sai vì CaSO4.2H2O là hợp chất ít tan ở nhiệt độ 80°C. d. Sai vì magnesium sulfate dễ tan nhất trong các muối sulfate của kim loại nhóm IIA. 26.22 Hấp thụ hoàn toàn 1,408 g khí CO2 vào 300 mL dung dịch Ba(OH)2 a mol/L, thu được 3,152 g kết tủa. Giá trị của a là bao nhiêu? Phương pháp giải: Dựa vào tính chất của nguyên tố nhóm IIA. Lời giải chi tiết: n CO2 = 1,408 : 44 = 0,032 mol; n BaCO3 = 3,152 : 197 = 0,016 mol Nhận xét: Nếu chỉ tạo ra muối BaCO3 thì n CO2 = n BaCO3 => Loại vì n CO2 > n BaCO3. Vì vậy phản ứng giữa CO2 và Ba(OH)2 tạo ra muối là BaCO3 và Ba(HCO3)2 Bảo toàn nguyên tố C: n CO2 = n BaCO3 + 2.n Ba(HCO3)2 → n Ba(HCO3)2 = 0,008 mol Bảo toàn nguyên tố Ba: n Ba(OH)2 = n BaCO3 + n Ba(HCO3)2 = 0,016 + 0,008 = 0,024 mol → CM Ba(OH)2 = 0,024 : 0,3 = 0,08 mol/L 26.23 Một hộ gia đình mua vôi sống để khử chua cho một thửa ruộng có diện tích là 720 m2 với liều lượng 2 kg/100 m2. Biết giá vôi sống là 20 nghìn đồng/kg. Hộ gia đình trên cần bao nhiêu nghìn đồng để mua vôi sống? Phương pháp giải: Dựa vào dữ liệu đề bài cung cấp. Lời giải chi tiết: Số tiền mua vôi là: \(\frac{{20000.2.720}}{{100}} = 288000dong\) 26.24 Hấp thụ 0,06 mol CO2 vào dung dịch chứa a mol Ba(OH)2, thu được 2b mol kết tủa. Mặt khác, nếu hấp thụ 0,08 mol CO2 vào dung dịch chứa a mol Ba(OH)2, thu được b mol kết tủa. Giá trị của a là bao nhiêu? Phương pháp giải: Dựa vào tính chất hóa học của nguyên tố nhóm IIA. Lời giải chi tiết: Nhận xét: n CO2 trong thí nghiệm (2) > n CO2 trong thí nghiệm (1) nhưng thu được kết tủa ít hơn. Vậy trong thí nghiệm (2), kết tủa bị hòa tan một phần. Ta có: n Kết tủa = n OH- - n CO2 TN1: n kết tủa = 2b = 2.a – 0,06 mol TN2: n kết tủa = b = 2.a – 0,08 Giải hệ phương trình thu được: a = 0,05 và b = 0,02 mol 26.25 Cho m gam NaOH vào 2 lít dung dịch NaHCO3 nồng độ a mol/L, thu được 2 lít dung dịch X. Lấy 1 lít dung dịch X tác dụng với dung dịch BaCl2 dư thu được 11,82 g kết tủa. Mặt khác, cho 1 lít dung dịch X vào dung dịch CaCl2 dư rồi đun nóng, sau khi kết thúc các phản ứng thu được 7,0 g kết tủa Giá trị của m là bao nhiêu? Phương pháp giải: Dựa vào tính chất hóa học của nguyên tố nhóm IA. Lời giải chi tiết: Thí nghiệm 1: NaOH + NaHCO3 → Na2CO3 Na2CO3 + BaCl2 → BaCO3 + 2NaCl n BaCO3 =\(\frac{{11,82}}{{197}} = 0,06mol\) => n Na2CO3 = 0,06 mol Thí nghiệm 2: n CaCO3 =\(\frac{7}{{100}} = 0,07mol\) Na2CO3 + CaCl2 → 2NaCl + CaCO3 0,06 → 0,06 2NaHCO3 + CaCl2 0,02 ← (0,07 – 0,06) Nhận xét: Cùng là dung dịch X cho vào 2 dung dịch Ba2+ và Ca2+ để tạo kết tủa nhưng n CaCO3 > n BaCO3. Vậy trong dung dịch X ngoài Na2CO3 sẽ còn NaHCO3 dư. NaOH + NaHCO3 → Na2CO3 0,06 ←0,06 ←0,06 m NaOH = 0,06.40 = 4,8gam
|













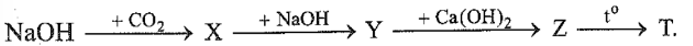

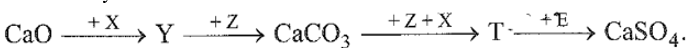
 2NaCl + CaCO3 + CO2 + H2O
2NaCl + CaCO3 + CO2 + H2O