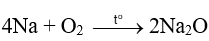Đề thi giữa kì 1 KHTN 8 Kết nối tri thức - Đề số 10Tổng hợp đề thi học kì 2 lớp 8 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Khoa học tự nhiên Dụng cụ đo thể tích chất lỏng là?Đề bài
I. Trắc nghiệm
Câu 1 :
Dụng cụ đo thể tích chất lỏng là?
Câu 2 :
Tình huống nguy hiểm có thể gặp phải trong phòng thực hành?
Câu 3 :
Khi thổi hơi thở vào dung dịch calcium hydroxide (nước vôi trong). Hiện tượng quan sát được trong ống nghiệm chứa dung dịch calcium hydroxide là
Câu 4 :
Yếu tố nào dưới đây được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín để ủ Ethanol (rượu) ?
Câu 5 :
Tỉ khối hơi của khí sulfur dioxide (SO2) đối với khí chlorine (Cl2) là:
Câu 6 :
Trong số quá trình và sự việc dưới đây, đâu là hiện tượng vật lí? (1) Hoà tan muối ăn vào nước ta được dung dịch muối ăn; (2) Cồn để trong lọ không kín bị bay hơi; (3) Nước bị đóng băng hai cực Trái Đất. (4) Cho vôi sống CaO hoà tan vào nước.
Câu 7 :
Sản phẩm của phản ứng
Câu 8 :
Phản ứng tỏa nhiệt là:
Câu 9 :
Cần lấy bao nhiêu lít N2 và H2 (đkc) để thu được 51 gam NH3 (hiệu suất phản ứng là 25%)
Câu 10 :
Tỉ khối của khí A đối với khí B là:
Câu 11 :
Hòa tan 14,36 gam NaCl vào 40 gam nước ở nhiệt độ 20oC thì được dung dịch bão hòa. Độ tan của NaCl ở nhiệt độ đó là
Câu 12 :
Muốn pha 150 gam dung dịch CuSO4 2% từ dung dịch CuSO4 20% thì khối lượng dung dịch CuSO4 20% cần lấy là
Câu 13 :
Hiệu suất phản ứng là
Câu 14 :
Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây.
Câu 15 :
Khối lượng của 0,01 mol khí SO2 là
Câu 16 :
Khí SO2 nặng hay nhẹ hơn không khí bao lần?
Câu 17 :
Hòa tan 117 gam NaCl vào nước để được 1,25 lít dung dịch. Dung dịch thu được có nồng độ mol là
Câu 18 :
Mg phản ứng với HCl theo phản ứng: Mg + HCl \( - \, - \to \)MgCl2 + H2. Sau phản ứng thu được 2,479 lít (đkc) khí hydrogen thì khối lượng của Mg đã tham gia phản ứng là
Câu 19 :
Cho hai thí nghiệm sau: Thí nghiệm 1: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 2M dư. Thí nghiệm 2: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 0,5M dư. So sánh tốc độ phản ứng ở hai thí nghiệm trên.
Câu 20 :
Carbon phản ứng với oxygen theo phương trình: Khối lượng C đã cháy là 3 kg và khối lượng CO2 thu được là 11 kg. Khối lượng O2 đã phản ứng là
Câu 21 :
Cho sơ đồ phản ứng: Al + H2O + NaOH \( \to \) NaAlO2 + H2 Sau khi cân bằng với các hệ số nguyên tố tối giản thì hệ số của các chất lần lượt là
II. Tự luận
Lời giải và đáp án
I. Trắc nghiệm
Câu 1 :
Dụng cụ đo thể tích chất lỏng là?
Đáp án : A Phương pháp giải :
Dựa vào dụng cụ thí nghiệm. Lời giải chi tiết :
Dụng cụ đo thể tích chất lỏng có thể là cốc đong, ống đong, bình tam giác. Đáp án A
Câu 2 :
Tình huống nguy hiểm có thể gặp phải trong phòng thực hành?
Đáp án : D Phương pháp giải :
Dựa vào an toàn trong phòng thí nghiệm. Lời giải chi tiết :
Ngửi hóa chất độc hại gây ảnh hưởng trực tiếp đến sức khỏe ngay lập tức như gây sốc, đau đầu, buồn nôn,… Tự tiện đổ các loại hóa chất vào nhau có thể gây ra phản ứng cháy nổ. Làm vỡ ống hóa chất gây thất thoát hóa chất, nếu hóa chất độc hại có thể gây hại cho con người. Đáp án D
Câu 3 :
Khi thổi hơi thở vào dung dịch calcium hydroxide (nước vôi trong). Hiện tượng quan sát được trong ống nghiệm chứa dung dịch calcium hydroxide là
Đáp án : C Phương pháp giải :
Dựa vào dấu hiệu phản ứng hóa học. Lời giải chi tiết :
Khi thổi hơi thở vào dung dịch calcium hydroxide (nước vôi trong) thấy dung dịch bị vẩn đục do tạo calcium carbonate. Đáp án C
Câu 4 :
Yếu tố nào dưới đây được sử dụng để làm tăng tốc độ phản ứng khi rắc men vào tinh bột đã được nấu chín để ủ Ethanol (rượu) ?
Đáp án : D Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng. Lời giải chi tiết :
Khi rắc men vào tinh bột làm tăng tốc độ phản ứng nhưng không bị tiêu hao trong quá trình ủ rượu nên men là xúc tác. Đáp án D
Câu 5 :
Tỉ khối hơi của khí sulfur dioxide (SO2) đối với khí chlorine (Cl2) là:
Đáp án : C Phương pháp giải :
Dựa vào công thức tính tỉ khối chất khí. Lời giải chi tiết :
Tỉ khối hơn của khí SO2 đối với khí Cl2 là: \(\frac{{{M_{S{O_2}}}}}{{{M_{C{l_2}}}}} = \frac{{64}}{{71}} = 0,9\) Đáp án C
Câu 6 :
Trong số quá trình và sự việc dưới đây, đâu là hiện tượng vật lí? (1) Hoà tan muối ăn vào nước ta được dung dịch muối ăn; (2) Cồn để trong lọ không kín bị bay hơi; (3) Nước bị đóng băng hai cực Trái Đất. (4) Cho vôi sống CaO hoà tan vào nước.
Đáp án : A Phương pháp giải :
Dựa vào sự biến đổi vật lí. Lời giải chi tiết :
Hiện tượng vật lí: 1, 2, 3 vì không có chất mới được tạo thành. Đáp án A
Câu 7 :
Sản phẩm của phản ứng
Đáp án : C Phương pháp giải :
Sản phẩm là những chất được tạo thành sau phản ứng. Lời giải chi tiết :
Sản phẩm của phản ứng là: Na2O. Đáp án C
Câu 8 :
Phản ứng tỏa nhiệt là:
Đáp án : A Phương pháp giải :
Dựa vào năng lượng phản ứng. Lời giải chi tiết :
Phản ứng tỏa nhiệt có nhiệt độ lớn hơn môi trường xung quanh. Đáp án A
Câu 9 :
Cần lấy bao nhiêu lít N2 và H2 (đkc) để thu được 51 gam NH3 (hiệu suất phản ứng là 25%)
Đáp án : A Phương pháp giải :
Dựa vào hiệu suất phản ứng. Lời giải chi tiết :
n NH3 = 51 : 17 = 3 mol PTHH: 3H2 + N2 \( \to \)2NH3 Vì hiệu suất phản ứng là 25% nên: n H2 = \(\frac{3}{2}.{n_{NH3}}:H\% = \frac{3}{2}.3.25\% = 18mol\) n N2 = \(\frac{1}{2}.{n_{NH3}}:H\% = \frac{1}{2}.3:25\% = 6mol\) V H2 = 18.24,79 = 446,22 lít V N2 = 6.24,79 = 148,74 lít Đáp án A
Câu 10 :
Tỉ khối của khí A đối với khí B là:
Đáp án : B Phương pháp giải :
Dựa vào công thức tính tỉ khối chất khí. Lời giải chi tiết :
Tỉ khối của chất khí A đối với B là: dA/B = MA/MB. Đáp án B
Câu 11 :
Hòa tan 14,36 gam NaCl vào 40 gam nước ở nhiệt độ 20oC thì được dung dịch bão hòa. Độ tan của NaCl ở nhiệt độ đó là
Đáp án : B Phương pháp giải :
Dựa vào công thức tính độ tan Lời giải chi tiết :
Độ tan của NaCl ở nhiệt độ 20oC là: \(\frac{{14,36}}{{40}}.100 = 35,9\) Đáp án B
Câu 12 :
Muốn pha 150 gam dung dịch CuSO4 2% từ dung dịch CuSO4 20% thì khối lượng dung dịch CuSO4 20% cần lấy là
Đáp án : B Phương pháp giải :
Dựa vào công thức tính nồng độ %. Lời giải chi tiết :
Khối lượng CuSO4 trong 150g là: 150.2% = 3g Thể tích dung dịch CuSO4 20% là: 3 : 20% = 15g Đáp án B
Câu 13 :
Hiệu suất phản ứng là
Đáp án : D Phương pháp giải :
Dựa vào khái niệm về hiệu suất phản ứng. Lời giải chi tiết :
Hiệu suất phản ứng là tỉ khối giữa lượng sản phẩm thu được theo thực tế và lượng sản phẩm theo lí thuyết. Đáp án D
Câu 14 :
Tốc độ phản ứng không phụ thuộc yếu tố nào sau đây.
Đáp án : A Phương pháp giải :
Dựa vào các yếu tố ảnh hưởng đến tốc độ phản ứng. Lời giải chi tiết :
Tốc độ phản ứng không phụ thuộc vào thời gian xảy ra phản ứng. Đáp án A
Câu 15 :
Khối lượng của 0,01 mol khí SO2 là
Đáp án : D Phương pháp giải :
Dựa vào công thức tính khối lượng gam của chất: m = n.M Lời giải chi tiết :
Khối lượng của 0,01 mol khí SO2 là: 0,01.64 = 0,64g Đáp án D
Câu 16 :
Khí SO2 nặng hay nhẹ hơn không khí bao lần?
Đáp án : A Phương pháp giải :
Dựa vào tỉ khối của chất khí với không khí. Lời giải chi tiết :
Tỉ khối khí SO2 với không khí là: \(\frac{{{M_{S{O_2}}}}}{{{M_{KK}}}} = \frac{{64}}{{29}} = 2,2\) Vậy khí SO2 nặng hơn không khí khoảng 2,2 lần. Đáp án A
Câu 17 :
Hòa tan 117 gam NaCl vào nước để được 1,25 lít dung dịch. Dung dịch thu được có nồng độ mol là
Đáp án : C Phương pháp giải :
Dựa vào công thức tính nồng độ mol. Lời giải chi tiết :
n NaCl = 117 : 58,5 = 2 mol CM NaCl = \(\frac{{{n_{NaCl}}}}{V} = \frac{2}{{1,25}} = 1,6M\) Đáp án C
Câu 18 :
Mg phản ứng với HCl theo phản ứng: Mg + HCl \( - \, - \to \)MgCl2 + H2. Sau phản ứng thu được 2,479 lít (đkc) khí hydrogen thì khối lượng của Mg đã tham gia phản ứng là
Đáp án : A Phương pháp giải :
Dựa vào tính theo phương trình hóa học. Lời giải chi tiết :
n H2 = 2,479 : 24,79 = 0,1 mol theo phương trình hóa học: n H2 = n Mg = 0,1 mol m Mg = 0,1.24 = 2,4gam Đáp án A
Câu 19 :
Cho hai thí nghiệm sau: Thí nghiệm 1: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 2M dư. Thí nghiệm 2: Cho mảnh Mg có khối lượng là a gam vào dung dịch HCl 0,5M dư. So sánh tốc độ phản ứng ở hai thí nghiệm trên.
Đáp án : B Phương pháp giải :
Dựa vào tốc độ phản ứng và chất xúc tác. Lời giải chi tiết :
ở thí nghiệm 1 sử dụng HCl có nồng độ lớn hơn so với thí nghiệm 2 nên tốc độ phản ứng 1 lớn hơn thí nghiệm 2. Đáp án B
Câu 20 :
Carbon phản ứng với oxygen theo phương trình: Khối lượng C đã cháy là 3 kg và khối lượng CO2 thu được là 11 kg. Khối lượng O2 đã phản ứng là
Đáp án : A Phương pháp giải :
Dựa vào định luật bảo toàn khối lượng. Lời giải chi tiết :
Áp dụng định luật bảo toàn khối lượng: m C + m O2 = m CO2 m O2 = m CO2 – m C = 11 – 3 = 8,0kg Đáp án A
Câu 21 :
Cho sơ đồ phản ứng: Al + H2O + NaOH \( \to \) NaAlO2 + H2 Sau khi cân bằng với các hệ số nguyên tố tối giản thì hệ số của các chất lần lượt là
Đáp án : D Phương pháp giải :
Dựa vào các bước lập phương trình hóa học. Lời giải chi tiết :
2Al + 2H2O + 2NaOH \( \to \) 2NaAlO2 + 3H2
II. Tự luận
Phương pháp giải :
Dựa vào dấu hiệu phản ứng. Lời giải chi tiết :
Dấu hiệu cho thấy đã có phản ứng hóa học xảy ra là có chất khí tạo thành. Phương trình chữ của phản ứng: Cồn + oxygen \( \to \)khí carbon dioxide + nước. Phương pháp giải :
Dựa vào định luật bảo toàn khối lượng. Lời giải chi tiết :
a) Phương trình chữ: iron + oxygen \( \to \) iron (II, III) oxide Phương trình hóa học: 3Fe + 2O2 \( \to \)Fe3O4 b) áp dung định luật bảo toàn khối lượng: m iron + m oxygen = m iron (II, III) oxide. c) m oxygen = m iron (II, III) oxide – m iron = 576 – 560 = 16g Phương pháp giải :
Dựa vào công thức tính nồng độ %. Lời giải chi tiết :
Khối lượng KOH trong 75 gam là: 75.30% = 22,5g Gọi khối lượng KOH cần thêm vào là a gam. C% KOH = \(\frac{{{m_{K{\rm{O}}H}}}}{{m{\rm{dd}}}}.100 = 56,25\% \) Ta có: \(\frac{{a + 22,5}}{{75 + a}}.100\% = 56,25\% \to a = 45g\) Lời giải chi tiết :
a)Viết PTHH: \({{\rm{H}}_{\rm{2}}}\,\,\,{\rm{ + }}\,\,\,{\rm{CuO}}\,\,\, \to \,{{\rm{H}}_{\rm{2}}}{\rm{O}}\,\,\,\,\,{\rm{ + }}\,\,{\rm{Cu}}{\rm{.}}\) b)Số mol Cu: \(\,\frac{{19,2}}{{64}}\,\,{\rm{ = }}\,\,{\rm{0,3}}\,\,{\rm{(mol)}}\,\) => số mol CuO là 0,3 mol. Số gam CuO: \({\rm{0,3}}\,{\rm{.}}\,80\,{\rm{ = }}\,\,24\,{\rm{(g)}}{\rm{.}}\) Số mol H2 = số mol Cu = 0,3 mol => thể tích H2 là: \({\rm{0,3}}\,{\rm{.}}\,\,24,79\,{\rm{ = }}\,\,7,437\,{\rm{(L)}}{\rm{.}}\) Khối lượng H2O là: \({\rm{0,3}}\,{\rm{.}}\,\,18\,\,{\rm{ = }}\,\,5,4\,{\rm{(g)}}{\rm{.}}\)
|