Bài 21. Cấu trúc hạt nhân trang 70, 71, 72 SBT Vật lí 12 Kết nối tri thứcĐánh dấu (x) vào các cột (đúng) hoặc (sai) tương ứng với các nội dung trong bảng dưới đây
Lựa chọn câu để xem lời giải nhanh hơn
21.1 Đánh dấu (x) vào các cột (đúng) hoặc (sai) tương ứng với các nội dung trong bảng dưới đây
Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết:
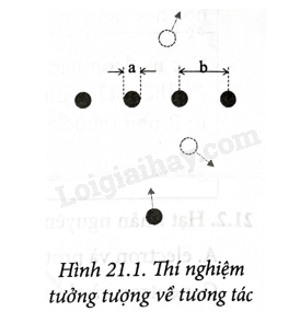
21.2 Hạt nhân nguyên tử gồm A. electron và proton. B. neutron và proton. C. neutron và electron. D. electron và pozitron Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết: Hạt nhân nguyên tử gồm neutron và proton. Đáp án: B 21.3 Các nguyên tử là nguyên tử đồng vị khi hạt nhân của chúng nó A. cùng số proton. B. cùng số neutron. C. cùng số neutron. D. cùng khối lượng. Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết: Đồng vị là các hạt nhân có cùng số proton. Đáp án: A 21.4 Hạt nhân 3115Pcó A. 31 proton và 15 neutron. B. 16 proton và 15 neutron. C. 15 proton và 16 neutron. D. 31 neutron và 15 proton. Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết: Hạt nhân 3115Pcó Z = 15 proton, N = 31 – 15 = 16 neutron. Đáp án: C 21.5 Hạt nhân nguyên tử 4119K gồm A. 19 proton và 41 nơtron. B. 19 proton và 22 neutron. D. 22 proton và 19 neutron. C. 41 proton và 19 neutron. Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết: Hạt nhân nguyên tử 4119Kgồm 19 proton, 41 – 19 = 22 neutron. Đáp án: B 21.6 Có 22 neutron trong đồng vị 42Ca. Số proton trong đồng vị 40Ca là A. 28. B. 26. C. 24. D. 20. Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết: Số proton trong cả 2 đồng vị đều có cùng giá trị là 42 – 22 = 20. Đáp án: D 21.7 Cho số Avogadro NA = 6,02.1023 mol-1. Số neutron có trong 3,5 g carbon 146C có giá trị bằng A. 3,01.1023. B. 6,02.1023. C. 9,03.1023. D. 12,04.1023. Phương pháp giải: Vận dụng kiến thức về hóa học Lời giải chi tiết: Số neutron có trong một nguyên tử carbon 146Clà N = 14 – 6 = 8. Số nguyên tử có trong m = 3,5 g carbon là: m⋅NAM=3,5⋅6,02⋅102314=1,505⋅1023 Số neutron có trong 3,5 g carbon là: 8.1,505.1023 = 12,04.1023. Đáp án: D 21.8 Cho khối lượng các nguyên tử oxygen và hydrogen lần lượt là 15,999 amu; 1,0078 amu. Số nguyên tử oxygen có trong 5 g nước xấp xỉ bằng A. 1,67.1023. B. 1,51.1023. C. 6,02.1023. D. 3,34.1023. Phương pháp giải: Vận dụng kiến thức về hóa học Lời giải chi tiết: Số nguyên tử oxygen có trong 1 mol (18g) H2O là: 6,02.1023 Số nguyên tử oxygen có trong 5 g H2O là: m⋅NAM=5⋅6,02⋅102318=1,67⋅1023. Đáp án: A 21.9 Xác định giá trị gần đúng bán kính của hạt nhân 23892U.. Hạt nhân 23892Ucó thể tích lớn gấp thể tích của hạt nhân 42Hekhoảng mấy lần? Phương pháp giải: Vận dụng kiến thức về hóa học Lời giải chi tiết: Áp dụng công thức: R=1,2.10−15A13(m);V=43πR3⇒V\~A. ⇒VUVHe=AUAHe=2384=59,5lần. 21.10 Đánh giá kích thước hạt nhân bằng thí nghiệm tưởng tượng sau: Khi cho một quả bóng lăn theo hướng ngẫu nhiên vào một dãy các quả bóng có đường kính a = 25 cm được gắn chặt cách đều nhau một khoảng cách không đổi là b = 50 cm (Hình 21.1) thì có thể tính được xác suất xảy ra va chạm giữa quả bóng chuyển động với một trong những quả bóng đứng yên rồi bật trở lại gần đúng là: Pbật=ab=50%.Còn xác suất quả bóng chuyển động đi xuyên qua dãy các quả bóng đứng yên là Pxuyên = 1 – Pbật = 50%. Nếu đường kính a của tất cả các quả bóng bằng 5 cm thì hai xác suất trên sẽ lần lượt là Pbật = 5% và Pxuyên = 95%, và nếu a = 5 mm thì hai xác suất này sẽ chỉ còn lần lượt là Pbật = 0,5% và Pxuyên = 99,5%. Hãy dựa vào sự tượng tự của thí nghiệm tưởng tượng trên với thí nghiệm của Rutherford bằng cách coi a là kích thước của hạt nhân nguyên tử vàng, coi b là kích thước của nguyên tử vàng, coi Pbật là tần suất đốm sáng ở vị trí 3 và pxuyên là tần suất đốm sáng ở trị trí 1, để chứng tỏ rằng thí nghiệm của Rutherford cho thấy kích thước hạt nhân nguyên tử chỉ bằng khoảng 110000 kích thước của nguyên tử, và điều này phù hợp với sự so sánh kích thước đã nêu trong thí nghiệm của Rutherford được nêu trong SGK. Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết: Trong Hình 21.1 SGK có chú thích: “chỉ 1 trong khoảng 10% hạt a bị lệch hơn 90°”. Lệch hơn 90° có nghĩa là bật ngược trở lại, do vậy pbat=ab=1104. Tức là hạt nhân nguyên tử vàng chỉ bằng khoảng 1104kích thước của nguyên tử vàng. 21.11 Người ta gọi khối lượng nguyên tử của một nguyên tố hoá học là khối lượng trung bình của một nguyên tử chất đó (tính theo đơn vị amu). Vì trong một khối chất hoá học trong thiên nhiên bao giờ cũng chứa một số đồng vị của chất đó với những tỉ lệ xác định, nên khối lượng nguyên tử của một nguyên tố hoá học không bao giờ là một số nguyên, trong khi đó số A của một hạt nhân bao giờ cũng là một số nguyên. Neon thiên nhiên có ba thành phần là 2010Ne;2110Nevà 2210Ne; trong đó thành phần 2110Nechỉ chiếm 0,26%, còn lại chủ yếu là hai thành phần kia. Khối lượng nguyên tử của neon là 20,179 amu. Tính tỉ lệ phần trăm của các thành phần 2010Nevà 2210Ne. Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết: Ta có: 20x + 22y + 21.0,26:100 = 20,179 Lại có: x + y = 1 – 0,26:100 = 0,9974 Từ hai phương trình trên ta xác định được: x = 0,9092; y = 0,0882. Vậy thành phần neon 2010Netrong neon thiên nhiên là 90,92% và thành phần neon 2010Nelà 8,82%. 21.12 Khí chlorine là hỗn hợp của hai đồng vị bền là 35Cl có khối lượng nguyên tử 34,969 amu, hàm lượng 75,4% và 37Cl có khối lượng nguyên tử 36,966 amu, hàm lượng 24,6%. Tính khối lượng nguyên tử của nguyên tố hoá học chlorine Phương pháp giải: Vận dụng kiến thức về nguyên tử Lời giải chi tiết: Khối lượng nguyên tử của chlorine: 34,969.75,4% + 36,966.24,6% = 35,46 amu.
>> Lộ Trình Sun 2025 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi TN THPT & ĐGNL; ĐGTD - Click xem ngay) tại Tuyensinh247.com. Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|