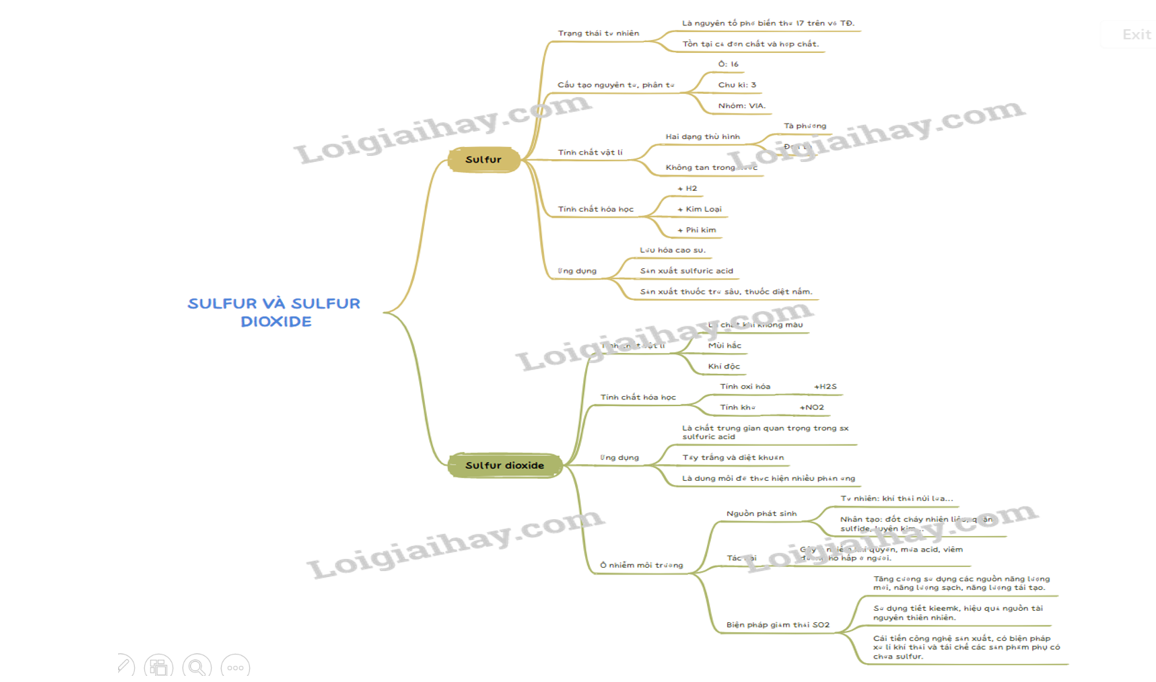
Lý thuyết Sulfur và sulfur dioxide - Hóa học 11 - Cánh diều- Kí hiệu hóa học: S. - Số hiệu nguyên tử: 16. - Trạng thái tự nhiên: Tồn tại ở cả đơn chất và hợp chất. + Đơn chất: vùng có núi lửa: Nhật Bản, Chile… + Hợp chất: khoáng vật, như pyrite (FeS2), Sphalerite (ZnS), thạch cao (CaSO4), barite (BaSO4)… Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Cánh diều Toán - Văn - Anh - Lí - Hóa - Sinh I. Sulfur 1. Trạng thái tự nhiên - Kí hiệu hóa học: S. - Số hiệu nguyên tử: 16. - Trạng thái tự nhiên: Tồn tại ở cả đơn chất và hợp chất. + Đơn chất: vùng có núi lửa: Nhật Bản, Chile… + Hợp chất: khoáng vật, như pyrite (FeS2), Sphalerite (ZnS), thạch cao (CaSO4), barite (BaSO4)… 2. Tính chất a, Tính chất vật lí - Trạng thái: chất rắn. - Màu sắc: màu vàng. - Không tan trong nước, tan nhiều trong dầu hòa, benzene. b, Tính chất hóa học - Tính oxi hóa + Tác dụng với kim loại VD: S + Fe → FeS S + Hg → HgS - Tính khử + Tác dụng được với một số phi kim, như: oxygen, chlorine, fluorine. VD: S + O2 → SO2 3. Ứng dụng - Sản xuất sulfuric acid, dược phẩm, phẩm nhuộm, thuốc trừ sâu, … II. Sulfur dioxide 1. Một số tính chất - Tính chất vật lí: SO2 là chất khí, không màu, có mùi hắc, độc, tan nhiều trong nước. - Tính chất hóa học: + Phản ứng với nước tạo môi trường acid. + Phản ứng với basic oxide tạo muối. + Phản ứng với base tạo muối. + Tính oxi hóa: So2 + 2H2 → 3S + 2H2O + Tính khử: SO2 + O2 → SO3 2. Ứng dụng - Là chất trung gian trong quá trình sản xuất sulfuric acid. -Tẩy trắng vải sợi, đường. + Sản xuất thuốc trừ sâu, thuốc sát trùng. + Diệt khuẩn , nấm mốc … 3. Một số biện pháp giảm thải sulfur dioxide vào khí quyển - Thay thế dần các nhiên liệu hóa thạch bằng nhiên liệu thân thiện với môi trường như ethanol, hydrogen… kết hợp với nguồn năng lượng tái tạo. - Dẫn khí thải của các nhà máy vào tháp hoặc bồn chứa các chất hấp phụ phù hợp như than hoạt tính, hấp phụ khí sulfur dioxide, trước khi thải ra môi trường. SƠ ĐỒ TƯ DUY
|