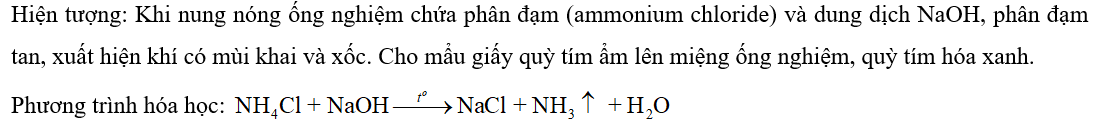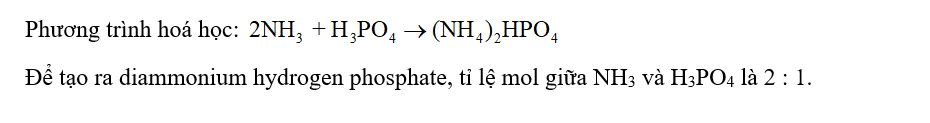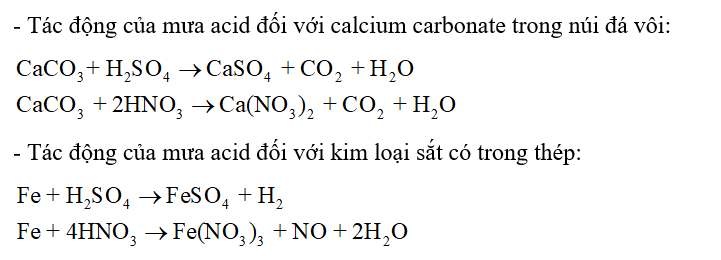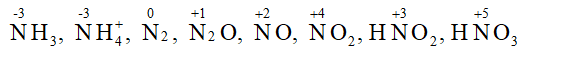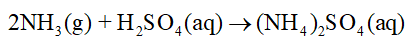Bài 5. Một số hợp chất quan trọng của nitrogen trang 30, 31, 32, 33, 34, 35, 36, 37, 38 Hóa học 11 Cánh diềuTrong các ao tù có thể tích tụ lượng đáng kể ion ammonium. Có thể nhận biết sự có mặt của ion ammonium trong các ao tù bằng những cách nào? Giải thích. Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Cánh diều Toán - Văn - Anh - Lí - Hóa - Sinh
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 30 MĐ Trong các ao tù có thể tích tụ lượng đáng kể ion ammonium. Có thể nhận biết sự có mặt của ion ammonium trong các ao tù bằng những cách nào? Giải thích. Phương pháp giải: Ion ammonium có công thức. Khi phản ứng với dung dịch kiềm, sinh khí NH3 (ammonia) có mùi khai, sốc, làm xanh quỳ tím ẩm. Lượng ion ammonium trong ao cung cấp một lượng nguyên tố N để rong, rêu, tảo,… trong ao phát triển. Lời giải chi tiết: Có thể nhận biết sự có mặt của ion ammonium trong các ao tù bằng những cách sau: + Sử dụng dung dịch kiềm phản ứng với nước trong ao, nếu có ion ammonia thì sinh ra khí NH3 có mùi khai, sốc, làm xanh quỳ tím ẩm. NH4+ + OH- → NH3 + H2O + Quan sát lượng rong, rêu, tảo,… trong ao, nếu chúng phát triển nhanh, nhiều, chứng tỏ trong ao có nhiều ion ammonium, cung cấp một lượng nguyên tố N để cho chúng phát triển. CH tr 31 CH1 Video hướng dẫn giải Cho thí nghiệm được thiết kế như hình dưới đây. Trong thí nghiệm này, nước pha phenolphthalein sẽ bị hút lên bình chứa khí ammonia và phun thành những tia màu hồng. Hãy giải thích hiện tượng trên. Phương pháp giải: Khí ammonia tan nhiều trong nước. Ở 20 oC, 1 bar, 1 lít nước có thể hòa tan 700 lít khí ammonia. NH3 (ammonia) là dung dịch có tính base theo thuyết acid – base của Brosted – Lowry. Dung dịch ammonia làm quỳ tím hóa xanh, phenolphthalein hóa hồng. Lời giải chi tiết: Khí ammonia tan nhiều trong nước. làm áp suất trong bình khí chứa ammonia giảm, hút nước có pha phenolphthalein lên bình, phun thành tia; khí ammonia có tính base, làm phenolphthalein hóa hồng nên các tia nước phun lên có màu hồng. CH tr 31 CH2 Khi giấy quỳ tím ẩm tiếp xúc với khí ammonia thì hiện tượng gì sẽ xảy ra? Phương pháp giải: NH3 (ammonia) là dung dịch có tính base theo thuyết acid – base của Brosted – Lowry. Dung dịch ammonia làm quỳ tím hóa xanh, phenolphthalein hóa hồng. Lời giải chi tiết: Khí ammonia tiếp xúc với nước trong quỳ tím ẩm, ammonia nhận H+ của nước, tạo thành ion ammonium (), dung dịch có tính base yếu, làm giấy quỳ tím hóa xanh. NH3 + H2O ⇌ NH4+ + OH- CH tr 32 CH Video hướng dẫn giải Ammonia thể hiện tính base, tính khử ở quá trình nào dưới đây? Giải thích. (1) Cho ammonia phản ứng với nitric acid (HNO3) để tạo phân bón ammonium nitrate (NH4NO3). (2) Dùng ammonia tẩy rửa lớp copper (II) oxide phủ trên bề mặt kim loại đồng, tạo kim loại, nước và khí nitrogen. Phương pháp giải: Thuyết acid – base của Brosted – Lowry: acid là chất cho H+, base là chất nhận H+ Trong phản ứng oxi hóa khử, chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng. Lời giải chi tiết:
CH tr 33 CH1 Video hướng dẫn giải Khi làm lạnh hỗn hợp khí gồm ammonia, hydrogen và nitrogen thì ammonia sẽ hoá lỏng trước. Tính chất vật lí nào của các chất giúp giải thích hiện tượng trên? Phương pháp giải: Khi làm lạnh hỗn hợp khí, chất nào có nhiệt độ hóa lỏng thấp hơn (về giá trị tuyệt đối nhỏ hơn) thì bị hóa lỏng trước. Lời giải chi tiết: Khi làm lạnh hỗn hợp khí gồm ammonia, hydrogen và nitrogen thì ammonia sẽ hoá lỏng trước. Nhiệt hóa lỏng của 3 chất giúp giải thích hiện tượng trên. Nhiệt hóa lỏng của N2, H2, NH3 lần lượt là: -196 oC; -252,87 oC; -33,3 oC. Do đó khi giữ nguyên áp suất và làm lạnh thiết bị thì khí NH3 sẽ hoá lỏng đầu tiên. CH tr 33 CH2 Nhận biết ion ammonium Chuẩn bị: Phân đạm ammonium chloride, dung dịch NaOH; ống nghiệm, đèn cồn, giấy quỳ. Tiến hành: Cho vài hạt phân đạm với thành phần chính là ammonium chloride vào ống nghiệm chứa dung dịch NaOH. Hơ nhẹ ống nghiệm trên ngọn lửa đèn cồn. Cho mẩu giấy quỳ đã tẩm ướt bằng nước lên miệng ống nghiệm. Yêu cầu: Quan sát hiện tượng, viết phương trình hoá học của phản ứng đã xảy ra. Phương pháp giải: Nhận biết muối ammonium bằng dung dịch kiềm, sinh ra khí ammonia có mùi khai và xốc. Lời giải chi tiết:
CH tr 33 VD Để giảm sốt hoặc giảm đau, người ta có thể dùng túi chườm lạnh chứa hoá chất. Hãy tìm hiểu về loại túi chườm lạnh này. Từ đó: a) Cho biết các chất thường được sử dụng trong túi chườm lạnh. b) Giải thích nguyên nhân giúp túi chườm lạnh có nhiệt độ thấp. Phương pháp giải: Muối ammonium () tan tốt trong nước, quá trình muối ammonium tan trong nước là quá trình thu nhiệt. Lời giải chi tiết: a) Các chất thường được sử dụng trong túi chườm lạnh: nước; muối ammonium như ammonium chloride (NH4Cl), ammonium nitrate (NH4NO3). b) Khi lớp ngăn cách giữa nước và muối ammonium trong túi chườm lạnh bị vỡ, muối ammonium hòa tan trong nước, đây là quá trình thu nhiệt, làm túi chườm lạnh có nhiệt độ thấp. Phương trình: NH4NO3(s) → NH4NO3(aq) ∆H < 0 CH tr 34 CH1 Video hướng dẫn giải Lượng lớn ammonium nitrate và ammonium chloride được sử dụng làm phân bón. Dựa vào đặc điểm phản ứng nhiệt phân của hai muối này, hãy cho biết muối nào có nguy cơ cháy nổ cao hơn trong quá trình lưu trữ. Phương pháp giải:
Lời giải chi tiết:
CH tr 34 CH2 Xác định tỉ lệ mol kết hợp giữa NH3 và H3PO4 để tạo ra diammonium hydrogen phosphate (dùng làm phân bón phức hợp DAP). Viết phương trình hoá học của phản ứng. Phương pháp giải: Viết phương trình phản ứng giữa NH3 và H3PO4 tạo (NH4)2HPO4 để xác định tỉ lệ mol của NH3 và H3PO4. Lời giải chi tiết:
CH tr 35 CH1 Video hướng dẫn giải Viết phương trình hoá học minh hoạ tác động của mưa acid đối với calcium carbonate trong núi đá vôi và với kim loại sắt có trong thép. Trong mưa acid chứa sulfuric acid (H2SO4) và nitric acid (HNO3).
Phương pháp giải: Trong mưa acid chứa sulfuric acid (H2SO4) và nitric acid (HNO3). Lời giải chi tiết:
CH tr 35 CH2 Cho biết số oxi hoá của nitrogen trong mỗi phân tử và ion sau: NH3,NH4+, N2, N2O, NO, NO2, HNO2, HNO3. Phương pháp giải: Số oxi hóa là điện tích quy ước của nguyên tử và được tính theo các quy tắc xác định số oxi hóa: - Trong đơn chất, số oxi hóa của nguyên tử bằng 0. - Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị. - Trong hợp chất, tổng số oxi hóa của nguyên tử trong phân tử bằng 0. - Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion. Lời giải chi tiết:
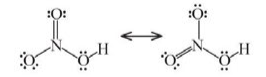
CH tr 36 CH1 Video hướng dẫn giải Công thức Lewis của HNO3 như dưới đây có phù hợp không? Phương pháp giải: Quy tắc octet: Khi hình thành liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững (8 electron lớp ngoài cùng – trừ helium) của nguyên tử khí hiếm. Quy tắc octet dùng cho sự tạo thành liên kết hóa học giữa các nguyên tử của nguyên tố thuộc chu kì 2 và một số nguyên tử của nguyên tố có tính kim loại, phi kim điển hình. Lời giải chi tiết: Công thức Lewis của HNO3 như hình trên là không phù hợp, vì nguyên tố nitrogen thuộc chu kì 2, liên kết được hình thành theo quy tắc octet. Số electron của N trong HNO3 là 10 electron, không phù hợp với quy tắc octet. Công thức Lewis của HNO3 như sau:
CH tr 36 CH2 Khi khơi thông nguồn nước thì nguy cơ xảy ra hiện tượng phú dưỡng sẽ tăng hay giảm? Giải thích. Phương pháp giải: Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng, bao gồm cả hợp chất nitrogen và hợp chất phosphorus trong các nguồn nước, do các tác động từ con người. Theo đó, các nguồn nước thải chưa xử lí triệt để, các nguồn phân bón có thành phần chính như: NH4NO3, (NH2)2CO, (NH4)2HPO4 Ca(H2PO4)2 dư thừa chảy vào vùng nước tù đọng làm tăng hàm lượng các nguyên tố dinh dưỡng trong nước. Lời giải chi tiết: Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng trong các nguồn nước Khi khơi thông nguồn nước thì nguy cơ xảy ra hiện tượng phú dưỡng giảm vì khơi thông nguồn nước giúp giảm hàm lượng các chất dinh dưỡng trong nguồn nước. CH tr 36 CH3 Dựa vào những dấu hiệu nào để dự đoán đã có hiện tượng phú dưỡng xảy ra trong một ao nước hay hồ nước? Phương pháp giải: Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng, bao gồm cả hợp chất nitrogen và hợp chất phosphorus trong các nguồn nước, do các tác động từ con người. Theo đó, các nguồn nước thải chưa xử lí triệt để, các nguồn phân bón có thành phần chính như: NH4NO3, (NH2)2CO, (NH4)2HPO4 Ca(H2PO4)2 dư thừa chảy vào vùng nước tù đọng làm tăng hàm lượng các nguyên tố dinh dưỡng trong nước. Lời giải chi tiết: Có thể quan sát được hiện tượng phú dưỡng thông qua sự xuất hiện dày đặc của tảo xanh trong nước, thủy sản chết, mùi nước ao (hồ) hôi thối… CH tr 36 VD Nhiều loài thuỷ hải sản được nuôi trong hồ, ao, “vuông” (cách gọi của người miền Tây Nam bộ về khu vực ruộng được khoanh vùng, cải tạo để nuôi thuỷ hải sản).... Để hạn chế nguy cơ xảy ra hiện tượng phú dưỡng trong hồ, ao, vuông... người nuôi thuỷ hải sản nên làm gì? Giải thích. Phương pháp giải: Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng, bao gồm cả hợp chất nitrogen và hợp chất phosphorus trong các nguồn nước, do các tác động từ con người. Theo đó, các nguồn nước thải chưa xử lí triệt để, các nguồn phân bón có thành phần chính như: NH4NO3, (NH2)2CO, (NH4)2HPO4 Ca(H2PO4)2 dư thừa chảy vào vùng nước tù đọng làm tăng hàm lượng các nguyên tố dinh dưỡng trong nước. Lời giải chi tiết: Để hạn chế nguy cơ xảy ra hiện tượng phú dưỡng trong hồ, ao, vuông... người nuôi thuỷ hải sản nên: + Tạo điều kiện để nước trong kênh rạch, ao, hồ được lưu thông. + Xử lí nước thải trước khi cho chảy vào kênh rạch, ao, hồ. + Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm để hạn chế sự rửa trôi ion từ nguồn phân bón dư thừa vào kênh rạch, ao, hồ. Tất cả các biện pháp trên nhằm hạn chế sự tích tụ các chất dinh dưỡng trong hồ, ao, vuông... CH tr 37 VD Video hướng dẫn giải Hãy tìm hiểu tình trạng phú dưỡng ở địa phương em. Từ đó, đề xuất biện pháp hạn chế hiện tượng này. Phương pháp giải: Hiện tượng phú dưỡng là sự tích tụ lượng lớn các chất dinh dưỡng, bao gồm cả hợp chất nitrogen và hợp chất phosphorus trong các nguồn nước, do các tác động từ con người. Theo đó, các nguồn nước thải chưa xử lí triệt để, các nguồn phân bón có thành phần chính như: NH4NO3, (NH2)2CO, (NH4)2HPO4 Ca(H2PO4)2 dư thừa chảy vào vùng nước tù đọng làm tăng hàm lượng các nguyên tố dinh dưỡng trong nước. Lời giải chi tiết: - Tình trạng: Địa phương em trồng nhiều cây công nghiệp, cây ăn quả. Việc bón phân để bổ sung các chất dinh dưỡng cho cây trồng là điều cần thiết, tuy nhiên lượng phân bón được sử dụng còn bị dư thừa, chảy vào vùng nước tù đọng làm tăng hàm lượng các nguyên tố dinh dưỡng trong nước gân nên hiện tượng phú dưỡng tại các ao, hồ. - Biện pháp: + Sử dụng phân bón đúng liều lượng, đúng cách, đúng thời điểm trong năm để hạn chế sự rửa trôi ion từ nguồn phân bón dư thừa vào kênh rạch, ao, hồ. + Xử lí nước thải trước khi đổ vào ao, hồ….Tuyên truyền toàn dân chung sức ngăn chặn hành vi xả thải trái phép chưa qua xử lí ra môi trường. Báo cáo chính quyền xử lí khi thấy hiện tượng xả thải trái phép ra môi trường. + Trồng một số thực vật thuỷ sinh phù hợp với môi trường phú dưỡng: bèo tây, ngổ trâu, cải xoong … Trồng thực vật thủy sinh cũng sẽ làm giảm mức độ dinh dưỡng trong nước ao, hồ và do đó không khuyến khích sự nhân lên của thực vật phù du. CH tr 38 CH1 Video hướng dẫn giải Vì sao nói ammonia có vai trò rất quan trọng đối với nông nghiệp? Cho ví dụ minh hoạ. Phương pháp giải: NH3 (ammonia) là dung dịch có tính base. Ammonia được sử dụng để sản xuất phân đạm bằng cách cho ammonia phản ứng với dung dịch acid tương ứng. Lời giải chi tiết: Mỗi năm có khoảng hàng trăm triệu tấn ammonia được sản xuất trên toàn cầu. Ammonia có vai trò rất quan trọng đối với nông nghiệp vì có khoảng 80% ammonia được sản xuất trên toàn cầu sử dụng cho sản xuất phân đạm ammonium, urea (NH2)2CO),... để cung cấp nguyên tố nitrogen cho đất và cây trồng. Ví dụ: Ammonia phản ứng với dung dịch sulfuric acid để tạo ra phân bón với thành phần chính là ammonium sulfate: CH tr 38 CH2 Biến thiên enthalpy chuẩn của phản ứng tổng hợp ammonia từ nitrogen và hydrogen có giá trị âm nhưng vì sao quá trình Haber lại chọn nhiệt độ phản ứng khá cao, vào khoảng 400 °C – 600 °C? Phương pháp giải: Nguyên lí chuyển dịch cân bằng Le Chatelier: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu tác động từ bên ngoài như biến đổi nhiệt độ, nồng độ hay áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó. Lời giải chi tiết:
CH tr 38 CH3 Ở 472 °C, hằng số cân bằng của phản ứng tổng hợp ammonia từ nitrogen và hydrogen theo quá trình Haber là Kc = 0,105. Giả sử, kết quả phân tích cho thấy tại thời điểm cân bằng, nồng độ của nitrogen và hydrogen trong buồng phản ứng lần lượt là 0,0201 M và 0,0602 M. a) Hãy tính nồng độ mol của ammonia có trong buồng phản ứng tại thời điểm cân bằng. b) Làm thế nào để tách được ammonia ra khỏi hỗn hợp? Phương pháp giải:
Lời giải chi tiết: a) N2(g) + 3H2 (g) 2NH3(g) Ban đầu (M): a b 0 Phản ứng: x 3x 2x Cân bằng: 0,0201 0,0602 2x
Vậy tại thời điểm cân bằng, nồng độ ammoni, nitrogen và hydrogen trong buồng phản ứng là không đổi. Khi đó, hỗn hợp khí này được dẫn qua hệ thống làm lạnh để hóa lỏng ammonia. Ammonia lỏng sẽ được tách ra CH tr 38 CH4 Quá trình đốt cháy nhiên liệu trong ô tô sinh ra nhiều khí như SO2, CO, NO. Từ năm 1975, người ta thiết kế “bộ chuyển đổi xúc tác” trong hệ thống xả khí của ô tô (và cả trong máy phát điện) nhằm tạo điều kiện thuận lợi cho phản ứng: 2CO(g) + 2NO(g) → 2CO2(g) +N2(g) a) Cho biết ý nghĩa của phản ứng trên đối với môi trường. b) Trong phản ứng trên, chất nào là chất oxi hoá, chất nào là chất khử? Giải thích. c) Giá trị enthalpy tạo thành chuẩn của CO(g), NO(g), CO2(g) lần lượt là –110,5; 91,3; –393,5 (kJ.mol-l). Hãy tính biến thiên enthalpy chuẩn của phản ứng trên. Phản ứng trên có thuận lợi về mặt năng lượng không? Giải thích. Phương pháp giải:
Lời giải chi tiết:
CH tr 38 CH5 Viết sơ đồ phản ứng gây ra mưa chứa nitric acid và sulfuric acid. Phương pháp giải: Sự hình thành nitric acid trong nước mưa liên quan đến nitrogen monoxide và nitrogen dioxide. Sự hình thành sulfuric acid trong nước mưa liên quan đến sulfur dioxide trong khí quyển. Acid trong nước mưa (H2SO4, HNO3) sẽ làm giảm pH của đất và nước, từ đó ảnh hưởng tiêu cực đến cây trồng, thuỷ sản,... Các acid này cũng ăn mòn các kết cấu kim loại, biến đổi thành phần vật liệu của các công trình. Lời giải chi tiết:
CH tr 38 CH6 Hãy tìm hiểu, chỉ ra các hoạt động tạo thành các khí gây mưa acid tại địa phương em. Đề xuất một số biện pháp giảm thiểu sự tạo thành các khí đó. Phương pháp giải: Sự hình thành nitric acid trong nước mưa liên quan đến nitrogen monoxide và nitrogen dioxide. Sự hình thành sulfuric acid trong nước mưa liên quan đến sulfur dioxide trong khí quyển. Acid trong nước mưa (H2SO4, HNO3) sẽ làm giảm pH của đất và nước, từ đó ảnh hưởng tiêu cực đến cây trồng, thuỷ sản,... Các acid này cũng ăn mòn các kết cấu kim loại, biến đổi thành phần vật liệu của các công trình. Lời giải chi tiết: - Hoạt động tạo thành các khí gây mưa acid tại địa phương em: khí thải của phương tiện giao thông; khí thải do đốt than, đốt rác … - Một số biện pháp giảm thiểu sự tạo thành các khí gây mưa acid: + Tăng cường sử dụng xe đạp, phương tiện công cộng thay cho các phương tiện động cơ cá nhân như ô tô, xe máy … + Tăng cường sử dụng các nguồn năng lượng mới, năng lượng sạch, năng lượng tái tạo thay cho nhiên liệu hóa thạch như than. + Xử lý rác thải theo phương pháp 3R, công nghệ sinh hóa tiên tiến,… Lý thuyết >> Xem chi tiết: Lý thuyết Một số hợp chất quan trọng của nitrogen - Hóa học 11 - Cánh diều
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM; 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|