Bài 10: Công thức phân tử hợp chất hữu cơ trang 63, 64, 65, 66 Hóa học 11 Cánh diềuChất X được tạo nên từ các nguyên tố C, H, O, tỉ lệ về số lượng nguyên tử của các nguyên tố này tương ứng là 2 : 6 : 1. Nghiên cứu cũng xác định được phân tử khối của hợp chất này là 46. Dựa vào đâu để có được các dữ kiện trên và X có công thức phân tử thế nào? Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Cánh diều Toán - Văn - Anh - Lí - Hóa - Sinh
Lựa chọn câu để xem lời giải nhanh hơn
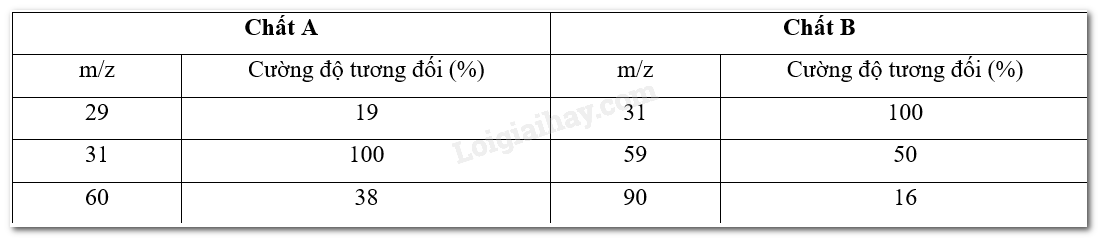
CH tr 63 MĐ Chất X được tạo nên từ các nguyên tố C, H, O, tỉ lệ về số lượng nguyên tử của các nguyên tố này tương ứng là 2 : 6 : 1. Nghiên cứu cũng xác định được phân tử khối của hợp chất này là 46. Dựa vào đâu để có được các dữ kiện trên và X có công thức phân tử thế nào? Phương pháp giải: Việc xác định thành phần các nguyên tố có trong hợp chất hữu cơ (thường là carbon, hydrogen, nitrogen, oxygen và sulfur) thường được thực hiện bằng các máy phân tích tự động và có thể cho kết quả sau 4 – 5 phút. Các máy phân tích này hoạt động trên cơ sở chuyển hoá chất hữu cơ thành những hợp chất đơn giản hơn rồi tiến hành phân tích định tính (xác định hợp chất là gì), định lượng (xác định lượng chất là bao nhiêu) những hợp chất đơn giản đó. Người ta thường xác định phân tử khối của một hợp chất dựa trên phổ khối lượng (phổ MS) của chúng. Đối với các hợp chất đơn giản, mảnh ion phân tử (kí hiệu là (M+)) thường ứng với mảnh có giá trị m/z lớn nhất. Lời giải chi tiết: - X được tạo nên từ các nguyên tố C, H, O, tỉ lệ về số lượng nguyên tử của các nguyên tố này tương ứng là 2 : 6 : 1 – dữ kiện trên có được từ phân tích nguyên tố (phân tích định tính và phân tích định lượng). Phân tử khối của hợp chất này là 46 – dữ kiện trên có được dựa vào kết quả từ mảnh ion phân tử (M+) ứng với mảnh có giá trị m/z lớn nhất của phổ khối lượng (MS). - Vì X được tạo thành từ các nguyên tố C, H, O có tỉ lệ tương ứng là 2 : 6 : 1 nên công thức đơn giản nhất của X là (C2H6O)n. Vì phân tử khối của X là 46 nên ta có: (12.2 + 1.6 + 16). n = 46 <=> 46n = 46 => n=4646=1n=4646=1 Vậy công thức phân tử của X là C2H6O. CH tr 64 LT 1 Video hướng dẫn giải Kết quả phân tích nguyên tố cho thấy thành phần phần trăm khối lượng các nguyên tố có trong hợp chất X như sau: carbon là 52,17%; hydrogen là 13,04%; còn lại là oxygen. Xác định công thức đơn giản nhất của hợp chất X. Phương pháp giải: - Công thức đơn giản nhất (còn được gọi là công thức thực nghiệm) cho biết tỉ lệ tối giản về số lượng nguyên tử của các nguyên tố trong phân tử một hợp chất hữu cơ. - Với hợp chất hữu cơ A có công thức đơn giản nhất là CxHyOz, ta có: Tỉ lệ x : y : z dưới dạng tỉ lệ các số nguyên dương tối giản x : y : z = %C12:%H1:%O16%C12:%H1:%O16 Với %C, %H, %O tương ứng là phần trăm khối lượng của các nguyên tố C, H, O có trong hợp chất hữu cơ A được xác định từ phân tích nguyên tố. Lời giải chi tiết: Gọi công thức đơn giản nhất của X là CxHyOzCxHyOz %O=100%−(52,17%+13,04%)=34,79%%O=100%−(52,17%+13,04%)=34,79% Ta có: x:y:z=%C12:%H1:%O16=52,1712:13,041:34,7916≈4,35:13,04:2,17≈2:6:1 Vậy công thức đơn giản nhất của X là C2H6O CH tr 64 CH 1 Ethyne (C2H2) và benzene (C6H6) đều có cùng công thức đơn giản nhất là CH. Cẩn thông tin gì để biết chính xác công thức phân tử của các chất sau khi biết công thức đơn giản nhất của chúng? Phương pháp giải: - Công thức đơn giản nhất (còn được gọi là công thức thực nghiệm) cho biết tỉ lệ tối giản về số lượng nguyên tử của các nguyên tố trong phân tử một hợp chất hữu cơ. - Công thức đơn giản nhất của chất là CxHyOz thì công thức phân tử có dạng (CxHyOz)n với n nguyên dương. Công thức phân tử có thể được xác định từ công thức đơn giản nhất của chất và phân tử khối của chất đó. Lời giải chi tiết: Để biết chính xác công thức phân tử của các chất sau khi biết công thức đơn giản nhất ta cần biết thêm phân tử khối của chất đó. CH tr 64 LT 2 Xác định công thức phân tử của propene, biết rằng propene có công thức đơn giản nhất là CH2 (xác định từ phân tích nguyên tố) và phân tử khối là 42. Phương pháp giải: - Công thức đơn giản nhất (còn được gọi là công thức thực nghiệm) cho biết tỉ lệ tối giản về số lượng nguyên tử của các nguyên tố trong phân tử một hợp chất hữu cơ. - Công thức đơn giản nhất của chất là CxHyOz thì công thức phân tử có dạng (CxHyOz)n với n nguyên dương. Công thức phân tử có thể được xác định từ công thức đơn giản nhất của chất và phân tử khối của chất đó. Lời giải chi tiết: Vì công thức đơn giản nhất của propene là CH2 nên công thức phân tử của propene có dạng (CH2)n. Vì phân tử khối của propene là 42 nên ta có: (12+ 1.2). n = 42 <=> 14n = 42 =>n=4212=3n Vậy công thức phân tử của propene là (CH2)3 hay C3H6. CH tr 65 CH 2 Video hướng dẫn giải Trên phổ MS có nhiều tín hiệu (peak), thường tín hiệu nào cho biết phân tử khối của chất? Phương pháp giải: Người ta thường xác định phân tử khối của một hợp chất dựa trên phổ khối lượng (phổ MS) của chúng. Đối với các hợp chất đơn giản, mảnh ion phân tử (kí hiệu là (M+)) thường ứng với mảnh có giá trị m/z lớn nhất. Lời giải chi tiết: Phân tử khối của hợp chất là peak từ mảnh ion phân tử (M+) ứng với mảnh có giá trị m/z lớn nhất của phổ khối lượng (MS). Bài tập Bài 1 Video hướng dẫn giải Hãy xác định công thức đơn giản nhất của các hợp chất có công thức dưới đây: a) C4H10 (butane). b) HOCH2CH2OH (ethane-1,2-diol). c) C6H6 (benzene). d) CHCl2COOH (dichloroethanoic acid). Phương pháp giải: Công thức đơn giản nhất (còn được gọi là công thức thực nghiệm) cho biết tỉ lệ tối giản về số lượng nguyên tử của các nguyên tố trong phân tử một hợp chất hữu cơ. Lời giải chi tiết: a) Công thức đơn giản nhất của butane có dạng CxHy => x : y = 4 : 10 = 2 : 5 Vậy công thức đơn giản nhất của butane là C2H5. b) Công thức phân tử của ethane-1,2-diol là C2H6O2. Công thức đơn giản nhất của ethane-1,2-diol có dạng CxHyOz => x : y : z = 2 : 6 : 2 = 1 : 3 : 1 Vậy công thức đơn giản nhất của ethane-1,2-diol là CH3O. c) Công thức đơn giản nhất của benzene có dạng CxHy => x : y = 6 : 6 = 1 : 1 Vậy công thức đơn giản nhất của butane là CH. d) Công thức phân tử của dichloroethanoic acid là C2H2O2Cl2. Công thức đơn giản nhất của dichloroethanoic acid có dạng CxHyOzClt. => x : y : z : t = 2 : 2 : 2 : 2 = 1 : 1 : 1 : 1 Vậy công thức đơn giản nhất của dichloroethanoic acid là CHOCl. Bài tập Bài 2 Công thức phân tử và công thức thực nghiệm có liên quan gì với nhau? Cần thông tin gì để xác định được công thức phân tử sau khi đã biết công thức thực nghiệm? Cho ví dụ minh hoạ. Phương pháp giải: - Công thức đơn giản nhất (còn được gọi là công thức thực nghiệm) cho biết tỉ lệ tối giản về số lượng nguyên tử của các nguyên tố trong phân tử một hợp chất hữu cơ. - Công thức đơn giản nhất của chất là CxHyOz thì công thức phân tử có dạng (CxHyOz)n với n nguyên dương. Công thức phân tử có thể được xác định từ công thức đơn giản nhất của chất và phân tử khối của chất đó. Lời giải chi tiết: - Để xác định được công thức phân tử sau khi đã biết công thức thực nghiệm, ta cần biết thêm về phân tử khối. - Ví dụ: Cho công thức thực nghiệm của benzene là CH và phân tử khối của benzene là 78 amu. Ta có thể xác định công thức phân tử của benzene: Công thức đơn giản nhất của benzene là CH nên công thức phân tử của benzene có dạng (CH)n. Vì phân tử khối của benzene là 78 nên ta có: (12 + 1). n = 78 <=> 13n = 78 =>n=7813=6 Vậy công thức phân tử của propene là (CH)6 hay C6H6. Bài tập Bài 3 Hai hợp chất A và B cùng có công thức thực nghiệm là CH2O. Phổ MS cho thấy A và B có các tín hiệu sau:
Xác định công thức phân tử của A và B. Biết mảnh (M+) có giá trị m/z lớn nhất. Phương pháp giải: - Phân tử khối của hợp chất là peak từ mảnh ion phân tử (M+) ứng với mảnh có giá trị m/z lớn nhất của phổ khối lượng (MS). - Công thức đơn giản nhất của chất là CxHyOz thì công thức phân tử có dạng (CxHyOz)n với n nguyên dương. Công thức phân tử có thể được xác định từ công thức đơn giản nhất của chất và phân tử khối của chất đó. Lời giải chi tiết: - Hợp chất A có công thức thực nghiệm là CH2O, công thức phân tử của A là (CH2O)n. Dựa vào kết quả từ phổ khối lượng (MS), ta có phân tử khối của A là 60. => (12 + 1.2 + 16). n = 60 <=> 30n = 60 =>n=6030=2 Vậy công thức phân tử của A là (CH2O)2 hay C2H4O2. - Hợp chất B có công thức thực nghiệm là CH2O, công thức phân tử của B là (CH2O)n. Dựa vào kết quả từ phổ khối lượng (MS), ta có phân tử khối của B là 90. => (12 + 1.2 + 16). n = 90 <=> 30n = 90 =>n=9030=3 Vậy công thức phân tử của B là (CH2O)3 hay C3H6O3. Bài tập Bài 4 Kết quả phân tích nguyên tố cho thấy trong hợp chất Y, carbon chiếm 85,7% còn hydrogen chiếm 14,3% về khối lượng. a) Y là hydrocarbon hay dẫn xuất của hydrocarbon? b) Xác định công thức đơn giản nhất của Y. c) Biết Y có phân tử khối là 56, xác định công thức phân tử của Y. Phương pháp giải: a) Hydrocarbon là những hợp chất hữu cơ trong phân tử chỉ chứa carbon và hydrogen. Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng nguyên tử hay nhóm nguyên tử khác thì thu được dẫn xuất hydrocarbon. b) Với hợp chất hữu cơ A có công thức đơn giản nhất là CxHyOz, ta có: Tỉ lệ x : y : z dưới dạng tỉ lệ các số nguyên dương tối giản x : y : z = %C12:%H1:%O16 Với %C, %H, %O tương ứng là phần trăm khối lượng của các nguyên tố C, H, O có trong hợp chất hữu cơ A được xác định từ phân tích nguyên tố. c) Công thức đơn giản nhất của chất là CxHyOz thì công thức phân tử có dạng (CxHyOz)n với n nguyên dương. Công thức phân tử có thể được xác định từ công thức đơn giản nhất của chất và phân tử khối của chất đó. Lời giải chi tiết: a) Ta có: 85,7% + 14,3% = 100% => Hợp chất Y được tạo thành bởi hai nguyên tố là C và H. => Y là hydrocarbon. b) Gọi công thức đơn giản nhất của Y làCxHy Ta có: x:y=%C12:%H1=85,712:14,31≈7:14=1:2 Vậy công thức đơn giản của Y là CH2 c) Hợp chất Y có công thức thực nghiệm là CH2, công thức phân tử của Y là (CH2)n. Ta có phân tử khối của Y là 56. => (12 + 1.2). n = 56 <=> 14n = 56 =>n=5614=4 Vậy công thức phân tử của Y là (CH2)4 hay C4H8. Bài tập Bài 4 Safrol là một chất có trong tinh dầu xá xị (hay gù hương), được dùng làm hương liệu trong thực phẩm. Phổ MS của safrol cho thấy chất này có phân tử khối là 162. Kết quả phân tích nguyên tố cho thấy thành phần phần trăm về khối lượng các nguyên tố carbon, hydrogen và oxygen có trong safrol lần lượt là: 74,07%; 6,18% và 19,75%. Xác định công thức đơn giản nhất và công thức phân tử của safrol. Phương pháp giải: Với hợp chất hữu cơ A có công thức đơn giản nhất là CxHyOz, ta có: Tỉ lệ x : y : z dưới dạng tỉ lệ các số nguyên dương tối giản x : y : z = %C12:%H1:%O16 Với %C, %H, %O tương ứng là phần trăm khối lượng của các nguyên tố C, H, O có trong hợp chất hữu cơ A được xác định từ phân tích nguyên tố. Công thức đơn giản nhất của chất là CxHyOz thì công thức phân tử có dạng (CxHyOz)n với n nguyên dương. Công thức phân tử có thể được xác định từ công thức đơn giản nhất của chất và phân tử khối của chất đó. Lời giải chi tiết: Gọi công thức đơn giản nhất của safrol là CxHyOz Ta có x:y:z=%C12:%H1:%O16=74,0712:6,181:19,7516≈6,17:6,18:1,23≈5:5:1 => Công thức đơn giản của X làC5H5O ð Công thức phân tử của safrol là (C5H5O)n Vì phân tử khối của safrol là 162 amu nên: (12.5+1.5+16)n=162⇔81n=162⇒n=16281=2 Vậy công thức của phân tử của safrol là (C5H5O)2hayC10H10O2.
>> 2K8! chú ý! Mở đặt chỗ Lộ trình Sun 2026: Luyện thi chuyên sâu TN THPT, Đánh giá năng lực, Đánh giá tư duy tại Tuyensinh247.com (Xem ngay lộ trình). Ưu đãi -70% (chỉ trong tháng 3/2025) - Tặng miễn phí khoá học tổng ôn lớp 11, 2K8 xuất phát sớm, X2 cơ hội đỗ đại học. Học thử miễn phí ngay.
|