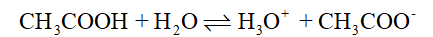Bài 2. Sự điện li trong dung dịch nước. Thuyết Brønsted - Lowry về acid - base trang 15, 16, 17, 18, 19 Hóa học 11 Cánh diềuQuan sát Hình 2.1, em hãy nêu những sự khác nhau giữa chất điện li và chất không điện li. Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Cánh diều Toán - Văn - Anh - Lí - Hóa - Sinh
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 15 Video hướng dẫn giải
Phương pháp: Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion. Lời giải chi tiết: a) Trong dung dịch chất điện li có các hạt ion âm và ion dương. b) Trong dung dịch chất không điện li có phân tử chất. CH tr 16 Video hướng dẫn giải
Phương pháp: Bản chất của dòng điện là dòng chuyển dời có hướng của các hạt mang điện như electron (ví dụ trong kim loại) hoặc ion (ví dụ trong dung dịch, trong muối nóng chảy,...). Lời giải chi tiết: Trong thí nghiệm trên, đèn sáng hay không sáng chứng tỏ tính chất dẫn điện của dung dịch chất tan. Trong dung dịch chất chất tan có ion, dung dịch đó có khả năng dẫn điện. Trong dung dịch chất chất tan không có ion, dung dịch đó không có khả năng dẫn điện.
Phương pháp: Bản chất của dòng điện là dòng chuyển dời có hướng của các hạt mang điện như electron (ví dụ trong kim loại) hoặc ion (ví dụ trong dung dịch, trong muối nóng chảy,...). Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion. Lời giải chi tiết: Trong nước nguyên chất có cân bằng hóa học: Tuy nhiên lượng ion H+ và OH- quá nhỏ, không đủ khả năng tạo nên dòng điện. Do đó trong thí nghiệm trên, cốc thuỷ tinh chứa nước nguyên chất thì đèn không sáng.
Phương pháp: Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion. Hầu hết các acid, base và muối tan được trong nước thuộc loại chất điện li. Rất nhiều chất hữu cơ tan được trong nước như đường saccharose (C12H22O11), ethanol, glycerol,... là những chất không điện li Lời giải chi tiết: Hầu hết các acid, base và muối tan được trong nước thuộc loại chất điện li. Chất điện li: HCl, BaCl2, Ca(OH)2, CH3COOH. CH tr 17 Video hướng dẫn giải
Phương pháp: Thuyết Bronsted – Lowry về acid – base: Acid là những chất có khả năng cho H+, base là những chất có khả năng nhận H+. Lời giải chi tiết: HCl + H2O → H3O+ + Cl- (3b) H2O nhận H+ từ HCl nên H2O là base.
CH tr 18 Video hướng dẫn giải
Phương pháp Acid mạnh và base mạnh phân li hoàn toàn trong nước (nên không tồn tại dạng phân tử trong nước). Acid yếu và base yếu phân li một phần trong nước. Lời giải chi tiết HBr→H++Br−HI→H++I−H2S→←\vboxto.5ex\vssH++HS−HS−→←\vboxto.5ex\vssH++S2−KOH→K++OH−NH3+H2O→←\vboxto.5ex\vssNH4++OH− Acid mạnh: HBr, HI Acid yếu: H2S Base mạnh: KOH Base yếu: NH3 Câu hỏi 2: Trong các cân bằng (7), (8a), (8b) xác định acid và các base
CH tr 19 Video hướng dẫn giải
Phương pháp: Bản chất của dòng điện là dòng chuyển dời có hướng của các hạt mang điện như electron (ví dụ trong kim loại) hoặc ion (ví dụ trong dung dịch, trong muối nóng chảy,...). Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion. Lời giải chi tiết: Nếu dòng điện chạy qua được dung dịch nước của một chất X thì chất X là một chất điện li, trong dung dịch X chứa ion âm và ion dương → Phát biểu a, b đúng. Chất X ở dạng rắn khan không dẫn được điện vì ở dạng rắn khan, X không có các hạt mang điện (ion hoặc electron) → Phát biểu c sai. Trong dung dịch chất X có các ion, không có electron tự do → Phát biểu d sai.
Phương pháp: Acid mạnh và base mạnh phân li hoàn toàn trong nước (nên không tồn tại dạng phân tử trong nước). Acid yếu và base yếu phân li một phần trong nước. Lời giải chi tiết: HCl là một acid mạnh, trong dung dịch, HCl phân li hoàn toàn: HCl + H2O → H3O+ + Cl- CH3COOH là một acid yếu, trong dung dịch, CH3COOH phân li không hoàn toàn: Do đó tuy cùng nồng độ dung dịch HCl dẫn diện tốt hơn dung dịch CH3COOH.
Phương pháp: Quá trình phân li các chất khi tan trong nước thành các ion được gọi là sự điện li. Chất điện li là chất khi tan trong nước phân li thành các ion. Chất không điện li là chất khi tan trong nước không phân li thành các ion. Lời giải chi tiết: Nước là phân tử phân cực (các nguyên tử H mang một phần diện tích dương và nguyên tử O mang một phần diện tích âm) nên khi hoà tan NaOH và HCl vào nước, xuất hiện tương tác của nước với các ion. Tương tác này sẽ bứt các ion Na+ và OH- khỏi tinh thể NaOH và bứt các ion H+, Cl- ra khỏi phân tử HCl để tan vào nước.
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM; 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|