Bài 16. Hợp kim - Sự ăn mòn kim loại trang 51, 52 SBT Hóa 12 Cánh diềuNối các hợp kim ở cột với kim loại cơ bản - kim Tổng hợp đề thi học kì 2 lớp 12 tất cả các môn - Cánh diều Toán - Văn - Anh - Hoá - Sinh - Sử - Địa
Lựa chọn câu để xem lời giải nhanh hơn
16.1 Nối các hợp kim ở cột \({\rm{A}}\) với kim loại cơ bản - kim loại là thành phần chính tương ứng ở cột \({\rm{B}}\).
Phương pháp giải: Dựa vào các thành phần hợp kim thông dụng. Lời giải chi tiết: 1-c ; 2-c ; 3-a ; 4-b ; 5-c ; 6-d 16.2 Những phát biểu nào sau đây là đúng? (a) Hợp kim được sử dụng trong đời sống và sản xuất phổ biến hơn so với kim loại. (b) Kim loại A có nhiệt độ nóng chảy cao hơn kim loại B, nhiệt độ nóng chảy của hợp kim A-B luôn cao hơn nhiệt độ nóng chảy của B. (c) Tính chất hoá học của hợp kim thường tương tự tính chất của các kim loại thành phần. (d) Hợp kim có thể cứng hơn rất nhiều các kim loại tạo nên nó. (e) Hợp kim thường khó bị oxi hoá hơn các đơn kim loại thành phần. Phương pháp giải: Dựa vào tính chất của hợp kim. Lời giải chi tiết: (a), (c), (d), (e). (b) Sai. Vì nhiệt độ nóng chảy của hợp kim A-B có thể cao hơn hoặc thấp hơn hẳn nhiệt độ nóng chảy của từng kim loại thành phần. Ví dụ thiếc chảy (Sn-Pb tỉ lệ ) nóng chảy ở , thấp hơn nhiều so với nhiệt độ nóng chảy của và lần lượng là và nên được dùng làm hợp kim hàn. 16.3 "Thép 304 " là một loại thép không gỉ được dùng phổ biến trong đời sống. Các kim loại chủ yếu tạo nên loại thép này bao gồm: A. \({\rm{Fe}},{\rm{C}},{\rm{Cr}}\). B. \({\rm{Fe}},{\rm{Cu}},{\rm{Cr}}\). C. Fe, \({\rm{Cr}},{\rm{Ni}}\). D. \({\rm{Fe}},{\rm{C}},{\rm{Cr}},{\rm{Ni}}\). Phương pháp giải: Dựa vào thành phần của hợp kim. Lời giải chi tiết: Thép 304 được tạo nên từ kim loại chủ yếu là Fe, Cr, Ni. Đáp án C 16.4 Để lợp nhà, các tấm tôn (thép mỏng mạ kẽm) được gắn với nhau bởi các đinh thép. Theo thời gian, các tấm tôn bị ăn mòn. Những nhận định nào sau đây là đúng? (1) Vị trí đóng đinh thép dễ xảy ra ăn mòn hơn các vị trí khác. (2) Tấm tôn bị ăn mòn từ trong ra ngoài do thép bị ăn mòn trước kẽm. (3) Sắt trong tấm tôn không bị ăn mòn theo thời gian. (4) Lớp tráng kẽm bị ăn mòn trước. A (1). (2). B. (1), (4). C. (2), (3). D. (1), (3), (4). Phương pháp giải: Dựa vào nguyên tắc xảy ra sự ăn mòn kim loại. Lời giải chi tiết: (1) Đúng. Vì vị trí đóng đinh thép bị ăn mòn trước là do việc đóng đinh tạo ra lỗ thủng trên tấm tôn làm cho lõi thép và lớp tráng kẽm cùng tiểp xúc với không khí ầm, nước mưa. Trong điều kiện này, vị trí đóng đinh thép sẽ xuất hiện một pin điện hoá và sự ăn mòn điện hoá diễn ra nhanh hơn so với các vị trí khác trên tấm tôn. (2) Sai, kẽm bị ăn mòn trước do kẽm có tính khử mạnh hơn. (3) Sai, vì ngoài sắt trong thép còn có carbon, khi hai thành phần này cùng tiếp xúc nước mưa (tại vị trí không có kẽm hoặc khi lớp kẽm đã bị ăn mòn), sắt đóng vai trò là anode và vẫn bị ăn mòn. (4) Đúng, vì kẽm sẽ bị ăn mòn trước. 16.5 Trang sức bằng bạc có thể bị ăn mòn bởi oxygen không khí khi có mặt hydrogen sulfide, tạo thành silver sulfide có màu đen. Viết phương trình hoá học của phản ứng xảy ra. Trong trường hợp này, bạc bị ăn mòn theo dạng ăn mòn hoá học hay ăn mòn điện hoá? Cho biết vai trò của oxygen trong quá trình này. Phương pháp giải: Dựa vào nguyên tắc xảy ra sự ăn mòn kim loại. Lời giải chi tiết: Phương trình hoá học: \({\rm{4Ag + }}{{\rm{O}}_{\rm{2}}}{\rm{ + 2}}{{\rm{H}}_{\rm{2}}}S \to {\rm{2A}}{{\rm{g}}_{\rm{2}}}{\rm{S + 2}}{{\rm{H}}_{\rm{2}}}{\rm{O}}\) Trong trường hợp này, bạc bị ăn mòn hoá học do bạc phản ứng trực tiếp với oxygen và hydrogen sulfide, trong đó oxygen đóng vai trò là chất oxi hoá. 16.6 Những phát biểu nào sau đây là đúng khi nói về sự ăn mòn của gang, thép trong không khí ẩm? (a) Dạng ăn mòn hoá học là chủ yếu, do sắt dễ dàng phản ứng với oxygen trong không khí. (b) Carbon bị khử tại cathode. (c) Oxygen đóng vai trò là chất oxi hoá. (d) Tại anode, Fe bị oxi hoá thành Fe2+. (e) Carbon đóng vai trò là cực âm (anode), sắt là cực dương (cathode) khi sự ăn mòn xảy ra. Phương pháp giải: Dựa vào nguyên tắc xảy ra sự ăn mòn kim loại. Lời giải chi tiết: (a) Sai, sắt bị ăn mòn điện hoá (b) C không bị khử, O2 bị khử: O2 + 4e + 2H2O \( \to \)4OH- (c) Đúng, O2 + 4e + 2H2O \( \to \) 4OH- (d) Đúng 16.7 Dural là một loại hợp kim quan trọng của nhôm, có đặc điểm là nhẹ, cứng, bền cơ học phù hợp với các ứng dụng nào sau đây? (1) Chế tạo cánh máy bay.(2) Áo giáp, khiên bảo vệ. (3) Làm ống dẫn dầu, mỏ neo. A. (1), (2). B. (1). C. (1), (2), (3). D. (1), (3). Phương pháp giải: Dựa vào ứng dụng của hợp kim. Lời giải chi tiết: Dural được ứng dụng để chế tạo cánh máy bay, áo giáp, khiên bảo vệ. Đáp án A 16.8 Để chống ăn mòn cho vỏ tàu biển làm bằng thép, bên cạnh việc phủ mặt ngoài của vỏ tàu bằng sơn, nhà sản xuất còn gắn nhiều khối kẽm lên mặt ngoài vỏ tàu (phần chìm trong nước). Phương pháp này còn được gọi là "anode hi sinh". Tìm hiểu và giải thích vì sao phương pháp này lại có tên gọi như vậy. Bên cạnh vỏ tàu biển, phương pháp này còn có thể áp dụng cho những trường hợp nào khác? Tìm hiểu và nêu một vài ví dụ. Phương pháp giải: Dựa vào cách bảo vệ kim loại. Lời giải chi tiết: Vỏ tàu làm bằng thép có thành phần , khi nhúng trong nước biển (môi trường điện li), Fe đóng vai trò là anode và bị ăn mòn. Tuy nhiên, khi gắn các khối kẽm lên vỏ tàu, do Zn có thế điện cực chuẩn âm hơn của Fe nên lúc này, Zn đóng vai trò là anode và bị ăn mòn trước . Vì vậy, tấm được gọi là anode hi sinh. Sau một thời gian, người ta cần thay thế hoặc bổ sung các khối kẽm đã bị ăn mòn bằng các khối kẽm mới. Mặc dù vậy, việc này dễ dàng và ít chi phí hơn nhiều so với việc phải sửa chũa, gia cố vỏ tàu. Bên cạnh bảo vệ vỏ tàu biển, phương pháp này còn được dùng rộng rãi trong việc bảo vệ các thiết bị, công trình làm bẵng thép khó tiếp cận khác như ống dẫn dầu (chìm trong đất, dưới biển), giàn khoan, trụ điện cao thế,… 16.9 Những trường hợp nào sau đây có xảy ra ăn mòn điện hoá? Giải thích. a) Cho một mẩu sodium vào dung dịch copper(II) sulfate. b) Nhúng một thanh kẽm vào dung dịch silver nitrate. c) Nhúng một thanh sắt vào dung dịch iron(III) chloride. d) Cho nước vào hỗn hợp bột magnesium, sắt và muối ăn. e) Trộn bột \({\rm{Zn}}\) vào bột CuSO4. Phương pháp giải: Dựa vào sự ăn mòn kim loại. Lời giải chi tiết: a) Không có ăn mòn điện hoá. b) \({\rm{Zn(s) + 2A}}{{\rm{g}}^{\rm{ + }}}{\rm{(aq)}} \to {\rm{Z}}{{\rm{n}}^{{\rm{2 + }}}}{\rm{(aq) + 2Ag(s)}}\) Anode: Zn \( \to \)Zn2+ + 2e Cathode: Ag+ +1e \( \to \) Ag c) \({\rm{Fe(s) + 2F}}{{\rm{e}}^{{\rm{3 + }}}}{\rm{(aq)}} \to {\rm{3F}}{{\rm{e}}^{{\rm{2 + }}}}{\rm{(aq)}}\), không có cặp hai kim loại hay kim loại phi kim nên không xảy ra ăn mòn điện hoá. d) Mg đóng vai trò là anode, Fe đóng vai trò là cathode, nước hoà tan NaCl tạo thành dung dịch chất điện li, nên xảy ra ăn mòn điện hoá. e) Ở dạng rắn, hai chất không phản ứng với nhau, không đủ điều kiện xảy ra ăn mòn điện hoá. 16.10
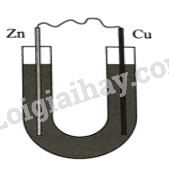
b) Sau bước 3, những phát biểu nào sau đây đúng? (1) Hai kim loại kẽm và đồng đều bị ăn mòn. (2) Kẽm bị oxi hoá và đóng vai trò là anode. (3) Cu2+ bị khử thành Cu bám vào thanh đồng, làm khối lượng thanh đồng tăng dần. (4) Không kim loại nào bị ăn mòn, nếu thay dung dịch NaCl thành dung dịch HCl thì ăn mòn mới diễn ra. (5) Kẽm bị ăn mòn, đồng không bị ăn mòn. c) Khoảng vài phút sau bước 3, nhỏ vài giọt phenolphthalein vào dung dịch gần thanh đồng và quan sát thấy dung dịch dần chuyển sang màu hồng là do A. dòng điện từ ăn mòn điện hoá đã điện phân NaCl thành dung dịch NaOH. B. sự khử oxygen hoà tan trong dung dịch tạo môi trường base. C. sự thuỷ phân muối NaCl làm tăng của dung dịch. D. do phản ứng giữa Cu và dung dịch NaCl tạo hợp chất có tính base. Phương pháp giải: Dựa vào sự ăn mòn kim loại. Lời giải chi tiết: a) D đúng vì Sau bước 2, hai kim loại không tiếp xúc, không được nối bằng dây dẫn nên không đủ điều kiện xảy ra ăn mòn điện hoá, hơn nữa cả hai kim loại đều không phản ứng trực tiếp với dung dịch NaCl (không có ăn mòn hoá học) nên cả hai kim loại đều không bị ăn mòn. b) Phát biểu đúng: (2),(5). - Sau bước 3, ăn mòn điện hoá diễn ra: Thanh kẽm (Anode): Zn \( \to \)Zn2+ + 2e Thanh đồng (cathode): O2 + 4e + 2H2O \( \to \)4OH- hoặc 2H2O + 2e \( \to \)2OH- + H2 - Kết quả Zn bị ăn mòn (Zn bị oxi hóa) - Dung dịch gần thanh Cu có môi trường base làm phenolphthalein chuyển sang màu hồng. c) B đúng vì O2 + 4e + 2H2O \( \to \)4OH- tạo môi trường base.
|