Bài 5. Một số hợp chất quan trọng của nitrogen trang 17, 18, 19, 20 SBT Hóa 11 Cánh diềuNối tính chất của ammonia của cột A với các biểu hiện tính chất ở cột B cho phù hợp Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Cánh diều Toán - Văn - Anh - Lí - Hóa - Sinh
Lựa chọn câu để xem lời giải nhanh hơn
5.1 5.1 Nối tính chất của ammonia của cột A với các biểu hiện tính chất ở cột B cho phù hợp
Phương pháp giải: Dựa vào tính chất của ammonia Lời giải chi tiết: a – 3; b – 1,2,4; c – 5,6 5.2 Phát biểu nào sau đây là không đúng khi nói về ammnonia? A. Trong công nghiệp, ammonia thường được sử dụng với vai trò chất làm lạnh (chất sinh hàn) B. Do có hàm lượng nitrogen cao (82,35% theo khối lượng) nên ammonia được sử dụng làm phân đạm rất hiệu quả C. Phần lớn ammonia được dùng phản ứng với acid để sản xuất các loại phân đạm. D. Quá trình tổng hợp ammonia từ nitrogen và hydrogen là quá trình thuận nghịch nên không thể đạt hiệu suất 100% Phương pháp giải: Dựa vào ứng dụng của ammonia Lời giải chi tiết: Đáp án B. Vì phần lớn ammnoia để sản xuất acid 5.3 Phương trình hóa học của phản ứng tổng hợp ammonia từ nitrogen và hydrogen bằng quá trình Haber như sau:
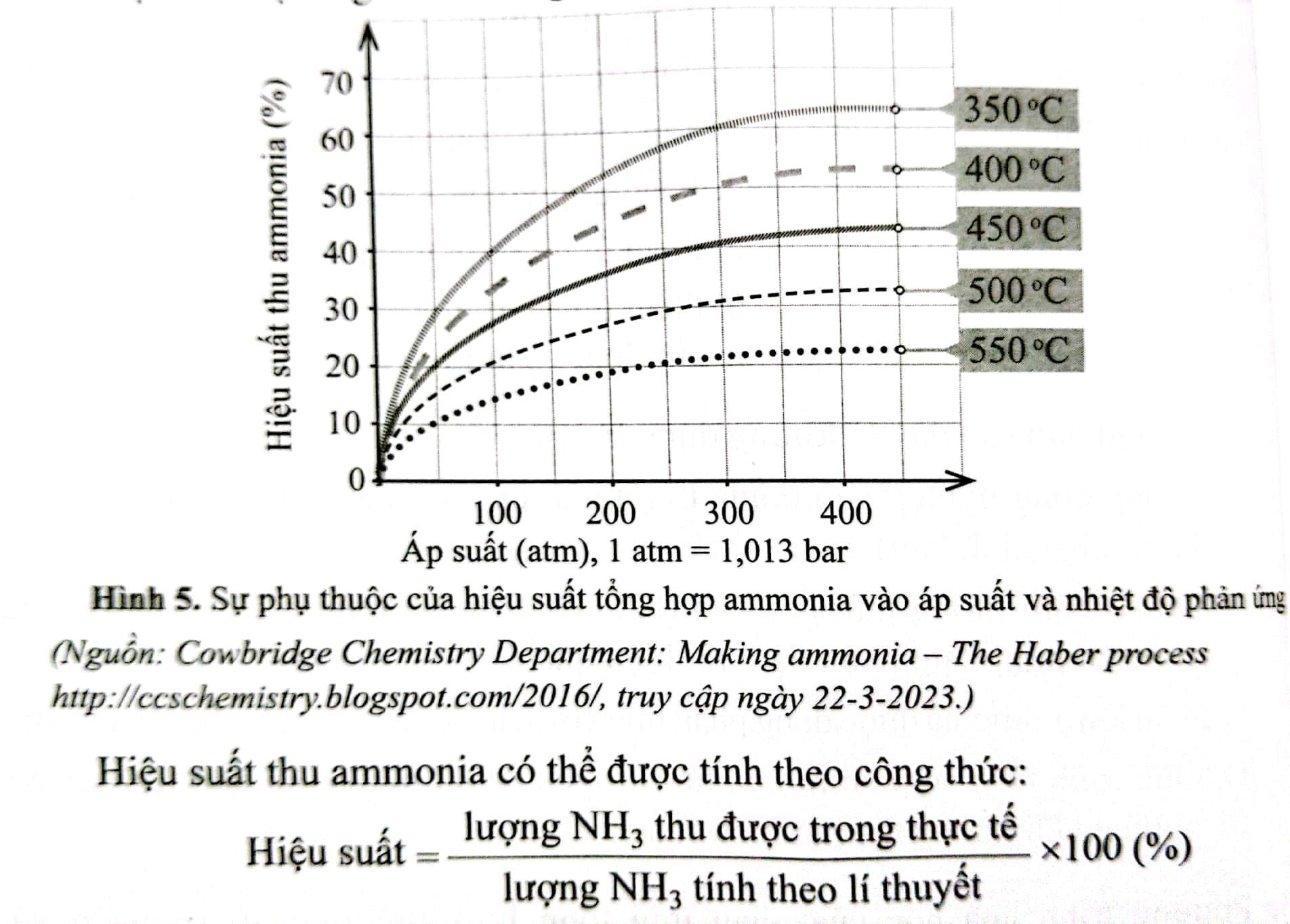
Những phát biểu liên quan tới quá trình Haber nào sau đây là đúng? (a) Là quá trình thuận nghịch nên tại thời điểm cân bằng, hỗn hợp trong buồng phản ứng gồm ammonia, nitrogen và hydrogen (b) Do ammonia dễ hóa lỏng hơn nên khi làm lạnh hỗn hợp sẽ tách được ammonia lỏng ra khỏi hỗn hợp khí (c) Nếu không sử dụng chất xúc tác thì không thể tạo thành ammonia (d) Nếu giảm áp suất của hệ thì phản ứng sẽ chuyển dịch theo chiều thuận (e) Phản ứng thuận là phản ứng tỏa nhiệt. Vì vậy, để phản ứng chuyển dịch theo chiều thuận, cần phải giảm nhiệt độ. Tuy nhiên, nếu giảm nhiệt độ xuống thấp thì tốc độ phản ứng nhỏ (g) Từ giá trị biến thiên enthalpy của phản ứng trên và năng lượng liên kết H-H, N-H lần lượt là 436 kJ/ mol và 389 kJ/mol sẽ được xác định năng lượng liên kết trong phân tử N2 ở cùng điều kiện là 934 kJ/mol Phương pháp giải: Dựa vào quá trình Haber và năng lượng của phản ứng Lời giải chi tiết: (a), (b), (e), (g) 5.4 4 Kết quả nghiên cứu sự phụ thuộc vào hiệu suất tổng hợp ammonia (theo phương trình hóa học (1), Câu 5.3) vào áp suất và nhiệt độ của phản ứng được thể hiện ở giản đồ trong hình 5 dưới đây:
Khi phản ứng ưu tiên diễn ra theo chiều thuận thì lượng ammonia thu được trong thực tế càng nhiều a) Trong khoảng từ 3500C đến 5500C, hiệu suất thu ammonia biến đổi theo xu hướng nào? b) Vì sao nhiệt độ phản ứng càng cao thì hiệu suất thu ammonia càng thấp? c) Ở một nhiệt độ, vì sao áp suất tăng cao thì hiệu suất thu ammonia tăng? d) Từ giản đồ Hình 5, hãy cho biết nên chọn nhiệt độ phản ứng là bao nhiêu để hiệu suất phản ứng đạt khoảng 44% ở 200 atm. Phương pháp giải: Dựa vào giản đồ hình 5 Lời giải chi tiết: a) giảm b) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, khi nhiệt độ tăng thì cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, tức phản ứng nghịch. Điều đó làm giảm hiệu suất ammonia c) Theo nguyên lí chuyển dịch cân bằng Le Chatelier, khi áp suất tăng thì cân bằng chuyển dịch theo chiều làm giảm áp suất, tức chiều giảm số mol khí, chiều thuận. Điều đó làm tăng hiệu suất thu ammonia 5.5 Viết các phương trình hóa học của phản ứng sản xuất NH4Cl, NH4NO3, (NH4)2SO4 và (NH2)2CO từ ammonia để làm phân bón vô cơ. Cho biết đó có phải là các phản ứng oxi hóa – khử không. Những phản ứng trên có tạo thành chất gây ô nhiễm môi trường không? Phương pháp giải: Dựa vào quy trình sản xuất các loại phân bón vô cơ từ ammoina Lời giải chi tiết: NH3+HCl→NH4ClNH3+HNO3→NH4NO3NH3+H2SO4→(NH4)2SO4NH3+CO2→←\vboxto.5ex\vss(NH2)2CO+H2O Quá trình sản xuất NH4Cl, NH4NO3, (NH4)2SO4, (NH2)2CO là phản ứng trực tiếp không phải là phản ứng oxi hóa – khử Các phản ứng trên không tạo khí độc. Tuy nhiên khi sử dụng dư thừa, phân bón chứa các chất này sẽ gây hiện tượng phú dưỡng cho đất và nước 5.6 Giá trị biến thiên enthalpy chuẩn quá trình hòa tan trong nước của urea và ammonium sulfate lần lượt là: 15,4 kJ/mol và 6,60 kJ/mol a) Có hai ống nghiệm cùng dung tích. Mỗi ống nghiệm được đặt vừa khí vào lỗ trống đã được khoát sẵn trên miếng xốp cách nhiệt dày. Cho vào mỗi ống nghiệm 10ml nước ở cùng nhiệt độ. Cắm nhiệt kế thủy ngân cùng loại vào mỗi ống nghiệm. Chờ dung dịch ổn định đến nhiệt độ phòng, sau đó cho 2 gam phân bón urea vào ống nghiệm thứ nhất, 2 gam phân bón ammonium sulfate vào ống nghiệm thứ hai. Nhanh chóng dùng đũa thủy tinh khuấy nhẹ để phân bón tan hết. Mức thủy ngân trong nhiệt kế ở ống nghiệm nào thấp hơn? Giải thích. b) Có thể phân biệt nhanh phân bón urea và phân bón ammonium sulfate bằng một lượng nước phù hợp được không? Giải thích. Phương pháp giải: Dựa vào giá trị biến thiên enthalpy chuẩn của quá trình hòa tan trong nước của urea và ammonium sulfate Lời giải chi tiết: a) mức thủy ngân trong ống nghiệm chứa urea sẽ thấp hơn do quá trình hòa tan urea thu nhiều nhiệt hơn b) có thể phân biệt được dựa vào nhiệt hòa tan 5.7 Trong các công thức dưới đây, có bao nhiêu công thức không thỏa mãn quy tắc octet?
A. 1. B. 2. C. 3. D. 4. Phương pháp giải: Dựa vào quy tắc octet Lời giải chi tiết: Đáp án B. Công thức (2) và (5) không thỏa mãn quy tắc octet 5.8 8 a) Viết cấu hình electron của nguyên tử nitrogen (7N) theo ô orbital. Nguyên tử N có bao nhiêu electron hóa trị ghép đôi, bao nhiêu electron độc thân? b) Có hai đề xuất về công thức Lewis của phân tử HNO3 như bên: b1) Công thức (A) hay (B) phù hợp với đặc điểm của electron hóa trị của nguyên tử nitrogen? Theo công thức đó, hóa trị và số oxi hóa của N là bao nhiêu? b2) Kết quá nghiên cứu cho biết giá trị độ dài của liên kết giữa nguyên tử N và O (liên kết NO) trong phân tử HNO3 là Phương pháp giải: Dựa vào cấu hình electron của nitrongen Lời giải chi tiết: a) 7N:
Nguyên tử N có 1 cặp electron hóa trị ghép đôi, 3 electron hóa trị độc thân b) b1) Công thức (A) phù hợp hơn vì nguyên tử N chỉ có 4 orbital hóa trị, do đó chỉ có thể tạo tối đa 4 liên kết cộng hóa trị. Theo công thức (A), N có hóa trị IV và số oxi hóa là +5. b2) Công thức (A) phù hợp với dữ liệu do có ba loại liên kết giữa N và O không tương đương nhau trong phân tử HNO3 (1 liên kết đôi, 1 liên kết đơn theo kiểu ghép đôi electron hóa trị và 1 liên kết đơn theo kiểu cho – nhận) 5.9 Cho hai quá trình sau: NH4NO3(s)→N2O(g)+2H2O(g) ΔrH0298=−36kJ NH4Cl(s)→NH3(g)+HCl(g) ΔrH0298=176kJ Ammonium nitrate và ammonium chloride được sử dụng làm phân bón. Trong quá trình lưu giữ, dưới ảnh hưởng của nhiệt, phân bón nào có nguy cơ cháy, nổ cao hơn? Giải thích. Phương pháp giải: Dựa vào phương trình nhiệt phân hai muối ammonium Lời giải chi tiết: Phân ammonium nitrate có nguy cơ cháy nổ cao hơn, do phản ứng thủy phân phát nhiều nhiệt 5.10 Trong quá trình sản xuất tơ, mỗi năm có hàng triệu tấn cyclohexanone (C6H10O) được cho phản ứng với HNO3 để tạo adipic acid (C6H10O4) theo phản ứng: C6H10O+HNO3→C6H10O4+N2O+H2O a) Cân bằng phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron b) Cho biết vai trò của HNO3 trong phản ứng trên. Giải thích Phương pháp giải: Xác định sự thay đổi số oxi hóa của các chất Lời giải chi tiết: a) C−4→C+2+6e2N+5+8e→2N+1 4C6H10O+6HNO3→4C6H10O4+3N2O+3H2O b) Do số oxi hóa của N đã giảm từ +5 xuống +1 nên HNO3 đóng vai trò là chất oxi hóa 5.11 Vàng tan trong hỗn hợp gồm dung dịch nitric acid đặc và dung dịch hydrochloric acid đặc (tỉ lệ 1:3 về thể tích) tạo ra hợp chất tan của Au3+ theo phản ứng sau: Au+HNO3+HCl→HAuCl4+H2O+NO a) Cân bằng phương trình hóa học của phản ứng trên theo phương pháp thăng bằng electron. b) Cho biết acid nào đóng vai trò chất oxi hóa trong phản ứng trên. Giải thích Phương pháp giải: Xác định sự thay đổi số oxi hóa của các chất Lời giải chi tiết: a) Au0→Au+3+3eN+5+3e→N+2Au+HNO3+4HCl→HAuCl4+2H2O+NO b) Do số oxi hóa của N đã giảm từ +5 xuống +2 nên HNO3 đóng vai trò là chất oxi hóa.
>> 2K9 Học trực tuyến - Định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 11 (Xem ngay) cùng thầy cô giáo giỏi trên Tuyensinh247.com. Bứt phá điểm 9,10 chỉ sau 3 tháng, tiếp cận sớm các kì thi.
|













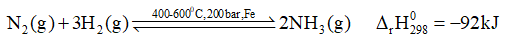
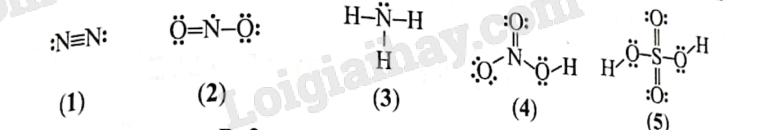
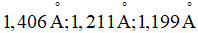 Công thức (A) hay (B) có thể thỏa mãn các số liệu đã cho? Giải thích.
Công thức (A) hay (B) có thể thỏa mãn các số liệu đã cho? Giải thích.