Bài 4. Mô hình nguyên tử và orbital nguyên tử trang 10, 11, 12 SBT Hóa 10 Cánh diềuDựa vào mô hình nguyên tử Rutherford – Bohr, hãy cho biết phát biểu nào sau đây là đúng. Theo mô hình Rutherford - Bohr, khi một nguyên tử H hấp thụ một năng lượng đủ lớn, electron sẽ GÓP Ý HAY - NHẬN NGAY QUÀ CHẤT Gửi góp ý cho HocTot.Nam.Name.Vn và nhận về những phần quà hấp dẫn
Lựa chọn câu để xem lời giải nhanh hơn
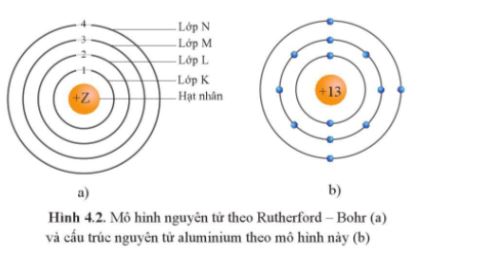
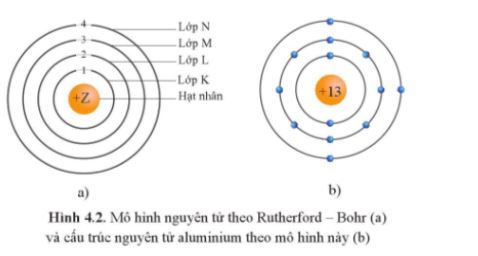
CH tr 10 4.1 Dựa vào mô hình nguyên tử Rutherford – Bohr, hãy cho biết phát biểu nào sau đây là đúng. A. Số lượng electron tối đa trên các lớp là như nhau. B. Năng lượng của các electron trên các lớp khác nhau có thể bằng nhau. C. Khi quay quanh hạt nhân theo một quỹ đạo xác định, năng lượng của electron là không đổi. D. Electron ở gần hạt nhân nhất có năng lượng cao nhất. Phương pháp giải: Nội dung mô hình nguyên tử theo Rutherford – Bohr:
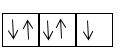
- Theo chiều từ hạt nhân ra ngoài lớp vỏ, các electron được sắp xếp vào các lớp electron: Lời giải chi tiết: A sai vì số electron tối đa trên các lớp là khác nhau, ví dụ lớp thứ nhất có tối đa 2 electron; lớp thứ hai có tối đa 8 electron. B sai vì năng lượng của các electron trên các lớp khác nhau là khác nhau. D sai vì electron ở gần hạt nhân nhất có năng lượng thấp nhất. -> Đáp án đúng: C CH tr 10 4.2 Đề bài: Theo mô hình Rutherford - Bohr, khi một nguyên tử H hấp thụ một năng lượng đủ lớn, electron sẽ A. chuyển từ lớp electron gần hạt nhân sang lớp xa hạt nhân hơn. B. chuyển từ lớp electron xa hạt nhân về lớp gần hạt nhân hơn. C. không thay đổi trạng thái. D. có thể chuyển sang lớp khác bất kì. Phương pháp giải: Đáp án A CH tr 10 4.3 Phát biểu nào sau đây không đúng khi nói về mô hình Rutherford – Bohr? A. Electron trên lớp K có năng lượng cao hơn trên lớp L. B. Electron trên lớp M có năng lượng cao hơn trên lớp K. C. Electron ở lớp K gần hạt nhân hơn so với electron ở lớp L. D. Electron ở lớp M xa hạt nhân hơn so với electron ở lớp L. Phương pháp giải: Dựa vào mô hình Rutherford – Bohr? Lời giải chi tiết: Đáp án: A Phát biểu A sai vì: Electron trên lớp K có năng lượng thấp hơn trên lớp L. CH tr 10 4.4 Nguyên tử F có 9 electron. Theo mô hình Rutherford – Bohr, tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là A. 2 : 12. B. 7 : 2. C. 5 : 2. D. 2 : 7. Phương pháp giải: Công thức xác định số lượng e tối đa trên một lớp: 2n2 (với ) Trong đó n là số lớp e Lời giải chi tiết: Số lượng electron tối đa trên một lớp là 2.n2 (với n ≤ 4). Lớp thứ nhất của F chứa tối đa 2 electron. Lớp thứ hai của F chứa 7 electron (lớp thứ hai tối đa chứa 2.22 = 8 electron). Vậy tỉ lệ số lượng electron trên lớp thứ hai so với số lượng electron trên lớp thứ nhất là 7 : 2. CH tr 11 4.5 Điền từ/ cụm từ thích hợp vào chỗ trống trong mô tả sau đây về mô hình hành tinh nguyên tử theo Rutherford – Bohr. Khối lượng nguyên tử tập trung ở ...(1)... Electron quay xung quanh hạt nhân theo những ...(2)... xác định. Electron ở càng xa hạt nhân thì có năng lượng càng ...(3)... Khi nguyên tử hấp thụ năng lượng phù hợp, electron sẽ chuyển ...(4)... hạt nhân hơn. Lời giải chi tiết: (1) hạt nhân. (2) quỹ đạo xác định. (3) cao. (4) ra xa hạt nhân hơn. CH tr 11 4.6 Nguyên tử O có 8 electron. Theo mô hình Rutherford – Bohr, nguyên tử O có số electron có cùng năng lượng ở lớp thứ nhất là A. 2. B. 4. C. 6. D. 8. Phương pháp giải: Áp dụng CT: Số lượng electron tối đa trên một lớp là 2.n2 (với n ≤ 4). Lời giải chi tiết: Số e tối đa ở lớp thứ nhất là: 2.1 = 2 (electron) → Đáp án: A CH tr 11 4.7 Theo mô hình nguyên tử hiện đại, xác suất tìm thấy electron lớn nhất là ở A. bên ngoài các orbital nguyên tử. B. trong các orbital nguyên tử. C. bên trong hạt nhân nguyên tử. D. bất kì vị trí nào trong không gian. Lời giải chi tiết: Đáp án: B CH tr 11 4.8 Vùng nào sau đây ứng với xác suất tìm thấy electron trong nguyên tử bằng 100%? A. Bên ngoài các orbital nguyên tử. B. Trong các orbital nguyên tử. C. Trong toàn bộ khoảng không gian xung quanh hạt nhân. D. Ở bên trong hạt nhân. Lời giải chi tiết: Đáp án: C CH tr 11 4.9 Mỗi phát biểu sau đây về mô hình nguyên tử hiện đại là đúng hay sai? (1) Theo mô hình nguyên tử hiện đại, electron chuyển động không theo những quỹ đạo xác định trong cả khu vực không gian xung quanh hạt nhân. (2) Tất cả các AO nguyên tử đều có hình dạng giống nhau. (3) Mỗi AO nguyên tử chỉ có thể chứa được 1 electron. (4) Các electron s chuyển động trong các AO có hình số tám nổi. Phương pháp giải: Dựa vào nội dung mô hình hiện đại về nguyên tử Các electron chuyển động xung quanh hạt nhân không theo những quỹ đạo xác định, chuyển động rất nhanh trong cả khu vực không gian xung quanh hạt nhân giống như một đám mây electron Lời giải chi tiết: Phát biểu (1) đúng. Phát biểu (2) sai vì AO s có dạng hình cầu, AO p có dạng hình số tám nổi. Phát biểu (3) sai vì mỗi AO chứa tối đa 2 electron. Phát biểu (4) sai vì AO s có dạng hình cầu. CH tr 11 4.10 Hình ảnh bên mô tả AO p với hai thùy.
Những phát biểu nào sau đây là đúng? A. Xác suất tìm thấy electron ở mỗi thùy là khoảng 45%. B. Xác suất tìm thấy electron ở mỗi thùy là khoảng 90%. C. Xác suất tìm thấy electron trong AO p là khoảng 90%. D. Xác suất tìm thấy electron trong AO p là khoảng 45%. Lời giải chi tiết: Đáp án: A và C CH tr 11 4.11 Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là A. 0. B. 1. C. 2. D. 5. Phương pháp giải: Mỗi AO chứa tối đa 2 e Lời giải chi tiết: Đáp án: B Chi tiết: 4.12 Fluorine là nguyên tố hóa học có mặt trong nhiều hợp chất được ứng dụng trong nha khoa, y tế. Nguyên tố F có 9 electron. Hãy đề xuất phương án sắp xếp những electron này vào 5 orbital nguyên tử. Cho biết số cặp electron ghép đôi và số lượng electron độc thân trong trường hợp đó. Phương pháp giải: Dựa trên nguyên tắc: Mỗi AO chứa tối đa 2 e Lời giải chi tiết: Mỗi orbital nguyên tử chứa tối đa 2 electron nên 9 electron sẽ được xếp vào 5 orbital. Trong đó có 4 orbital chứa 2 electron và 1 orbital chứa 1 electron. => có 4 cặp electron ghép đôi và 1 electron độc thân. CH tr 12 4.13 Cần ít nhất bao nhiêu orbital nguyên tử để chứa được: 2, 8, 18 electron? Phương pháp giải: Dựa trên nguyên tắc: Mỗi AO chứa tối đa 2 e Lời giải chi tiết: Do mỗi orbital nguyên tử chứa tối đa hai electron nên số electron tối thiểu tương ứng để chứa được 2, 8, 18 electron lần lượt là 1, 4 và 9. CH tr 12 4.14 Theo mô hình Rutherford – Bohr, electron trong nguyên tử hydrogen chuyển động trên các quỹ đạo xác định xung quanh tâm là hạt nhân nguyên tử. Mỗi quỹ đạo được đặc trưng bởi một giá trị n (n = 1, 2, 3 …). Giá trị của n cũng chính là số thứ tự của lớp electron. Bán kính của quỹ đạo thứ n (kí hiệu là rn) của nguyên tử hydrogen có thể tính theo công thức: rn = n2 × 0,529 (oA) Hãy tính bán kính quỹ đạo thứ nhất và thứ hai (tương ứng với n = 1 và n = 2) của nguyên tử hydrogen. Phương pháp giải: Áp dụng CT: rn = n2 × 0,529 (oA) (1) Lời giải chi tiết: Thay n tương ứng vào CT (1) Bán kính quỹ đạo thứ nhất của nguyên tử hydrogen là: r1 = 12 × 0,529 = 0,529 (oA). Bán kính quỹ đạo thứ hai của nguyên tử hydrogen là: r2 = 22 × 0,529 = 2,116 (oA). CH tr 12 4.15 Bán kính của quỹ đạo thứ n (rn) của các ion chỉ chứa 1 electron như He+, Li2+, Be3+ có thể tính theo công thức: rn=n2×0.529Z2(oA), trong đó Z là điện tích hạt nhân. Hãy so sánh (có giải thích) bán kính quỹ đạo thứ nhất của các ion He+, Li2+, Be3+. Phương pháp giải: - Tính bán kính quỹ đạo các ion theo CT: rn=n2×0.529Z2(oA) ->So sánh Bán kính các ion Lời giải chi tiết: Bán kính quỹ đạo thứ nhất của ion He+ là: r1(He+)=12×0.52922=0,132(oA) Bán kính quỹ đạo thứ nhất của ion Li2+ là: r1(Li2+)=12×0.52932=0,059(oA) Bán kính quỹ đạo thứ nhất của ion Be3+ là: r1(Be3+)=12×0.52942=0,033(oA) So sánh: r1(He+)>r1(Li2+)>r1(Be3+) Giải thích: khi Z tăng, lực hút giữa hạt nhân với electron ngoài cùng tăng cũng sẽ tăng -> Bán kính các ion nguyên tố giảm CH tr 12 4.16 Năng lượng của electron trong hệ gồm 1 electron và 1 hạt nhân (như H, He+, …) theo mô hình Rutherford – Bohr cũng như mô hình hiện đại đều phụ thuộc vào số thứ tự của lớp (n) và điện tích hạt nhân (Z) như sau: En=−2,18×10−18×Z2n2 (J) trong đó Z là điện tích hạt nhân; n = 1, 2, 3, … là số thứ tự của lớp electron. Hãy tính và so sánh (có giải thích) năng lượng của electron lớp thứ nhất của H, He+, Li2+. Lời giải chi tiết: Năng lượng của electron lớp thứ nhất của H: E1(H)=−2,18×10−18×1212=−2,18.10−18(J) Năng lượng của electron lớp thứ nhất của He+: E1(He+)=−2,18×10−18×2212=−8,72.10−18(J) Năng lượng của electron lớp thứ nhất của Li2+: E1(Li2+)=−2,18×10−18×3212=−1,96.10−17(J) -> THeo chiều tăng điện tích hạt nhân, năng lượng của e lớp thứ nhất tăng dần theo thứ tự từ H, He+, Li2+ khi Z tăng, lực hút giữa hạt nhân với electron cũng sẽ tăng lên.
>> Học trực tuyến Lớp 10 cùng thầy cô giáo giỏi tại Tuyensinh247.com, (Xem ngay) Cam kết giúp học sinh học tốt, bứt phá điểm 9,10 chỉ sau 3 tháng, làm quen kiến thức, định hướng luyện thi TN THPT, ĐGNL, ĐGTD ngay từ lớp 10
|