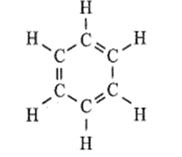
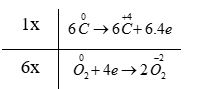Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học trang 44, 45, 46 SBT Hóa 10 Cánh diềuBiến thiên enthalpy chuẩn của quá trình “H2O(s) → H2O(l)” là 6,020 kJ. a) Quá trình tan chảy của nước đá là quá trình thu nhiệt hay toả nhiệt? Vì sao? b) Vì sao khi cho viên nước đá vào một cốc nước lỏng ấm, viên đá lại tan chảy dần? c) Vì sao cốc nước lỏng bị lạnh dần trong quá trình viên nước đá tan chảy? Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Cánh diều Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 44 15.1 Nối mỗi nội dung ở cột A với nội dung ở cột B sao cho phù hợp:
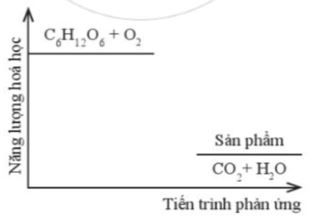
Phương pháp giải: Dựa vào - Nếu sau phản ứng: + Môi trường tăng nhiệt độ, nhiệt độ của hệ phản ứng giảm → quá trình tỏa nhiệt + Môi trường giảm nhiệt độ, nhiệt độ của hệ phản ứng tăng → quá trình thu nhiệt - \({\Delta _r}H_{298}^0\) < 0 → Phản ứng tỏa nhiệt - \({\Delta _r}H_{298}^0\) > 0 → Phản ứng thu nhiệt Lời giải chi tiết: - Đáp án: a - 4; b - 1; c - 3; d - 2 CH tr 44 15.2 Đường sucrose (C12H22O11) là một đường đôi. Trong môi trường acid ở dạ dày và nhiệt độ cơ thể, sucrose bị thủy phân thành đường glucose và fructose, sau đó bị oxi hóa bởi oxygen tạo thành CO2 và H2O. Sơ đồ thay đổi năng lượng hóa học của phản ứng được cho như hình dưới đây:
a) Dựa theo đồ thị, hãy cho biết phản ứng trong đó là tỏa nhiệt hay thu nhiệt. Vì sao? b) Viết phương trình hoá học của phản ứng thuỷ phân đường sucrose. Phản ứng trong sơ đồ có phải là phản ứng oxi hoá - khử không? Nếu có, hãy chỉ ra chất oxi hoá và chất khử trong phản ứng và cân bằng phương trình hoá học của phản ứng theo phương pháp thăng bằng electron. c) Khi 1 mol đường sucrose bị đốt cháy hoàn toàn với một lượng vừa đủ oxygen ở điều kiện chuẩn toả ra một lượng nhiệt là 5645 kJ. Xác định biến thiên enthalpy chuẩn của phản ứng oxi hoá sucrose. d) Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng bao nhiêu? e) Vì sao để duy trì một cơ thể khoẻ mạnh, cần một chế độ dinh dưỡng đầy đủ và luyện tập thể dục thể thao hợp lí? Lời giải chi tiết: a) Năng lượng của sản phẩm < năng lượng chất tham gia → Biến thiên enthalpy âm → Phản ứng tỏa nhiệt b) - Phản ứng thủy phân đường sucrose trong môi trường acid và đun nóng: C12H22O11 + H2O → C6H12O6 (glucose) + C6H12O6 (fructose) - Phản ứng trong sơ đồ là phản ứng oxi hóa - khử với O2 là chất oxi hóa, đường glucose và fructose là chất khử: + Bước 1: \(\overset{0}{\mathop{{{C}_{6}}}}\,{{H}_{12}}{{O}_{6}}+\overset{0}{\mathop{{{O}_{2}}}}\,\xrightarrow{{{t}^{o}}}\overset{+4}{\mathop{C}}\,\overset{-2}{\mathop{{{O}_{2}}}}\,+{{H}_{2}}O\) → C6H12O6 là chất khử, O2 là chất oxi hóa + Bước 2: + Quá trình oxi hóa: \(6\overset{0}{\mathop{C}}\,\to 6\overset{+4}{\mathop{C}}\,+6.4e\) + Quá trình khử: \(\overset{0}{\mathop{{{O}_{2}}}}\,+4e\to 2\overset{-2}{\mathop{{{O}_{2}}}}\,\) - Bước 3: - Bước 4: C6H12O6 + 6O2 \(\xrightarrow{{{t}^{o}}}\) 6CO2 + 6H2O c) - Phản ứng đốt cháy đường sucrose: C12H22O11 + 12O2 \(\xrightarrow{{{t}^{o}}}\) 12CO2 + 11H2O - Phản ứng tỏa nhiệt → \({{\Delta }_{r}}H_{298}^{0}=-5645kJ\) d) Nếu 5,00 gam đường sucrose được đốt cháy hoàn toàn ở cùng điều kiện như trên thì biến thiên enthalpy quá trình bằng: \(\frac{5}{{342}}.( - 5645) = - 82,5kJ\) e) - Cơ thể cần năng lượng để hoạt động nên phải có chế độ dinh dưỡng đầy đủ. - Luyện tập thể dục, thể thao hợp lý giúp tăng cường sức khỏe và đốt cháy năng lượng dư thừa trong cơ thể CH tr 45 15.3* Biến thiên enthalpy chuẩn của quá trình “H2O(s) → H2O(l)” là 6,020 kJ. a) Quá trình tan chảy của nước đá là quá trình thu nhiệt hay toả nhiệt? Vì sao? b) Vì sao khi cho viên nước đá vào một cốc nước lỏng ấm, viên đá lại tan chảy dần? c) Vì sao cốc nước lỏng bị lạnh dần trong quá trình viên nước đá tan chảy? d) Biết rằng để làm cho nhiệt độ của 1 mol nước lỏng thay đổi 1°C cần một nhiệt lượng là 75,4 J. Giả sử mỗi viên nước đá tương ứng với 1 mol nước, số viên nước đá tối thiểu cần tan chảy để có thể làm lạnh 500 gam nước lỏng ở 20°C xuống 0°C là A. 1. B. 7. C. 14. D. 15. E. 126. e) Để làm lạnh 120 gam nước lỏng ở 45°C xuống 0°C, một bạn học sinh đã dùng 150 gam nước đá. Lượng nước đá này là vừa đủ, thiếu hay dư? (Trong phần d, e, giả thiết chỉ có sự trao đổi nhiệt giữa nước và nước đá.) Lời giải chi tiết: a) Biến thiên enthalpy dương → Quá trình tan chảy của nước đá là quá trình thu nhiệt b) Nước lỏng ấm có nhiệt độ cao hơn đá viên → viên đá sẽ lấy nhiệt từ nước lỏng ấm nên sẽ bị tan chảy dần c) Do viên đá lấy nhiệt từ nước lỏng ấm trong cốc → làm mất nhiệt của nước → cốc nước lỏng bị lạnh dần d) - Nhiệt lượng cần tan chảy để có thể làm lạnh 500 gam nước lỏng ở 20°C xuống 0°C là \(\frac{{500}}{{18}}.(20 - 0).75,4 = 41888,9J = 41,889kJ\) - Phần nhiệt lượng tỏa ra này được viên nước đá hấp thụ để tan chảy. Số viên nước đá cần tối thiểu là: \(\frac{{41,889}}{{6,02}} \approx 7\)(viên) → Đáp án: B e) - Nhiệt lượng cần để làm lạnh 120 gam nước lỏng ở 45°C xuống 0°C là: \(\frac{{120}}{{18}}.(45 - 0).75,4 = 22620J = 22,62kJ\) - Khối lượng nước đá cần tối thiểu là: \(\frac{{22,62}}{{6,02}}{.18.10^{ - 3}} = 67,63g\)(gam) → Dùng 150 gam nước đá là dư CH tr 45 15.4 Phản ứng của 1 mol ethanol lỏng với oxygen xảy ra theo phương trình: C2H5OH(l) + O2(g) → CO2(g) + H2O(l) (1) a) Những nhận định nào sau đây là đúng? (1) Đây là phản ứng tỏa nhiệt vì nó tạo ra khí CO2 và nước lỏng. (2) Đây là phải là phản ứng oxi hóa – khử với tổng số hệ số cân bằng trong phương trình phản ứng là 9. (3) Biến thiên enthalpy chuẩn của phản ứng sẽ thay đổi nếu nước tạo ra ở thể khí. (4) Sản phẩm của phản ứng chiếm một thể tích lớn hơn so với chất phản ứng. A. (1), (2). B. (1), (2), (3). C. (1), (3), (4). D. (3), (4). E. (1). G. (2), (3). b) Biến thiên enthalpy chuẩn kèm theo quá trình khi 1 mol ethanol lỏng cháy hoàn toàn trong oxygen là \({\Delta _r}H_{298}^0 = - 1,{367.10^3}kJ\), xác định enthalpy hình thành chuẩn của C2H5OH (lỏng). (Những số liệu cần thiết được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều). Phương pháp giải: - Cách tính enthalpy của phản ứng hóa học dựa vào enthalpy tạo thành của các chất \({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} - \sum {{\Delta _r}H_{298}^0(cd)} \) Trong đó: \(\sum {{\Delta _r}H_{298}^0(sp)} \) và \(\sum {{\Delta _r}H_{298}^0(cd)} \) là tổng enthalpy tạo thành ở điều kiện chuẩn của sản phẩm và chất đầu của phản ứng Lời giải chi tiết: a) Phương trình: C2H5OH(l) + 3O2(g) \(\xrightarrow{{{t}^{o}}}\) 2CO2(g) + 3H2O(l) - Phát biểu (1) sai vì để xét phản ứng tỏa nhiệt hay thu nhiệt cần dựa vào năng lượng hóa học của phản ứng. - Phát biểu (2) đúng, tổng hệ số cân bằng của phản ứng là 1 + 3 + 2 + 3 = 9. - Phát biểu (3) đúng vì biến thiên enthalpy phụ thuộc vào trạng thái của các chất - Phát biểu (4) sai, sản phẩm của phản ứng chiếm một số mol lớn hơn so với chất phản ứng. → Đáp án: G b) Biến thiên enthalpy của phản ứng C2H5OH(l) + 3O2(g) \(\xrightarrow{{{t}^{o}}}\) 2CO2(g) + 3H2O(l) là: \({\Delta _r}H_{298}^0 = 2.{\Delta _f}H_{298}^0(C{O_2}) + 3.{\Delta _f}H_{298}^0({H_2}O) - {\Delta _f}H_{298}^0({C_2}{H_5}OH)\)(\({\Delta _r}H_{298}^0\) của đơn chất = 0) → \({\Delta _r}H_{298}^0 = 2.{\Delta _r}H_{298}^0( - 393,5) + 3.{\Delta _r}H_{298}^0( - 285,8) - {\Delta _r}H_{298}^0( - 1367) = - 277,4(kJ/mol)\) CH tr 46 15.5 Sulfur dioxide là một chất có nhiều ứng dụng trong công nghiệp (dùng để sản xuất sulfuric acid, tẩy trắng bột giấy trong công nghiệp giấy, tẩy trắng dung dịch đường trong sản xuất đường tinh luyện,…) và giúp ngăn cản sự phát triển của một số loại vi khuẩn và nấm gây hư hại cho thực phẩm. Ở áp suất 1 bar và nhiệt độ 25oC, phản ứng giữa 1 mol sulfur với khí oxygen xảy ra theo phương trình “S(s) + O2(g) → SO2(g)” và tỏa ra một lượng nhiệt là 296,9 kJ. Những phát biểu nào sau đây là đúng? A. Biến thiên enthalpy chuẩn của phản ứng là 296,9 kJ. B. Enthalpy tạo thành chuẩn của sulfur dioxide bằng -296,9 kJ mol-1. C. Sulfur dioxide vừa có thể là chất khử vừa có thể là chất oxi hóa, tùy thuộc vào phản ứng mà nó tham gia. D. 0,5 mol sulfur tác dụng hết với oxygen giải phóng 148,45 kJ năng lượng dưới dạng nhiệt. E. 32 gam sulfur cháy hoàn toàn tỏa ra một lượng nhiệt là 2,969 × 105 J. Lời giải chi tiết: - Đáp án: B, C, D, E - Giải thích: A sai vì đây là phản ứng tỏa nhiệt → Biến thiên enthalpy mang giá trị âm CH tr 46 15.6 Phản ứng luyện gang trong lò cao có phương trình như sau: Fe2O3(s) + CO(g) → Fe(s) + CO2(g) (1) a) Cân bằng phương trình hóa học của phản ứng (1) và tính biến thiên enthalpy chuẩn của phản ứng với các hệ số cân bằng tương ứng. b) Từ 1 mol Fe2O3 và 1 mol CO, giả sử chỉ xảy ra phản ứng (1) với hiệu suất 100% thì giải phóng một lượng nhiệt là A. 8,27 kJ. B. 49,6 kJ. C. 12,4 kJ. D. 74,4 kJ. Lời giải chi tiết: a) - Phương trình: Fe2O3(s) + 3CO(g) \(\xrightarrow{{{t}^{o}}}\) 2Fe(s) + 3CO2(g) - Biến thiên enthalpy của phản ứng trên là: \({\Delta _r}H_{298}^0 = 3.{\Delta _f}H_{298}^0(C{O_2}) - 3.{\Delta _f}H_{298}^0(CO) - {\Delta _f}H_{298}^0(F{e_2}{O_3})\)(\({\Delta _r}H_{298}^0\) của đơn chất = 0) → \({\Delta _r}H_{298}^0 = 3.{\Delta _r}H_{298}^0( - 393,5) - 3.{\Delta _r}H_{298}^0( - 110,5) - {\Delta _r}H_{298}^0( - 824,2) = - 24,8(kJ)\) b) Xét phương trình: Fe2O3(s) + 3CO(g) \(\xrightarrow{{{t}^{o}}}\) 2Fe(s) + 3CO2(g) - Có 1 mol Fe2O3 và 1 mol CO → CO hết, Fe2O3 dư → Tính theo mol CO - Lượng nhiệt giải phóng ra là \(\frac{{24,8}}{3} = 8,27(kJ)\) → Đáp án: A CH tr 46 15.7 Ở điều kiện chuẩn, 2 mol nhôm tác dụng vừa đủ với khí chlorine tạo ra muối aluminium chloride và giải phóng một lượng nhiệt 1390,81 kJ. a) Viết và cân bằng phương trình hóa học của phản ứng. Đây có phải là phản ứng oxi hóa – khử không? Vì sao? b) Biến thiên enthalpy chuẩn của phản ứng bằng bao nhiêu? Phản ứng trên thu nhiệt hay tỏa nhiệt? c) Tính lượng nhiệt được giải phóng khi 10 gam AlCl3 được tạo thành. d) Nếu muốn tạo ra được 1,0 kJ nhiệt lượng cần bao nhiêu gam Al phản ứng? Lời giải chi tiết: a) Phương trình: \(2\overset{0}{\mathop{Al}}\,\left( s \right)\text{ }+\text{ }3\overset{0}{\mathop{C{{l}_{2}}}}\,\left( g \right)\xrightarrow{{{t}^{o}}}2\overset{+3}{\mathop{Al}}\,\overset{-1}{\mathop{C{{l}_{3}}}}\,\left( s \right)\) → Đây là phản ứng oxi hóa - khử vì có sự thay đổi số oxi hóa của các nguyên tố trong phản ứng b) Vì phản ứng giải phóng ra một lượng nhiệt 1390,81 kJ → Đây là phản ứng tỏa nhiệt → \({\Delta _r}H_{298}^0 = - 1390,81{\rm{ }}kJ\) c) - Lượng nhiệt được giải phóng khi 1 mol AlCl3 được tạo thành là: \(1390,81:2 = 695,405(kJ)\) - Lượng nhiệt được giải phóng khi 10 gam AlCl3 được tạo thành là: \(\frac{{10}}{{133,5}}.695,405 = 52,09(kJ)\) CH tr 47 15.8 Trong ngành công nghệ lọc hóa dầu, các alkane thường được loại bỏ hydrogen trong các phản ứng dehydro hóa để tạo ra những sản phẩm hydrocarbon không no có nhiều ứng dụng trong công nghiệp. Hãy tính biến thiên enthalpy chuẩn của các phản ứng sau dựa vào năng lượng liên kết. (Giá trị một số năng lượng liên kết được cho trong Phụ lục 2, SGK Hóa học 10, Cánh Diều) a) H3C – CH2 – CH2 – CH3 → CH2 = CH – CH = CH2 + 2H2 b) 6CH4 → C6H6 (1,3,5 – cyclohexatriene) + 9H2 Cho biết công thức cấu tạo của 1,3,5 – cyclohexatriene như sau: Các phản ứng trên có thuận lợi về phương diện nhiệt hay không? Phản ứng theo chiều ngược lại có biến thiên enthalpy bằng bao nhiêu? Phương pháp giải: - Cách tính enthalpy của phản ứng hóa học dựa vào enthalpy tạo thành của các chất \({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} - \sum {{\Delta _r}H_{298}^0(cd)} \) Trong đó: \(\sum {{\Delta _r}H_{298}^0(sp)} \) và \(\sum {{\Delta _r}H_{298}^0(cd)} \) là tổng enthalpy tạo thành ở điều kiện chuẩn của sản phẩm và chất đầu của phản ứng Lời giải chi tiết: a) Biến thiên enthalpy của phản ứng là: \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} - \sum {{E_b}(sp)} \) \({\Delta _r}H_{298}^0 = {\rm{(10}}{\rm{.}}{E_b}(C - H) + 3{E_b}(C - C){\rm{) - (6}}{\rm{.}}{E_b}(C - C) + 2.{E_b}(C = C) + {E_b}(C - C) + 2.{E_b}(H - H){\rm{)}}\) \({\Delta _r}H_{298}^0 = 10.414 + 3.347 - {\rm{(}}6.414 + 2.611 + 347{\rm{ + }}2.436{\rm{)}} = 256\left( {kJ} \right)\) < 0 b) Biến thiên enthalpy của phản ứng là: \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} - \sum {{E_b}(sp)} \) \({\Delta _r}H_{298}^0 = {\rm{(6}}{\rm{.4}}{\rm{.}}{E_b}(C - H){\rm{) - (6}}{\rm{.}}{E_b}(C - H) + 3.{E_b}(C = C) + 3.{E_b}(C - C) + 9.{E_b}(H - H){\rm{)}}\) \({\Delta _r}H_{298}^0 = 24.414 - {\rm{(}}6.414 + 3.611 + 3.347{\rm{ + }}9.436{\rm{)}} = 654\left( {kJ} \right)\) < 0 → Cả 2 phản ứng đều là phản ứng thu nhiệt " Không thuận lợi về phương diện nhiệt → Phản ứng theo chiều ngược lại thuận lợi về phương diện nhiệt: CH2 = CH – CH = CH2 + 2H2 " H3C – CH2 – CH2 – CH3 có \({\Delta _r}H_{298}^0 = - 256\left( {kJ} \right)\) C6H6 (1,3,5 – cyclohexatriene) + 9H2 " 6CH4 có \({\Delta _r}H_{298}^0 = - 654\left( {kJ} \right)\) CH tr 47 15.9 Bằng cách tính biến thiên enthalpy chuẩn của quá trình sau dựa vào năng lượng liên kết, hãy chỉ ra ở điều kiện chuẩn, H3C – CH2 – OH hay H3C – O – CH3 bền hơn. H3C – CH2 – OH (g) → H3C – O – CH3 (g) Phương pháp giải: - Cách tính enthalpy của phản ứng hóa học dựa vào enthalpy tạo thành của các chất \({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} - \sum {{\Delta _r}H_{298}^0(cd)} \) Trong đó: \(\sum {{\Delta _r}H_{298}^0(sp)} \) và \(\sum {{\Delta _r}H_{298}^0(cd)} \) là tổng enthalpy tạo thành ở điều kiện chuẩn của sản phẩm và chất đầu của phản ứng Lời giải chi tiết: - Biến thiên enthalpy của phản ứng là: \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} - \sum {{E_b}(sp)} \) \({\Delta _r}H_{298}^0 = {\rm{(}}{E_b}(C - C) + {\rm{5}}{\rm{.}}{E_b}(C - H) + {E_b}(C - O) + {E_b}(O - H){\rm{) - (6}}{\rm{.}}{E_b}(C - H) + 2.{E_b}(C - O){\rm{)}}\) \({\Delta _r}H_{298}^0 = {\rm{(}}347 + 5.414 + 360 + 464{\rm{)}} - {\rm{(}}6.414 + 2.360{\rm{)}} = 37\left( {kJ} \right)\) > 0 → Ở điều kiện chuẩn, CH3CH2OH bền hơn CH3OCH3 CH tr 47 15.10 Xét các phản ứng thế trong dãy halogen ở điều kiện chuẩn: (1) F2(g) + NaCl(s) → NaF(s) + Cl2(g) (2) Cl2(g) + NaBr(s) → NaCl(s) + Br2(l) (3) Br2(l) + NaI(s) → NaBr(s) + I2(s) (4) Cl2(g) + NaBr(aq) → NaCl(aq) + Br2(l) Hay còn viết: Cl2(g) + Br−(aq) → Cl−(aq) + Br2(l) (5) Br2(l) + NaI(aq) → NaBr(aq) + I2(s) Hay còn viết: Br2(l) + I−(aq) → Br−(aq) + I2(s) a) Từ các giá trị của enthalpy hình thành chuẩn, hãy tính biến thiên enthalpy chuẩn của các phản ứng thế trên.
(Các giá trị khác được cho trong Phụ lục 3, SGK Hóa học 10, Cánh Diều). b) Nhận xét sự thuận lợi về phương diện nhiệt của các phản ứng thế trong dãy halogen. Kết quả này có phù hợp với quy luật biến đổi tính phi kim của dãy halogen trong bảng tuần hoàn các nguyên tố hóa học không? Phương pháp giải: - Cách tính enthalpy của phản ứng hóa học dựa vào enthalpy tạo thành của các chất \({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} - \sum {{\Delta _r}H_{298}^0(cd)} \) Trong đó: \(\sum {{\Delta _r}H_{298}^0(sp)} \) và \(\sum {{\Delta _r}H_{298}^0(cd)} \) là tổng enthalpy tạo thành ở điều kiện chuẩn của sản phẩm và chất đầu của phản ứng Lời giải chi tiết: a) (1) \(\frac{1}{2}\)F2(g) + NaCl(s) → NaF(s) + \(\frac{1}{2}\)Cl2(g) → \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(NaF) - {\Delta _f}H_{298}^0(NaCl)\)(\({\Delta _r}H_{298}^0\) của đơn chất = 0) → \({\Delta _r}H_{298}^0 = - 574\; - \;\left( { - 411,2} \right)\; = - 162,8(kJ)\) (2) \(\frac{1}{2}\)Cl2(g) + NaBr(s) → NaCl(s) + \(\frac{1}{2}\)Br2(l) → \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(NaCl) - {\Delta _f}H_{298}^0(NaBr)\)(\({\Delta _r}H_{298}^0\) của đơn chất = 0) → \({\Delta _r}H_{298}^0 = - 411,2 - ( - 361,1)\; = - 50,1(kJ)\) (3) \(\frac{1}{2}\)Br2(l) + NaI(s) → NaBr(s) + \(\frac{1}{2}\)I2(s) → \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(NaBr) - {\Delta _f}H_{298}^0(NaI)\)(\({\Delta _r}H_{298}^0\) của đơn chất = 0) → \({\Delta _r}H_{298}^0 = - 361,1 - ( - 287,8)\; = - 73,3(kJ)\) (4) \(\frac{1}{2}\)Cl2(g) + NaBr(aq) → NaCl(aq) + \(\frac{1}{2}\)Br2(l) Hay còn viết: \(\frac{1}{2}\)Cl2(g) + Br−(aq) → Cl−(aq) + \(\frac{1}{2}\)Br2(l) → \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(C{l^ - }) - {\Delta _f}H_{298}^0(B{r^ - })\)(\({\Delta _r}H_{298}^0\) của đơn chất = 0) → \({\Delta _r}H_{298}^0 = - 167,2 - ( - 121,6)\; = - 45,6\;(kJ)\) (5) \(\frac{1}{2}\)Br2(l) + NaI(aq) → NaBr(aq) + \(\frac{1}{2}\)I2(s) Hay còn viết: \(\frac{1}{2}\)Br2(l) + I−(aq) → Br−(aq) + \(\frac{1}{2}\)I2(s) → \({\Delta _r}H_{298}^0 = {\Delta _f}H_{298}^0(B{r^ - }) - {\Delta _f}H_{298}^0({I^ - })\)(\({\Delta _r}H_{298}^0\) của đơn chất = 0) → \({\Delta _r}H_{298}^0 = - 121,6 - ( - 55,2)\; = - 66,4(kJ)\) b) - Các giá trị biến thiên enthalpy chuẩn đều âm → Quá trình diễn ra thuận lợi về phương diện nhiệt - Quy luật tính chất oxi hóa của X: Halogen có tính oxi hóa mạnh đẩy halogen có tính oxi hóa yếu hơn ra khỏi muối của nó → Kết quả thu được phù hợp với quy luật biến đổi tính phi kim của dãy halogen CH tr 48 15.11 Phân tử hemoglobin (Hb) trong máu nhận O2 ở phổi để chuyển thành HbO2. Chất này theo máu tới các bộ phận cơ thể, tại đó HbO2 lại chuyển thành Hb và O2 (để cung cấp O2 cho các hoạt động sinh hóa cần thiết trong cơ thể). Nếu trong không khí có lẫn carbon monoxide (CO), cơ thể nhanh chóng bị ngộ độc. Cho các số liệu thực nghiệm sau: Hb + O2 → HbO2 \({\Delta _r}H_{298}^0 = - 33,05{\rm{ }}kJ\) (1) Hb + CO → HbCO \({\Delta _r}H_{298}^0 = - 47,28{\rm{ }}kJ\) (2) HbO2 + CO → HbCO + O2 \({\Delta _r}H_{298}^0 = - 14,23{\rm{ }}kJ\) (3) HbCO + O2 → HbO2 + CO \({\Delta _r}H_{298}^0 = + 14,23{\rm{ }}kJ\) (4) Liên hệ giữa mức độ thuận lợi của phản ứng (qua \({\Delta _r}H_{298}^0\)) với những vấn đề thực nghiệm nêu trên. Phương pháp giải: Dựa vào giá trị của \({\Delta _r}H_{298}^0\), \({\Delta _r}H_{298}^0\) càng nhỏ → phản ứng diễn ra theo chiều thuận càng thuận lợi Lời giải chi tiết: - Phản ứng (2) có \({\Delta _r}H_{298}^0\) âm hơn so với phản ứng (1) và phản ứng (3) có \({\Delta _r}H_{298}^0\) âm hơn phản ứng (4) → Sự hình thành HbCO thuận lợi hơn sự hình thành HbO2 → Không có sự nhả O2 và giải phóng Hb như trường hợp không có CO → Gây ngộ độc CO trong máu
|