Bài 16: Tốc độ phản ứng hóa học trang 49, 50, 51 SBT Hóa 10 Cánh diềuKhi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hoá học xảy ra, tốc độ phản ứng sẽ. Phản ứng 3H2 + N2 → 2NH3 có tốc độ mất đi của H2 so với tốc độ hình thành NH3 như thế nào? Tổng hợp đề thi học kì 1 lớp 10 tất cả các môn - Cánh diều Toán - Văn - Anh - Lí - Hóa - Sinh - Sử - Địa...
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 49 16.1 Những phát biểu nào sau đây là đúng? A. Tốc độ của phản ứng hoá học là đại lượng mô tả mức độ nhanh hay chậm của chất phản ứng được sử dụng hoặc sản phẩm được tạo thành. B. Tốc độ của phản ứng hoá học là hiệu số nồng độ của một chất trong hỗn hợp phản ứng tại hai thời điểm khác nhau. C. Tốc độ của phản ứng hoá học có thể có giá trị âm hoặc dương. D. Trong cùng một phản ứng hoá học, tốc độ tạo thành của các chất sản phẩm khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học. E. Trong cùng một phản ứng hoá học, tốc độ tiêu thụ các chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ. Lời giải chi tiết: - Đáp án: A và D - Giải thích: + B sai vì tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian. + C sai vì tốc độ phản ứng có giá trị dương. + E sai vì trong cùng một phản ứng hoá học, tốc độ tiêu thụ của các chất phản ứng khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học. CH tr 49 16.2 Những phát biểu nào sau đây không đúng? A. Tốc độ của phản ứng hoá học chỉ có thể được xác định theo sự thay đổi nồng độ chất phản ứng theo thời gian. B. Tốc độ của phản ứng hoá học không thể xác định được từ sự thay đổi nồng độ chất sản phẩm tạo thành theo thời gian. C. Theo công thức tính, tốc độ trung bình của phản ứng hoá học trong một khoảng thời gian nhất định là không thay đổi trong khoảng thời gian ấy. D. Dấu “−” trong biểu thức tính tốc độ trung bình theo biến thiên nồng độ chất phản ứng là để đảm bảo cho giá trị của tốc độ phản ứng không âm. E. Tốc độ trung bình của một phản ứng trong một khoảng thời gian nhất định được biểu thị bằng biến thiên nồng độ chất phản ứng hoặc sản phẩm tạo thành chia cho khoảng thời gian đó Lời giải chi tiết: - Đáp án: A và B - Giải thích: + A sai vì tốc độ của phản ứng đơn giản còn được xác định dựa vào định luật tác dụng khối lượng. + B sai vì tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của các chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian. CH tr 49 16.3 Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hoá học xảy ra, tốc độ phản ứng sẽ A. không đổi cho đến khi kết thúc. B. tăng dần cho đến khi kết thúc. C. chậm dần cho đến khi kết thúc. D. tuân theo định luật tác dụng khối lượng. Lời giải chi tiết: - Đáp án: C CH tr 50 16.4 Tốc độ phản ứng còn được tính theo sự thay đổi lượng chất (số mol, khối lượng) theo thời gian. Cho hai phản ứng xảy ra đồng thời trong hai bình (1) và (2): Ca + Cl2 → CaCl2 (1) 2K + Cl2 → 2KCl (2) Sau 2 phút, có 3 gam CaCl2 được hình thành theo phản ứng (1). a) Xác định tốc độ trung bình của phản ứng (theo đơn vị mol phút-1) theo lượng sản phẩm được tạo ra. b) Giả sử phản ứng (2) cũng xảy ra cùng một tốc độ trung bình như phản ứng (1), hãy tính số mol KCl được tạo thành sau 2 phút. Cho biết khối lượng (gam) của K cần thiết để tạo ra số mol KCl trên. Lời giải chi tiết: a) Số mol CaCl2 được tạo ra sau 2 phút là: 3:111=0,027 (mol) Tốc độ trung bình của phản ứng (1) là: 0,027:2=0,0135 (mol/phút) b) Số mol KCl được tạo thành sau 2 phút là: nKCl = 0,0135.2.2 = 0,054 (mol) Khối lượng K cần thiết cho phản ứng xảy ra là: 0,054.39 = 2,106 (gam). CH tr 50 16.5 Cho hai phản ứng có phương trình hóa học như sau: 2O3 (g) → 3O2 (g) (1) 2HOF (g) → 2HF + O2 (g) (2) a) Viết biểu thức tốc độ trung bình (theo cả các chất phản ứng và chất sản phẩm) của hai phản ứng trên. b) Trong phản ứng (1), nếu \(\frac{{\Delta {C_{{O_2}}}}}{{\Delta t}} = 1,5 \times {10^{ - 4}}\) molL−1s−1 thì \(\frac{{\Delta {C_{{O_3}}}}}{{\Delta t}}\) bằng bao nhiêu? Phương pháp giải: Dựa vào biểu thức tốc độ trung bình của phản ứng: aA + bB " cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\) Trong đó: + \(\overline v \): tốc độ trung bình của phản ứng + \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ + \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian Lời giải chi tiết: a) Phản ứng 1: \(\overline v = - \frac{1}{2}.\frac{{\Delta {C_{{O_3}}}}}{{\Delta t}} = \frac{1}{3}.\frac{{\Delta {C_{{O_2}}}}}{{\Delta t}}\) Phản ứng 2: \(\overline v = - \frac{1}{2}.\frac{{\Delta {C_{{\rm{HOF}}}}}}{{\Delta t}} = \frac{1}{2}.\frac{{\Delta {C_{HF}}}}{{\Delta t}} = \frac{1}{1}.\frac{{\Delta {C_{{O_2}}}}}{{\Delta t}}\) b) Ta có: \(\overline v = - \frac{1}{2}.\frac{{\Delta {C_{{O_3}}}}}{{\Delta t}} = \frac{1}{3}.\frac{{\Delta {C_{{O_2}}}}}{{\Delta t}}\) → \(\frac{{\Delta {C_{{O_3}}}}}{{\Delta t}} = - \frac{2}{3}.\frac{{\Delta {C_{{O_2}}}}}{{\Delta t}} = - \frac{2}{3}.1,{5.10^{ - 4}}\; = \; - 1,{0.10^{ - 4}}(mol{L^{ - 1}}{s^{ - 1}})\) CH tr 50 16.6 Phản ứng 3H2 + N2 → 2NH3 có tốc độ mất đi của H2 so với tốc độ hình thành NH3 như thế nào? A. Bằng \(\frac{1}{2}\) B. Bằng \(\frac{3}{2}\) C. Bằng \(\frac{2}{3}\) D. Bằng \(\frac{1}{3}\) Phương pháp giải: Dựa vào biểu thức tốc độ trung bình của phản ứng: aA + bB " cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\) Trong đó: + \(\overline v \): tốc độ trung bình của phản ứng + \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ + \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian Lời giải chi tiết: - Đáp án: B CH tr 50 16.7 Cho phản ứng: 6CH2O + 4NH3 → (CH2)6N4 + 6H2O Tốc độ trung bình của phản ứng trên được biểu diễn bằng những biểu thức nào trong những biểu thức sau? A. \(\frac{1}{6}.\frac{{\Delta {C_{{H_2}O}}}}{{\Delta t}}\) B. \( - \frac{1}{4}.\frac{{\Delta {C_{N{H_3}}}}}{{\Delta t}}\) C. \(\frac{1}{6}.\frac{{\Delta {C_{C{H_2}O}}}}{{\Delta t}}\) D. \( - \frac{1}{6}.\frac{{\Delta {C_{C{H_2}O}}}}{{\Delta t}}\) E. \( - \frac{{\Delta {C_{{{(C{H_2})}_6}{N_4}}}}}{{\Delta t}}\) Phương pháp giải: Dựa vào biểu thức tốc độ trung bình của phản ứng: aA + bB " cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\) Trong đó: + \(\overline v \): tốc độ trung bình của phản ứng + \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ + \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian Lời giải chi tiết: - Đáp án: A, B, D CH tr 51 16.8 Những phát biểu nào sau đây không đúng? A. Phản ứng đơn giản là phản ứng xảy ra theo một bước. B. Phản ứng đơn giản là phản ứng có các hệ số tỉ lượng trong phương trình hóa học bằng nhau và bằng 1. C. Tốc độ của một phản ứng đơn giản tuân theo định luật tác dụng khối lượng. D. Tốc độ của mọi phản ứng hóa học đều tuân theo định luật tác dụng khối lượng. E. Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ của tất cả các chất trong hỗn hợp phản ứng đều bằng nhau và bằng 1. G. Hằng số tốc độ của phản ứng phụ thuộc vào thời gian. H. Hằng số tốc độ phản ứng là tốc độ của phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M. Lời giải chi tiết: - Đáp án: B, D, E, G - Giải thích: + B sai vì: Phản ứng đơn giản là phản ứng chỉ diễn ra qua một giai đoạn duy nhất, chất phản ứng tạo thành sản phẩm không qua một chất trung gian nào khác. + D sai vì: Định luật tác dụng khối lượng áp dụng cho các phản ứng đơn giản. + E sai vì: Hằng số tốc độ phản ứng có giá trị đúng bằng tốc độ phản ứng khi nồng độ các chất phản ứng bằng nhau và bằng 1 M CH tr 51 16.9 Cho phản ứng đơn giản: H2 + I2 → 2HI Người ta thực hiện ba thí nghiệm với nồng độ các chất đầu (\({C_{{H_2}}}\) và \({C_{{I_2}}}\)) được lấy khác nhau và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
Biểu thức định luật tác dụng viết cho phản ứng trên là: A. \(v = 1250{C_{{H_2}}}C_{{I_2}}^2\) B. \(v = 125{C_{{H_2}}}C_{{I_2}}^{}\) C. \(v = 250C_{{H_2}}^2\) D. \(v = 5,0{C_{{H_2}}}C_{{I_2}}^{}\) Phương pháp giải: Dựa vào biểu thức tốc độ trung bình của phản ứng: aA + bB " cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\) Trong đó: + \(\overline v \): tốc độ trung bình của phản ứng + \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ + \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian Lời giải chi tiết: - Có \(\overline v = - \frac{1}{1}.\frac{{\Delta {C_{{H_2}}}}}{{\Delta t}} = - \frac{1}{1}.\frac{{\Delta {C_{{I_2}}}}}{{\Delta t}} = \frac{1}{2}.\frac{{\Delta {C_{HI}}}}{{\Delta t}}\)
→ k = 125 → Đáp án: B CH tr 51 16.10 Cho phản ứng: 2A + B → 2M + 3N a) Hãy viết biểu thức tính tốc độ trung bình của phản ứng trên theo sự thay đổi nồng độ chất A, B, M và N. b) Nếu biến thiên nồng độ trung bình của chất M (\(\frac{{\Delta {C_M}}}{{\Delta t}}\)) là 1,0 mol L-1 s-1 thì tốc độ trung bình của phản ứng và biến thiên nồng độ trung bình của N (\(\frac{{\Delta {C_N}}}{{\Delta t}}\)); A (\( - \frac{{\Delta {C_A}}}{{\Delta t}}\)) và B (\( - \frac{{\Delta {C_B}}}{{\Delta t}}\)) lần lượt là: A. 2,0 mol L-1 s-1; 4,0 mol L-1 s-1; 6,0 mol L-1 s-1 và 2,0 mol L-1 s-1. B. 0,5 mol L-1 s-1; 1,5 mol L-1 s-1; 1,0 mol L-1 s-1 và 0,5 mol L-1 s-1. C. 1,0 mol L-1 s-1; 1,0 mol L-1 s-1; 1,0 mol L-1 s-1và 1,0 mol L-1 s-1. D. 2,0 mol L-1 s-1; 4,0 mol L-1 s-1; 3,0 mol L-1 s-1và 2,0 mol L-1 s-1. Phương pháp giải: Dựa vào biểu thức tốc độ trung bình của phản ứng: aA + bB → cC + dD là \(\overline v = - \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\) Trong đó: + \(\overline v \): tốc độ trung bình của phản ứng + \(\Delta C = {C_2} - {C_1}\): sự biến thiên nồng độ + \(\Delta t = {t_2} - {t_1}\): sự biến thiên thời gian Lời giải chi tiết: a) Biểu thức tính tốc độ trung bình của phản ứng 2A + B → 2M + 3N theo sự thay đổi nồng độ chất A, B, M và N: \(\overline v = - \frac{1}{2}.\frac{{\Delta {C_A}}}{{\Delta t}} = - \frac{1}{1}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{2}.\frac{{\Delta {C_M}}}{{\Delta t}} = \frac{1}{3}.\frac{{\Delta {C_N}}}{{\Delta t}}\) b) Tốc độ trung bình của phản ứng: \(\overline v = \frac{1}{2}.\frac{{\Delta {C_M}}}{{\Delta t}} = \frac{1}{2}.1 = 0,5(mol{L^{ - 1}}{s^{ - 1}})\) -> Đáp án: B CH tr 52 16.11 Phản ứng A → 2B được thực hiện trong một bình phản ứng. Số liệu thực nghiệm của phản ứng được cho trong bảng sau:
a) Hãy tính sự thay đổi nồng độ chất B sau mỗi 10 giây từ 0,0 tới 40,0 giây. Các giá trị này tăng hay giảm khi đi từ khoảng thời gian này sang khoảng thời gian tiếp theo? Vì sao? b) Tốc độ thay đổi của nồng độ chất A có liên quan như thế nào với tốc độ thay đổi của nồng độ chất B trong mỗi khoảng thời gian? Tính tốc độ thay đổi nồng độ của A trong khoảng thời gian từ 10,0 đến 20,0 giây. Lời giải chi tiết: a) Sự thay đổi nồng độ chất B sau mỗi 10 giây từ 0,0 tới 40,0 giây:
Các giá trị này giảm dần do tốc độ phản ứng giảm dần (tốc độ phụ thuộc nồng độ chất phản ứng và theo thời gian nồng độ chất phản ứng giảm dần). b) - Tốc độ thay đổi của nồng độ chất A chỉ bằng một nửa tốc độ hình thành chất B do hệ số của hai chất trong phương trình. - Tốc độ thay đổi nồng độ của A trong khoảng thời gian từ 10,0 đến 20,0 giây là: 0,247:(2.10) = 0,01235 mol L-1 s-1 CH tr 52 16.12 Bạn A và B thực hiện phản ứng giữa kẽm với dung dịch hydrochloric acid và thu được thể tích khí thoát ra theo thời gian. Hai bạn lặp lại thí nghiệm ba lần và kết quả của ba lần thí nghiệm được hai bạn ghi vào bảng sau:
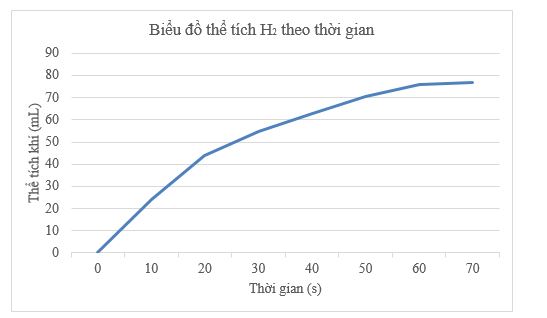
a) Cho biết khí thoát ra là khí gì. Hãy viết và cân bằng phương trình hoá học của phản ứng xảy ra. b) Hoàn thành hai cột còn trống trong bảng trên. Hãy biểu diễn kết quả của hai bạn lên đồ thị thể tích khí thu được theo thời gian. Vì sao hai bạn lại lặp lại thí nghiệm ba lần? c) Dựa vào đồ thị, cho biết khi nào phản ứng kết thúc. Vì sao? d) Phản ứng diễn ra nhanh nhất trong khoảng thời gian nào? Sau đó, phản ứng diễn ra nhanh dần hay chậm dần? e) Nếu thí nghiệm được lặp lại với nồng độ HCl lớn hơn thì tốc độ phản ứng sẽ nhanh hơn hay chậm hơn? g) Nếu hai bạn không đo được thể tích khí thoát ra, em hãy đề xuất một cách khác để xác định tốc độ phản ứng. Lời giải chi tiết: a) Khí thoát ra là khí H2. Phương trình hóa học: Zn(s) + 2HCl(aq) → H2(g) + ZnCl2(aq) b) Hoàn thành bảng:
Biểu diễn kết quả của hai bạn lên đồ thị thể tích khí thu được theo thời gian: Hai bạn cần lặp lại thí nghiệm ba lần để giảm sai số trong quá trình thực nghiệm và tăng độ tin cậy của kết quả thu được. c) Dựa vào đồ thị thấy khoảng 70 giây phản ứng sẽ kết thúc vì khi đó khí thoát ra rất chậm và gần như không đổi. d) Dựa vào đồ thị xác định phản ứng nhanh nhất trong khoảng 10 giây đầu, sau đó chậm dần. e) Nếu thí nghiệm được lặp lại với nồng độ HCl lớn hơn thì tốc độ phản ứng sẽ nhanh hơn. g) Nếu hai bạn không đo được thể tích khí thoát ra, có thể thực hiện thí nghiệm bằng cách đặt bình phản ứng lên cân và theo dõi sự thay đổi khối lượng của bình phản ứng khi phản ứng diễn ra để tính khối lượng H2 thu được. CH tr 53 16.13 Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3,5. Ở 15 °C, tốc độ của phản ứng này bằng 0,2 M s-1. Tính tốc độ của phản ứng ở 40 °C. Phương pháp giải: Dựa vào biểu thức hệ số nhiệt độ γ của phản ứng \({v_{{T_2}}} = {v_{{T_1}}}.{\gamma ^{\frac{{{T_2} - {T_1}}}{{10}}}}\) Trong đó: + \({v_{{T_1}}}\) là tốc độ phản ứng tại nhiệt độ T1 + \({v_{{T_2}}}\) là tốc độ phản ứng tại nhiệt độ T2 Lời giải chi tiết: - Có tốc độ của phản ứng ở 40°C: \({v_{40}} = {v_{15}}.3,{5^{\frac{{40 - 15}}{{10}}}} = 4,6(M/s)\) CH tr 53 16.14 Một bạn học sinh thực hiện hai thí nghiệm: Thí nghiệm 1: Cho 100 mL dung dịch acid HCl vào cốc (1), sau đó thêm một mẫu kẽm và đo tốc độ khí H2 thoát ra theo thời gian. Thí nghiệm 2 (lặp lại tương tự thí nghiệm 1): 100 mL dung dịch acid HCl khác được cho vào cốc (2) rồi cũng thêm một mẫu kẽm vào và lại đo tốc độ khí hydrogen thoát ra theo thời gian. Bạn học sinh đó nhận thấy tốc độ thoát khí hydrogen ở cốc (2) nhanh hơn ở cốc (1). Những yếu tố nào sau đây có thể dùng để giải thích hiện tượng mà bạn đó quan sát được? A. Phản ứng ở cốc (2) nhanh hơn nhờ có chất xúc tác. B. Lượng kẽm ở cốc (1) nhiều hơn ở cốc (2). C. Acid HCl ở cốc (1) có nồng độ thấp hơn acid ở cốc (2). D. Kẽm ở cốc (2) được nghiền nhỏ còn kẽm ở cốc (1) ở dạng viên. Lời giải chi tiết: - Đáp án: B, C, D - Giải thích: A sai vì thí nghiệm không sử dụng chất xúc tác. CH tr 54 16.15 Khi tăng áp suất của chất phản ứng, tốc độ của những phản ứng nào sau đây sẽ bị thay đổi? A. 2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s) B. 2H2(g) + O2(g) → 2H2O(l) C. C(s) + O2(g) → CO2(g) D. CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g) Lời giải chi tiết: - Đáp án: B và C - Giải thích: vì các phản ứng ở đáp án B và C có sự tham gia của chất khí CH tr 54 16.16 Khi nghiên cứu ảnh hưởng của nhiệt độ tới tốc độ của phản ứng giữa Mg(s) với HCl(aq), những mô tả nào sau đây phản ánh đúng hiện tượng quan sát được khi làm thí nghiệm? A. Khi đun nóng, bọt khí thoát ra nhanh hơn so với không đun nóng. B. Khi đun nóng, bọt khí thoát ra chậm hơn so với không đun nóng. C. Khi đun nóng, dây Mg tan nhanh hơn so với không đun nóng. D. Khi đun nóng, dây Mg tan chậm hơn so với không đun nóng. Lời giải chi tiết: - Đáp án: A và C
CH tr 54 16.17 Từ một miếng đá vôi và một lọ dung dịch HCl 1 M, thí nghiệm được tiến hành trong điều kiện nào sau đây sẽ thu được lượng CO2 lớn nhất trong một khoảng thời gian xác định? A. Tán nhỏ miếng đá vôi, cho vào dung dịch HCl 1M, không đun nóng. B. Tán nhỏ miếng đá vôi, cho vào dung dịch HCl 1M, đun nóng. C. Cho miếng đá vôi vào dung dịch HCl 1 M, không đun nóng. D. Cho miếng đá vôi vào dung dịch HCl 1M, đun nóng. Lời giải chi tiết: - Đáp án: B CH tr 54 16.18 Chất xúc tác là chất A. làm tăng tốc độ phản ứng và không bị mất đi sau phản ứng. B. làm tăng tốc độ phản ứng và bị mất đi sau phản ứng. C. làm giảm tốc độ phản ứng và không bị mất đi sau phản ứng. D. làm giảm tốc độ phản ứng và bị mất đi sau phản ứng. Lời giải chi tiết: - Đáp án: A CH tr 55 16.19 Enzyme catalase phân huỷ hydrogen peroxide thành oxygen và nước nhanh gấp khoảng 107 lần sự phân huỷ khi không có xúc tác. Giả sử một phản ứng không có xúc tác phân huỷ một lượng hydrogen peroxide mất 360 ngày, hãy tính thời gian (theo giây) cho sự phân huỷ cùng một lượng hydrogen peroxide đó khi sử dụng enzyme catalase làm xúc tác. Lời giải chi tiết: Thời gian phân hủy (theo giây) khi phân huỷ cùng một lượng hydrogen peroxide đó, sử dụng enzyme catalase làm xúc tác là: 360.24.60.60.10-7 = 3,11 (giây). CH tr 55 16.20 Hai bạn Tôm và Vừng thực hiện một thí nghiệm về sự phân huỷ của hydrogen peroxide với chất xúc tác manganese dioxide (MnO2). Hai bạn thấy rằng phản ứng sủi bọt nhiều và khí thoát ra mạnh khi thêm manganese dioxide. 1. Hoàn thành các câu sau đây nói về thí nghiệm của hai bạn. a) Phương trình của phản ứng là: ...... b) Chất khí thoát ra là ...(1)... và có thể kiểm tra (nhận biết) ra nó bằng cách ...(2)... c) Sau một thời gian nhất định, Vừng nói với Tôm là phản ứng đã kết thúc vì ...... d) Hai bạn biết rằng chất xúc tác chỉ làm tăng tốc độ phản ứng mà không thay đổi về bản chất hoá học nên Tôm sẽ thu lại manganese dioxide sau khi phản ứng kết thúc bằng cách ..... 2. Tôm và Vừng muốn biết liệu cho lượng xúc tác nhiều hơn thì có làm phản ứng nhanh hơn không. Em hãy đề xuất một kế hoạch thí nghiệm cho nghiên cứu của hai bạn. Trong bản kế hoạch, em cần viết cả những lưu ý để đảm bảo an toàn khi làm việc trong phòng thí nghiệm. Lời giải chi tiết: 1. a) 2H2O2 O2 + 2H2O b) (1) oxygen; (2) đưa que đóm còn tàn đỏ sẽ thấy que đóm bùng cháy. c) ...không còn thấy khí thoát ra d) ...lọc 2. Kế hoạch thí nghiệm: - Hóa chất: H2O2; MnO2 - Dụng cụ: Bình tam giác to (hoặc lọ thủy tinh), ống dẫn khí, phễu bromine, ống nghiệm, chậu thủy tinh. - Chú ý: Phễu bromine là loại phễu được thiết kế có nút đậy, khóa nhám, Loại này được dùng để đựng và rót các loại hóa chất có dạng lỏng bay hơi xuống các bình, lọ trong lúc đang tiến hành các phản ứng hóa học. - Cách tiến hành: + Thí nghiệm 1: Cho một lượng H2O2 vào phễu bromine, cho 1 gam MnO2 vào bình tam giác. Mở từ từ khóa phễu bromine cho H2O2 chảy xuống; khí O2 được thu vào bình thu khí bằng phương pháp dời nước. Bấm giờ theo dõi thời gian từ lúc bắt đầu mở khóa phễu cho đến khi phản ứng kết thúc (ngừng sủi bọt khí). + Thí nghiệm 2: Cho một lượng H2O2 (bằng lượng dùng ở thí nghiệm 1) vào phễu bromine, cho 2 gam MnO2 vào bình tam giác. Mở từ từ khóa phễu bromine cho H2O2 chảy xuống; khí O2 được thu vào bình thu khí bằng phương pháp dời nước. Bấm giờ theo dõi thời gian từ lúc bắt đầu mở khóa phễu cho đến khi phản ứng kết thúc (ngừng sủi bọt khí). + So sánh thời gian phản ứng ở hai thí nghiệm, rút ra kết luận. - Lưu ý: + Trước khi lắp dụng cụ thí nghiệm cần phác họa sơ đồ dụng cụ, thống kê các bộ phận cần thiết, chọn đủ dụng cụ rồi mới lắp. + Sau khi lắp xong dụng cụ thí nghiệm cần thử lại xem dụng cụ đã kín chưa. Ví dụ: Dùng miệng thổi hoặc nhỏ nước lên chỗ nối để kiểm tra. + Sau mỗi lần lấy H2O2 phải đóng kín lại ngay.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||