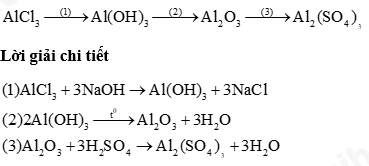Đề thi giữa kì I KHTN 8 Cánh diều - Đề số 3Tải vềCông dụng của thìa thủy tinh là A. đo khối lượng. B. lấy hóa chất rắn. C. cố định ống nghiệm. D. đun nóng. Tổng hợp đề thi học kì 1 lớp 8 tất cả các môn - Cánh diều Toán - Văn - Anh - Khoa học tự nhiên
Lựa chọn câu để xem lời giải nhanh hơn
Tải về
Đề thi Câu 1: Công dụng của thìa thủy tinh là A. đo khối lượng. B. lấy hóa chất rắn. C. cố định ống nghiệm. D. đun nóng. Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi hóa học? A. Muối ăn hòa vào nước thành nước muối. B. Bật bếp ga thấy lửa màu xanh. C. Cồn bay hơi khi mở nắp. D. Mở lọ nước hoa thấy mùi thơm. Câu 3: Chất phản ứng của phản ứng: nhôm (aluminium) + chlorine → aluminium chloride là A. nhôm (aluminium). B. aluminium chloride. C. chlorine. D. nhôm (aluminium) và chlorine. Câu 4: Phản ứng tỏa nhiệt là phản ứng trong đó A. hỗn hợp phản ứng truyền nhiệt cho môi trường. B. chất phản ứng truyền nhiệt cho sản phẩm. C. chất phản ứng thu nhiệt từ môi trường D. các chất sản phẩm thu nhiệt từ môi trường. Câu 5: Khối lượng của 0,2 mol Al2O3 là A. 10,2g B. 2,04g C. 1,02g D. 20,4g Câu 6: Đốt cháy hoàn toàn 0,384 gam magnesium trong khí oxygen, thu được 0,640 gam magnesium oxide. Có bao nhiêu gam oxygen đã tham gia phản ứng A. 0,640 gam B. 0,256 gam C. 0,320 gam D. 0,512 gam Câu 7: ở 25oC, 250 gam nước có thể hòa tan tối đa 80 gam KNO3, độ tan của KNO3 ở 25oC là A. 32 gam/ 100 gam H2O B. 36 gam/ 100 gam H2O C. 80 gam/ 100 gam H2O D. 40 gam/ 100 gam H2O Câu 8: Trong phòng thí nghiệm, khí O2 được điều chế từ phản ứng tỏa nhiệt phân potassium permanganate (KMnO4): 2 KMnO4 ® K2MnO4 + MnO2 + O2 .Đem nhiệt phân hoàn toàn 7, 9 gam potassium permanganate thu được khối lượng khí O2 là
Câu 9: Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây? A. Đốt trong lò kín. B. Xếp củi chặt khít. C. Thổi không khí khô. D. Thổi hơi nước. Câu 10: Chất nào sau đây không phản ứng với sắt? A. NaCl. B. CH3COOH. C. H2SO4. D. HCl. Câu 11: Dãy chất nào sau đây chỉ gồm các base không tan? A. Fe(OH)2, Mg(OH)2, NaOH. B. Fe(OH)3, Cu(OH)2, KOH. C. Mg(OH)2, Cu(OH)2, Ba(OH)2. D. Fe(OH)3, Mg(OH)2, Cu(OH)2. Câu 12: Chất nào sau đây là oxide lưỡng tính? A. Fe2O3. B. CaO. C. SO3. D. Al2O3. Câu 13: Cho sơ đồ phản ứng sau: ? + 2HCl → ZnCl2 + H2 Chất thích hợp để điền vào vị trí dấu hỏi là A. Zn(OH)2. B. ZnO. C. Zn. D. ZnCO3. Câu 14: Dung dịch không màu X có pH = 10, dung dịch không màu Y có pH=4. Khi nhỏ dung dịch phenolphtalein vào các dung dịch X và Y thì có hiện tượng: A. Dung dịch X và Y chuyển sang màu hồng. B. Dung dịch X và Y không chuyển màu. C. Dung dịch X chuyển màu hồng, dung dịch Y không chuyển màu. D. Dung dịch X không đổi màu, dung dịch Y chuyển sang màu hồng. Câu 15: Công thức hóa học của một trong các loại phân bón kép là A. K2SO4 B. (NH4)2SO4 C.KNO3 D. Ca3(PO4)2. II. Tự luận Câu 1: Hoàn thành sơ đồ phản ứng sau Câu 2: Một nguyên tố R có hoá trị II. Trong thành phần oxide của R, oxygen chiếm 40% về khối lượng. a) Tìm công thức oxide đó? b) Cho 4g oxide trên tác dụng vừa đủ với 200ml dung dịch HCl, tính nồng độ dung dịch HCl đã dùng.
Đáp án Phần trắc nghiệm
Câu 1: Công dụng của thìa thủy tinh là A. đo khối lượng. B. lấy hóa chất rắn. C. cố định ống nghiệm. D. đun nóng. Phương pháp giải Công dụng của thìa thủy tinh: lấy hóa chất rắn Lời giải chi tiết Đáp án B Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi hóa học? A. Muối ăn hòa vào nước thành nước muối. B. Bật bếp ga thấy lửa màu xanh. C. Cồn bay hơi khi mở nắp. D. Mở lọ nước hoa thấy mùi thơm. Phương pháp giải Biến đổi hóa học có sự thay đổi về chất Lời giải chi tiết Đáp án B (các khí gas cháy tạo ra nhiệt) Câu 3: Chất phản ứng của phản ứng: nhôm (aluminium) + chlorine → aluminium chloride là A. nhôm (aluminium). B. aluminium chloride. C. chlorine. D. nhôm (aluminium) và chlorine. Phương pháp giải Chất phản ứng là chất ban đầu tham gia phản ứng Lời giải chi tiết Đáp án D Câu 4: Phản ứng tỏa nhiệt là phản ứng trong đó A. hỗn hợp phản ứng truyền nhiệt cho môi trường. B. chất phản ứng truyền nhiệt cho sản phẩm. C. chất phản ứng thu nhiệt từ môi trường D. các chất sản phẩm thu nhiệt từ môi trường. Phương pháp giải Phản ứng tỏa nhiệt là phản ứng tỏa ra năng lượng dưới dạng nhiệt Lời giải chi tiết Đáp án A Câu 5: Khối lượng của 0,2 mol Al2O3 là A. 10,2g B. 2,04g C. 1,02g D. 20,4g Phương pháp giải Dựa vào công thức tính khối lượng m = n.M Lời giải chi tiết m Al2O3 = 0,2 . 102 = 20,4g Đáp án D Câu 6: Đốt cháy hoàn toàn 0,384 gam magnesium trong khí oxygen, thu được 0,640 gam magnesium oxide. Có bao nhiêu gam oxygen đã tham gia phản ứng A. 0,640 gam B. 0,256 gam C. 0,320 gam D. 0,512 gam Phương pháp giải Áp dụng định luật bảo toàn khối lượng: m tham gia = m sản phẩm Lời giải chi tiết m magnesium + m oxygen = m magnesium dioxide => m oxygen = 0,640 – 0,384 = 0,256g Đáp án B Câu 7: ở 25oC, 250 gam nước có thể hòa tan tối đa 80 gam KNO3, độ tan của KNO3 ở 25oC là A. 32 gam/ 100 gam H2O B. 36 gam/ 100 gam H2O C. 80 gam/ 100 gam H2O D. 40 gam/ 100 gam H2O Phương pháp giải Áp dụng công thức: \(s = \frac{{{m_{ct}}}}{{{m_{{H_2}O}}}}.100\) Lời giải chi tiết \(s = \frac{{{m_{ct}}}}{{{m_{{H_2}O}}}}.100 = \frac{{80}}{{250}}.100 = 32g\) Đáp án A Câu 8: Trong phòng thí nghiệm, khí O2 được điều chế từ phản ứng tỏa nhiệt phân potassium permanganate (KMnO4): 2 KMnO4 ® K2MnO4 + MnO2 + O2 .Đem nhiệt phân hoàn toàn 7, 9 gam potassium permanganate thu được khối lượng khí O2 là A. 0,2 gam. B. 1,6 gam C. 0,4 gam. D. 0,8 gam. Phương pháp giải Tính số mol KMnO4 sau đó dựa vào phương trình để tính số mol O2 Lời giải chi tiết \({n_{KMnO4}} = \frac{{7,9}}{{158}} = 0,05mol\) Theo phương trình: n KMnO4 = 2 n O2 => n O2 = 0,05 : 2 = 0,025 mol => m O2 = 0,025.32 = 0,8g Đáp án D Câu 9: Khi đốt củi, để tăng tốc độ cháy, người ta sử dụng biện pháp nào sau đây? A. Đốt trong lò kín. B. Xếp củi chặt khít. C. Thổi không khí khô. D. Thổi hơi nước. Phương pháp giải Dựa vào yếu tố để tăng tốc độ phản ứng Lời giải chi tiết Đáp án C Câu 10: Chất nào sau đây không phản ứng với sắt? A. NaCl. B. CH3COOH. C. H2SO4. D. HCl. Phương pháp giải Sắt tác dụng được với dung dịch acid Lời giải chi tiết Đáp án A Câu 11: Dãy chất nào sau đây chỉ gồm các base không tan? A. Fe(OH)2, Mg(OH)2, NaOH. B. Fe(OH)3, Cu(OH)2, KOH. C. Mg(OH)2, Cu(OH)2, Ba(OH)2. D. Fe(OH)3, Mg(OH)2, Cu(OH)2. Phương pháp giải Dựa vào phân loại base Lời giải chi tiết Đáp án D Câu 12: Chất nào sau đây là oxide lưỡng tính? A. Fe2O3. B. CaO. C. SO3. D. Al2O3. Lời giải chi tiết Đáp án D Câu 13: Cho sơ đồ phản ứng sau: ? + 2HCl → ZnCl2 + H2 Chất thích hợp để điền vào vị trí dấu hỏi là A. Zn(OH)2. B. ZnO. C. Zn. D. ZnCO3. Phương pháp giải Dựa vào kim loại trong muối để xác định kim loại Lời giải chi tiết Đáp án C Câu 14: Dung dịch không màu X có pH = 10, dung dịch không màu Y có pH=4. Khi nhỏ dung dịch phenolphtalein vào các dung dịch X và Y thì có hiện tượng: A. Dung dịch X và Y chuyển sang màu hồng. B. Dung dịch X và Y không chuyển màu. C. Dung dịch X chuyển màu hồng, dung dịch Y không chuyển màu. D. Dung dịch X không đổi màu, dung dịch Y chuyển sang màu hồng. Phương pháp giải Dung dịch có pH = 10 => môi trường base, làm phenolphtalein chuyển màu hồng Dung dịch có pH = 4 => môi trường acid, không làm phenolphtalein chuyển màu Lời giải chi tiết Đáp án C Câu 15: Công thức hóa học của một trong các loại phân bón kép là A. K2SO4 B. (NH4)2SO4 C.KNO3 D. Ca3(PO4)2. Phương pháp giải Phân bón kép chứa nhiều nguyên tố dinh dưỡng trong thành phần Lời giải chi tiết Đáp án C II. Tự luận Câu 1: Hoàn thành sơ đồ phản ứng sau
Câu 2: Một nguyên tố R có hoá trị II. Trong thành phần oxide của R, oxygen chiếm 40% về khối lượng. a) Tìm công thức oxide đó? b) Cho 4g oxide trên tác dụng vừa đủ với 200ml dung dịch HCl, tính nồng độ dung dịch HCl đã dùng. Phương pháp giải Dựa vào tính chất lí hóa của oxide Lời giải chi tiết: a) Carbon dioxide: CO2. R hoá trị II nên oxide có công thức RO. Tỉ lệ oxygen: \(\frac{{16}}{{R + 16}}.100\% = 40\% \) ⇒ R = 24. Vậy R là Mg, oxide là MgO. b, n MgO = 4 : 40 = 0,1 mol \(\begin{array}{l}MgO + 2HCl \to MgC{l_2} + {H_2}O\\0,1 \to 0,2\\{C_M}_{_{HCl}} = \frac{{0,2}}{{0,2}} = 0,1M\end{array}\)
|