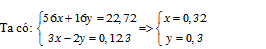20 bài tập vận dụng cao về axit nitric - muối nitrat có lời giải (phần 1)Làm bàiCâu hỏi 1 : Đốt cháy 10,08 gam Mg trong oxi một thời gian, thu được m gam hỗn hợp rắn X. Hòa tan hết X trong dung dịch gồm HCl 0,9M và H2SO4 0,6M, thu được dung dịch Y chỉ chứa các muối có khối lượng 3,825m gam. Mặt khác, hòa tan hết 1,25m gam X trong dung dịch HNO3 loãng dư, thu được dung dịch Z chứa 82,5 gam muối và hỗn hợp khí T gồm N2 và 0,015 mol khí N2O. Số mol HNO3 phản ứng là
Đáp án: A Phương pháp giải: 1. Bảo toàn điện tích 2. Bảo toàn khối lượng 3. Bảo toàn e Lời giải chi tiết: + \(Y\left\{ \begin{array}{l}{n_{C{l^ - }}} = 0,9x\\{n_{S{O_4}^{2 - }}} = 0,6x\\{n_{M{g^{2 + }}}} = 0,42\end{array} \right. \to \left\{ \begin{array}{l}BTDT:0,9x + 2.0,6x = 2.0,42\\BTKL:35,5.0,9x + 96.0,6x = 3,825m - 10,08\end{array} \right. \to \left\{ \begin{array}{l}x = 0,4\\m = 12\end{array} \right.\) Trong 1,25m gam có \(\left\{ \begin{array}{l}{n_{MgO}} = \frac{{1,25.(12 - 10,08)}}{{16}} = 0,15\\{n_{Mg}} = 1,25.0,42 - 0,15 = 0,375\end{array} \right.\) + \(\begin{array}{l}\left\{ \begin{array}{l}BTKL:{n_{N{H_4}N{O_3}(Z)}} = \frac{{m{\,_{muoi(Z)}} - {m_{Mg{{(N{O_3})}_2}}}}}{{{M_{N{H_4}N{O_3}}}}} = \frac{{82,5 - (0,15 + 0,375).148}}{{80}} = 0,06\\BT\,e:{n_{{N_2}}} = \frac{{0,375.2 - 0,06.8 - 0,015.8}}{{10}} = 0,015\end{array} \right.\\ \to {n_{HN{O_3}}} = 2{n_{M{g^{2 + }}}} + 2{n_{{N_2}}} + 2{n_{{N_2}O}} + 2{n_{N{H_4}N{O_3}}} = 1,23mol\end{array}\) Đáp án A Câu hỏi 2 : Cho 4,32 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ đến khi phản ứng xảy ra hoàn toàn thu được dung dịch X; 0,896 lít (đktc) hỗn hợp khí Y có khối lượng 0,92 gam gồm 2 khí không màu có một khí hóa nâu trong không khí và còn lại 2,04 gam chất rắn không tan. Cô cạn cẩn thận dung dịch X, thu được m gam muối khan. Giá trị của m là
Đáp án: B Phương pháp giải: 1. Bảo toàn nguyên tố 2. Bảo toàn e 3. Bảo toàn điện tích Lời giải chi tiết: Khí là NO và H2, tính được nH2 = 0,01 mol và nNO = 0,03 mol => X không chứa NO3- (do H+ dư tạo khí H2) Sơ đồ phản ứng:
\(\begin{gathered} Đáp án B Câu hỏi 3 : Hòa tan hết hỗn hợp kim loại (Mg, Al, Zn) trong dung dịch HNO3 loãng vừa đủ thu được dung dịch X và không có khí thoát ra. Cô cạn cẩn thận dung dịch X thu được m gam muối khan (trong đó oxi chiếm 61,364% về khối lượng). Nung m gam muối khan đến khối lượng không đổi thu được 19,2g chất rắn. Giá trị của m gần nhất với :
Đáp án: B Phương pháp giải: Bảo toàn e, Bảo toàn khối lượng
Lời giải chi tiết: Vì KL + HNO3 không có khí thoát ra => sản phẩm khử là NH4NO3 TQ : 2M(NO3)n ---> M2On + 2nNO2 + 0,5nO2 NH4NO3 ---> N2O + 2H2O nO(X) = 0,61364m/16 (mol) nNO3 = ne tđ + nNH4NO3 = 1/3nO(X) = 0,61364m/48 (mol) Ta có : ne tđ = 8nNH4NO3 => ne tđ = 0,61364m/54 = nNO2 = 4nO2 ; nNH4NO3 = 0,61364m/432 => nO2 = 0,61364m/216 (mol) Bảo toàn khối lượng : mX - mrắn = mNH4NO3 + mNO2 + mO2 => m – 19,2 = 80. 0,61364m/432 + 46. 0,61364m/54 + 32. 0,61364m/216 => m = 70,4g Đáp án B Câu hỏi 4 : Cho 22,72 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 2,688 lít khí NO (sản phẩm khử duy nhất, ở đktc). Khối lượng muối nitrat sau phản ứng là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án: D Phương pháp : Quy đổi tất cả các oxit ban đầu gồm Fe và O , dùng bảo toàn e và bảo toàn khối lượng. Hướng dẫn giải: n NO = 2,688 : 22,4 = 0,12 (mol) Coi hỗn hợp ban đầu gồm Fe và O với số mol lần lượt là x; y mol Ta có:
Khối lượng muối Fe(NO3)3 = 0,32 . 242= 77,44 (g) Câu hỏi 5 : Cho 8,4 gam bột Mg tác dụng vừa đủ với dung dịch HNO3 vừa đủ thu được dung dịch Y và 2,24 lít khí NO duy nhất. Khối lượng muối tạo thành trong dng dịch Y là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án: C Phương pháp : dùng bảo toàn e, n e (KL nhường) = n e (HNO3 nhận) Hướng dẫn giải: n Mg = 0,35 (mol) ; n NO = 0,1 (mol) n NH4NO3 = ( 0,35.2 – 0,1.3 ): 8 = 0,05 (mol) =>m MUỐI = mMg(NO3)2 + m NH4NO3 = 0,35. 148+ 0,05. 80 = 55, 8 (gam) Câu hỏi 6 : Nhiệt phân hết 1 muối nitrat thu được rắn A và hỗn hợp khí B. Cho A tác dụng với HCl thì thấy không có phản ứng xảy ra. Tỉ khối của hỗn hợp B so với H2 là:
Đáp án: D Phương pháp giải: Lời giải chi tiết: A không tác dụng với HCl → Nhiệt phân muối sau Cu 2M(NO3)n → 2M + 2nNO2 +nO2 => Hỗn hợp khí gồm NO2 và O2 có tỉ lệ là 2 : 1 => Mtb=(46.2+32.1)/3=124/3 => d hh/H2 = 62/3 Đáp án: D Câu hỏi 7 : Nung 27,3 gam hỗn hợp NaNO3, Cu(NO3)2 khan sinh ra hỗn hợp khí A, dẫn toàn bộ A vào 89,2 ml H2O thấy có 1,12 lít khí (đktc) không bị nước hấp thụ. Nồng độ phần trăm của dung dịch tạo thành là bao nhiêu? (Coi độ tan của O2 trong nước không đáng kể)
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án: A Nhận xét: Tỉ lệ NO2: O2 hấp thụ vào nước là 4:1 bằng với tỉ lệ sinh ra do Cu(NO3)2 nhiệt phân => 1,12 lít khí không hấp thụ là O2 do NaNO3 nhiệt phân ra.
$$\eqalign{ & {n_{{O_2}(do{\rm{ }}NaN{O_3})}} = 0,05 = > {n_{NaN{O_3}}} = 2{n_{{O_2}}} = 0,1 \cr & = > {n_{Cu{{(N{O_3})}_2}}} = {{27,3 - 0,1.85} \over {188}} = 0,1 = > {n_{N{O_2}}} = 0,2{\rm{ ;}}{{\rm{n}}_{{O_2}}} = {\rm{ }}0,05;{\rm{ }}{n_{HN{O_3}}} = 0,2 \cr & = > {m_{{\rm{dd}}}} = {m_{{O_2}P{\rm{}}}} + {m_{N{O_2}}} + {m_{{H_2}O}} = {\rm{ }}0,05.32 + 0,2.46 + 89,2.1{\rm{ }} = {\rm{ }}100(g) \cr & C\% HN{O_3} = {\rm{ }}[(0,2.63):100].100\% {\rm{ }} = {\rm{ }}12,6(\% ) \cr} $$ Câu hỏi 8 : Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng, thu được 5,376 lít (đktc) hỗn hợp khí X gồm N2; N2O và dung dịch chứa 8m gam muối. Tỉ khối của X so với H2 bằng 18. Giá trị của m là
Đáp án: D Phương pháp giải: HS xét 2 trường hợp: *TH1: Không tạo muối NH4NO3 *TH2: Tạo muối NH4NO3 Lời giải chi tiết: nhh khí = 0,24 (mol); Mhh khí = 18.2 = 36 Đặt nN2 = a (mol); nN2O = b (mol) Ta có hệ phương trình: \(\left\{ \begin{array}{l}{n_{khi}} = a + b = 0,24\\{m_{khi}} = 28{\rm{a}} + 44b = 0,24.36\end{array} \right. \to a = b = 0,12\) *TH1: Không tạo muối NH4NO3 Áp dụng bảo toàn e: \({n_{Al}} = \frac{{10{n_{{N_2}}} + 8{n_{{N_2}O}}}}{3} = \frac{{10.0,12 + 8.0,12}}{3} = 0,72\left( {mol} \right)\) → m = 0,72.27 = 19,44 gam → mmuối = 8m = 155,52 gam Bảo toàn Al → nAl(NO3)3 = nAl = 0,72 mol → mAl(NO3)3 = 153,36g ≠ 155,52g (loại) *TH2: Tạo muối NH4NO3 Đặt nAl = x (mol); n NH4NO3 = y (mol) + Áp dụng bảo toàn e: 3nAl = 10nN2 + 8nN2O + 8nNH4NO3 → 3x = 10.0,12 + 8.0,12 + 8y (1) + mmuối = 8m → 213x + 80y = 8.27x (2) Giải hệ (1) (2) được x = 0,8 và y = 0,03 Vậy m = 27x = 21,6 gam Đáp án D Câu hỏi 9 : Khi cho 5,4 gam kim loại Al tác dụng với dung dịch HNO3 loãng dư thu được dung dịch A chứa 45,0 gam muối. Số mol khí thoát ra ít nhất trong thí nghiệm là bao nhiêu?
Đáp án: A Phương pháp giải: Bảo toàn nguyên tố, bảo toàn electron. Lời giải chi tiết: BTNT "Al": nAl(NO3)3 = nAl = 5,4/27 = 0,2 mol Mặt khác: mmuối = mAl(NO3)3 + mNH4NO3 => mNH4NO3 = 45 - 0,2.213 = 2,4 gam => nNH4NO3 = 0,03 mol Bảo toàn electron: 3nAl = 8nNH4NO3 + e.n Khí => 3.0,2 = 8.0,03 + e.n Khí => e.n Khí = 0,36 mol Khi e lớn nhất thì nKhí nhỏ nhất. Vậy số mol khí nhỏ nhất khi e = 10 => nN2 = 0,36 : 10 = 0,036 mol Đáp án A Câu hỏi 10 : Khi cho 9,45 gam kim loại Al tác dụng với dung dịch HNO3 loãng dư thu được dung dịch A chứa 78,55 gam muối. Thể tích khí (đktc) thoát ra ít nhất trong thí nghiệm là bao nhiêu?
Đáp án: C Phương pháp giải: Bảo toàn nguyên tố, bảo toàn electron. Lời giải chi tiết: BTNT "Al": nAl(NO3)3 = nAl = 9,45/27 = 0,35 mol Mặt khác: mmuối = mAl(NO3)3 + mNH4NO3 => mNH4NO3 = 78,55 - 0,35.213 = 4 gam => nNH4NO3 = 0,05 mol Bảo toàn electron: 3nAl = 8nNH4NO3 + e.n Khí => 3.0,35 = 8.0,05 + e.n Khí => e.n Khí = 0,65 mol Khi e lớn nhất thì nKhí nhỏ nhất. Vậy số mol khí nhỏ nhất khi e = 10 => nN2 = 0,65 : 10 = 0,065 mol => VN2 = 1,456 lít. Đáp án C Câu hỏi 11 : Hòa tan hết 30 gam rắn gồm Mg, MgO, MgCO3 trong HNO3 thấy có 2,15 mol HNO3 phản ứng. Sau phản ứng thu được 4,48 lít (đktc) hỗn hợp khí NO, CO2 có tỉ so với H2 là 18,5 và dung dịch X chứa m gam muối. Giá trị của m là
Đáp án: B Phương pháp giải: 1. Bảo toàn nguyên tố 2. Bảo toàn e 3. Bảo toàn điện tích Lời giải chi tiết: \(\begin{gathered} Đáp án B Câu hỏi 12 : Cho 5 gam bột Mg vào dung dịch hỗn hợp KNO3 và H2SO4, đun nhẹ, trong điều kiện thích hợp, đến khi phản ứng xảy ra hoàn toàn thu được dung dịch A chứa m gam muối; 1,792 lít hỗn hợp khí B (đktc) gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí và còn lại 0,44 gam chất rắn không tan. Biết tỉ khối hơi của B đối với H2 là 11,5. Giá trị của m là:
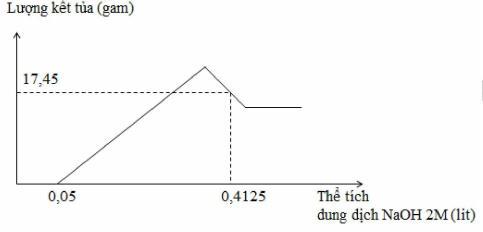
Đáp án: A Phương pháp giải: Lời giải chi tiết: Khí B gồm NO ( 0,06 mol ) và H2 ( 0,02 mol ) ; nMg pư = 0,19 mol Theo định luật bảo toàn electron : nNH4+ = (0,19.2 – 0,06.3 - 0,02.2)/8 = 0,02 mol Do tạo H2 nên NO3- hết nên : nKNO3 = 0,06 + 0,02 = 0,08 mol Dung dịch A chứa : Mg2+( 0,19 mol) ; K+ (0,08 mol); NH4+ ( 0,02 mol ) và SO42- ( 0,24 mol ) => m = 31,08 gam Đáp án A Câu hỏi 13 : Hòa tan hoàn toàn m gam hỗn hợp Al và Mg trong V ml dung dịch HNO3 2,5 M. Kết thúc phản ứng thu được dung dịch X ( không chứa muối amoni) và 0,084 mol hỗn hợp khí gồm N2 và N2O có tỉ khối so với oxi là 31:24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ dưới đây:
Giá trị của m và V lần lượt là
Đáp án: D Phương pháp giải: Bảo toàn nguyên tố Bảo toàn electron Lời giải chi tiết: Theo quy tắc đường chéo tính được N2 :0,014 mol và N2O : 0,07 mol Đặt nAl = x mol nMg= y mol Dd X có dư HNO3 nên Al và Mg phản ứng hết Al → Al+3 + 3e Mg → Mg+2 + 2e 2N+5 + 10e → N2 2N+5 + 8e → 2N+1 Bảo toàn e thì 3x + 2y = 0,014.10 +0,07.8=0,7 Cho NaOH vào NaOH + HNO3 → NaNO3 + H2O → HNO3 dư :0,1 mol Tại thể tích NaOH là 0,4125 lít thì kết tủa qua vị trí cực đại → Al(OH)3 bị hòa tan một phần 2OH- + Mg2+ → Mg(OH)2 3OH- + Al3+ → Al(OH)3 Al(OH)3 + OH- → AlO2- +H2O Kết tủa có Mg(OH)2 : y mol, Al(OH)3 : x-z mol( giả sử z mol Al(OH)3 bị hòa tan) Ta có 17,45=58y+78(x-z)=m↓ 2y + 3x + z =(0,4125-0,05).2=nNaOH → x= 0,1 mol ; y=0,2 mol; z=0,025 mol → m= 27x + 24y=7,5 Bảo toàn N trong phản ứng X + HNO3 có nHNO3 = 3x + 2y + 2nN2 + 2nN2O + nHNO3 dư = 0,968 → V=0,3872 Đáp án D Câu hỏi 14 : Cho 21,6 gam bột Mg tan hết trong dung dịch hỗn hợp gồm NaNO3 và NaHSO4 thu được dung dịch X chỉ chứa m gam hỗn hợp các muối trung hòa và 5,6 lít hỗn hợp khí Y gồm N2O và H2 (tỉ khối của Y so với H2 là 13,6). Giá trị gần nhất của m là
Đáp án: C Phương pháp giải: Bảo toàn khối lượng Bảo toàn nguyên tố Bảo toàn điện tích Tính khối lượng muối theo khối lượng ion tạo nên muối Lời giải chi tiết: Theo quy tắc đường chéo tính được Y có 0,15 mol N2O và 0,1 mol H2 nMg=0,9 mol Vì phản ứng tạo cả H2 nên NO3 hết trong dung dịch thu được X Ta có Mg → Mg+2 +2e 2N+5 + 8e → 2N+1 2H+1 +2 e→H2 Ta có 2nMg > 8nN2O + 2nH2 → phản ứng tạo thêm NH4+ N+5 + 8e → N-3 Bảo toàn e ta có nNH4 = (0,9.2 – 0,15.8-0,1.2) : 8 = 0,05 mol Bảo toàn N ta có nNaNO3 = 2nN2O + nNH4 = 2.0,15+0,05=0.35 mol Đặt số mol của NaHSO4 ban đầu là x mol Dd sau phản ứng có Mg2+ : 0,9 mol, Na+ : (x+0,35)mol ; NH4+ : 0,05 mol và SO42- : x mol Bảo toàn điện tích ta có 0,9.2 + x +0,35 + 0,05 = 2x → x=2,2 mol Khối lượng muối trong dd X là mmuối = mMg + mNa + mNH4+mSO4 = 292,35 g Đáp án C Câu hỏi 15 : Hỗn hợp X gồm Mg, Fe, Fe3O4 và CuO, trong đó oxi chiếm 20% khối lượng. Cho a gam hỗn hợp X tan hết vào dung dịch Y gồm H2SO4 1,32M và NaNO3 0,8M, thu được dung dịch Z chứa b gam các chất tan đều là muối trung hòa và 1,792 lít khí NO ( ở đktc). Dung dịch Z phản ứng với dung dịch KOH dư thấy có 68,32 gam KOH phản ứng hết. Biết các phản ứng xảy ra hoàn toàn và 183a = 50b. Gía trị của b gần nhất với giá trị nào sau đây?
Đáp án: A Phương pháp giải: Bảo toàn nguyên tố, bảo toàn điện tích Lời giải chi tiết: Đặt x làm thể tích dung dịch Y và y là số mol NH4+ Quy đổi hỗn hợp thành kim loại ( chiếm 80%) và oxi ( chiếm 20%) Trong X: mKL = 0,8a ; mO = 0,2 a => nH+ = 4nNO +10nNH4+ => 4 . 0,08 +10y + 2 . (0,2a :16) = 2 . 1,32x (1) Bảo toàn N: nNO3− trong Z = 0,8x − 0,08 − y => mmuối= 0,8a + 18y + 23x + 62 . (0,8x − 0,08 - y) + 96 . 1,32x =3,66a(2) → -2,86a - 44y + 199,32 x = 4,96 Khi KOH phản ứng với X thì sản phẩm chứa: 1,22 mol K+; 0,8x mol Na+ ; 1,32x mol SO42-, (0,8x − 0,08 − y) mol NO3- Bảo toàn điện tích: nK++ nNa+ =2nSO4 2- +nNO3− =>1,22 + 0,8x =1,32x . 2 + 0,8x − 0,08 − y(3) Từ đó tính được a =32,78 → b=120 Đáp án A Câu hỏi 16 : Để hòa tan hoàn toàn 19,225 gam hỗn hợp X gồm Mg, Zn cần dùng vừa đủ 800ml dung dịch HNO3 1,5M. Sau khi phản ứng kết thúc thu được dung dịch Y và 2,24 lít (đktc) hỗn hợp khí A gồm N2, N2O, NO, NO2 (trong đó số mol của N2O và NO2 bằng nhau) có tỉ khối đối với H2 là 14,5. Phần trăm về khối lượng của Mg trong X là
Đáp án: C Phương pháp giải: Lời giải chi tiết: nH2O = nNO2 => ghép khí: N2O + NO2 = N2O3 = 3NO => quy A về N2 và NO. Đặt nN2 = x mol; nNO = y mol ⇒ x + y = 0,1 mol và mhh khí = 28x + 30y = 0,1 × 14,5 × 2 => giải ra: x = y = 0,05 mol. Hai kim loại Mg, Zn → chú ý có muối amoni! Ta có: nHNO3 = 10nNH4+ + 12nN2 + 4nNO => nNH4+ = 0,04 mol. Gọi số mol Mg là a và Zn là b => 24a + 65b = 19,225; Lại theo bảo toàn electron: 2a + 2b = 0,04 . 8 + 0,05 . 10 + 0,05 . 3 => giải ra: a = 0,3 mol; b = 0,185 mol => %mMg = [(0,3 . 24 ): 19,225] . 100% = 37,45% Đáp án C Câu hỏi 17 : Cho 7,2 gam bột Mg tan hết trong dung dịch hỗn hợp HCl (dư) và KNO3 thu được dung dịch X chứa m gam muối và 2,688 lít khí Y (đktc) gồm N2 và H2 có khối lượng 0,76 gam. Giá trị của m là:
Đáp án: A Phương pháp giải: Phương pháp: Bảo toàn electron Hướng dẫn giải: nMg = 7,2: 24 = 0,3 (mol); nY = 2,688: 22,4 = 0,12 (mol) Gọi nN2 = x (mol); nH2 = y (mol) Ta có: \(\left\{ {\matrix{{{\rm{x}}{\rm{ + y = 0,12}}} \cr {{\rm{28x + 2y = 0,76}}} \cr} } \right.{\rm{ = > }}\,\,\,\,\left\{{\matrix{{{\rm{x }}\,\,{\rm{ = 0,02 (mol)}}} \cr {{\rm{y = 0,1 (mol)}}} \cr} } \right.\) Ta thấy ne( khí nhận) = 0,02. 10 + 0,1.2 = 0,4 < ne (nhường của Mg) = 0,3. 2= 0,6 => Tạo muối NH4+ nNH4+ = ( 0,3.2 – 0,02.10 – 0,1.2)/8 = 0,025 (mol) m muối = mMgCl2 + m NH4Cl + mKCl = 0,3. 95 + 0,025. 53,5 + ( 0,02.2+ 0,025). 74,5 = 34,68(g) Đáp án A Lời giải chi tiết: Câu hỏi 18 : Cho 9,6 gam hỗn hợp X gồm Mg và Fe3O4 vào 300 ml dung dịch HNO3 2M, thu được dung dịch Y và 0,896 lít (đktc) hỗn hợp N2O và NO có tỉ khối so với hiđro là 16,75. Trung hòa Y cần dùng 40 ml NaOH 1M thu được dung dịch Z, cô cạn Z thu được m gam muối khan. Biết rằng phản ứng xảy ra hoàn toàn và khi cô cạn muối không bị nhiệt phân. Giá trị m là
Đáp án: A Phương pháp giải: 1. Bảo toàn e 2. Bảo toàn điện tích Lời giải chi tiết: + Y chứa HNO3 dư nên Y không chứa Fe2+ \(\left\{ \begin{gathered} + Sơ đồ phản ứng:
\(\begin{gathered} \(\left\{ \begin{gathered} \(\begin{gathered} Đáp án A Câu hỏi 19 : Hòa tan hoàn toàn 4,8 gam kim loại M (biết M chỉ có một hóa trị duy nhất) vào dung dịch axit HNO3 dư, thu được dung dịch A. Chia A thành 2 phần bằng nhau. - Phần 1: cho tác dụng với NaOH dư được kết tủa B. Nung B đến khối lượng không đổi thu được 4,0 gam oxit kim loại. - Phần 2: cô cạn ở điều kiện thích hợp thu được 25,6 gam một muối X duy nhất. Muối X có công thức phân tử là
Đáp án: D Phương pháp giải: Phương pháp : Bảo toàn khối lượng, bảo toàn nguyên tố Lời giải chi tiết:
Lời giải : Gọi hóa trị của kim loại là n (1 ; 2 ; 3), Khối lượng mol là a (g) Gọi số mol muối mỗi phần là x. Ta có số mol kim loại ban đầu là 2x Có : 2ax = 4,8 nên ax = 2,4 (1) Nếu muối tạo thành chỉ là M(NO3)n thì ta có : (a + 62n)x = 25,6 (2) Từ (1) và (2) => x = (25,6 – 2,4)/(62n) = 0,187/n Mặt khác , số mol oxit thu được là x/2 => (2a + 16n).x/2 = 4 (3) Từ (1) và (3) => x = (4 – 2,4)/(16n) = 0,1/n. 2 giá trị x không bằng nhau. Vì vậy muối phải là muối ngậm nước. Đặt công thức muối là M(NO3)n.mH2O Khối lượng muối mỗi phần là (a + 62n + 18m)x = 25,6 (4) Kết hợp (1), (3), (4) ta có hệ sau : ax = 2,4 (2a + 16n).x/2 = 4 (a + 62n + 18m)x = 25,6 => nx = 0,2 ; mx = 0,6 => a/n = 12. Thay n = 1, 2, 3 ta được a = 24g => Mg Thay n = 2 => x = 0,1 ; do đó m = 6 Vậy M là Mg và muối là Mg(NO3)2.6H2O Đáp án D
Câu hỏi 20 : Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng, thu được 5,376 lít(đktc) hỗn hợp khí X gồm N2, N2O và dung dịch chứa 8m gam muối. Tỉ khối của X so với H2 bằng 18. Giá trị của m là:
Đáp án: B Phương pháp giải: Tìm số mol từng khí N2; N2O dựa vào quy tắc đường chéo Giả sử trong dung dịch thu được chứa muối NH4NO3 Đặt mol Al = a (mol) ; nNH4NO3 = b (mol) Ta có hệ phương trình sau: \(\begin{array}{l}\left\{ \begin{array}{l}BT:e \to 3{n_{Al}} = 10{n_{{N_2}}} + 8{n_{{N_2}O}} + 8{n_{N{H_4}N{O_3}}}\\\frac{{{m_{Al}}}}{{{m_{Al(NO3)3}} + {m_{N{H_4}N{O_3}}}}} = \frac{m}{{8m}} = \frac{1}{8}\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}3a - 8b = 2,16\\3a - 80b = 0\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = ?\\b = ?\end{array} \right.\end{array}\) => m = mAl = 27a = ? (g) Lời giải chi tiết: nhh X = 5,376 :22,4 = 0,24 (mol) MX = 18.2 = 36 (g/mol)
\( \Rightarrow \frac{{{n_{{N_2}}}}}{{{n_{{N_2}O}}}} = \frac{8}{8} = \frac{1}{1} = \frac{{0,12}}{{0,12}}\) Gọi nAl = a (mol) Giả sử trong dd có chứa muối NH4NO3: b (mol) \(\begin{array}{l}\left\{ \begin{array}{l}BT:e \to 3{n_{Al}} = 10{n_{{N_2}}} + 8{n_{{N_2}O}} + 8{n_{N{H_4}N{O_3}}}\\\frac{{{m_{Al}}}}{{{m_{Al(NO3)3}} + {m_{N{H_4}N{O_3}}}}} = \frac{m}{{8m}} = \frac{1}{8}\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}3a = 10.0,12 + 8.0,12 + 8b\\\frac{{27a}}{{213a + 80b}} = \frac{1}{8}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}3a - 8b = 2,16\\3a - 80b = 0\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,8\\b = 0,03\end{array} \right.\end{array}\) nAl = 0,8 (mol) => mAl = 0,8.27 = 21,6 (g) Vậy giá trị của m = 21,6 gam Đáp án B
|