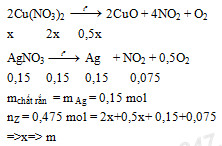30 bài tập vận dụng về muối nitrat có lời giải (phần 2)Làm bàiCâu hỏi 1 : Nhiệt phân hoàn toàn 17 gam muối nitrat kim loại M thu được 10,8 gam kim loại M. Kim loại đó là
Đáp án: B Phương pháp giải: Phương pháp: M(NO3)n -> M + nNO2+ n/2 O2 Mmuối=M+62n= => M Lời giải chi tiết:
Hướng dẫn giải M(NO3)n -> M + nNO2+ n/2 O2 Mmuối=M+62n= => M=108, n=1 (Ag) => chọn B Đáp án B Câu hỏi 2 : Tiến hành nung 6,06g muối nitrat của một kim loại kiềm thu được 5,1g muối nitrit .Hỏi muối nitrat của kim loại đem phân hủy là gì ?
Đáp án: B Phương pháp giải: moxi = mchất rắn giảm = 6,06-5,1= 0,96 g => noxi MNO3 →MNO2 + 0,5O2 => M Lời giải chi tiết: moxi = mchất rắn giảm = 6,06-5,1= 0,96 g => noxi= 0,03 mol MNO3 →MNO2 + 0,5O2 0,06 0,03 => M+ 62 = 6,06:0,06= 101 => M= 39 (K) Đáp án B Câu hỏi 3 : Nung 63,9 gam Al(NO3)3 một thời gian để nguội cân lại được 31,5 gam chất rắn. Hiệu suất của phản ứng là:
Đáp án: A Phương pháp giải: PTHH: 4Al(NO3)3 \(\overset{t^{o}}{\rightarrow}\) 2Al2O3 + 12NO2 + 3O2 4x 2x 12x 3x mol Khối lượng chất rắn giảm là khối lượng của khí thoát ra → Phương trình khối lượng của khí → x → Hiệu suất H = \(\frac{{{m_{phan\,ung}}}}{{{m_{ban\,dau}}}}.100\% \) Lời giải chi tiết: PTHH: 4Al(NO3)3 \(\overset{t^{o}}{\rightarrow}\) 2Al2O3 + 12NO2 + 3O2 4x 2x 12x 3x mol Ta có: mrắn giảm = mkhí thoát ra = mNO2 + mO2 = 12x.46 + 3x.32 = 63,9 - 31,5 = 32,4 gam → x = 0,05 mol Hiệu suất của phản ứng là H = \(\frac{{{m_{phan\,ung}}}}{{{m_{ban\,dau}}}}.100\% = \frac{{0,05.4.213}}{{63,9}}.100\% = 66,67\% \) Đáp án A Câu hỏi 4 : Nung 18,8 gam muối Cu(NO3)2 một thời gian, thu được 12,32 gam hỗn hợp rắn X. Hiệu suất phản ứng nhiệt phân là:
Đáp án: B Phương pháp giải: khối lượng chất rắn giảm là khối lượng của khí thoát ra => m chất rắn giảm = mNO2 + mO2 Tính toán theo PTHH: Cu(NO3)2 → CuO + 2NO2↑ + 0,5 O2↑ Lời giải chi tiết: nCu(NO3)2 bđ = 0,1 mol Đặt nCu(NO3)2 nhiệt phân = x mol PTHH: Cu(NO3)2 → CuO + 2NO2↑ + 0,5 O2↑ x → x → 2x → 0,5x (mol) Ta thấy khối lượng chất rắn giảm là khối lượng của khí thoát ra => m chất rắn giảm = mNO2 + mO2 => 46.2x + 32.0,5x = 18,8 - 12,32 => x = 0,06 mol => Hiệu suất quá trình nhiệt phân là: H% = 0,06/0,1 = 0,6 = 60% Đáp án B Câu hỏi 5 : Nung nóng hoàn toàn 27,3 g hổn hợp NaNO3, Cu(NO3)2. Hổn hợp khí thoát ra được dẫn vào nước dư thấy có 1,12 l khí (ở đktc) không bị hấp thụ, khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Đáp án: A Phương pháp giải: Lời giải chi tiết: Gọi số mol của NaNO3, Cu(NO3)2 lần lượt là x và y NaNO3 → NaNO2 + ½ O2 a → 0,5a Cu(NO3)2→ CuO + 2NO2 + ½ O2 b → 2b → 0,5b Hỗn hợp khí gồm nNO2=2b mol , nO2 = 0,5(a+b) Hấp thụ hỗn hợp khí vào nước 4NO2 + O2 + 2H2O → 4HNO3 Bđ: 2b 0,5(a+b) Pư: 2b --> 0,5b => nO2 dư = 0,5(a +b) - 0,5b = 0,5a = 0,05 mol => a = 0,1 mol => mCu(NO3)2 = (27,3 – 85 . 0,1) = 18,8 g Đáp án A Câu hỏi 6 : Nhiệt phân hoàn toàn hỗn hợp X gồm: Mg(NO3)2 và NaNO3, sau phản ứng thu được hỗn hợp khí Y. Dẫn hỗn hợp khí Y vào nước, thu được 1 lít dung dịch có pH = 1 và có 2,24 lít khí không màu thoát ra. Phần trăm khối lượng của NaNO3 trong hỗn hợp X là:
Đáp án: A Phương pháp giải: Tính toán theo PTHH: Mg(NO3)2 \(\xrightarrow{{{t^o}}}\) MgO + 2NO2 + 0,5 O2 NaNO3 \(\xrightarrow{{{t^o}}}\) NaNO2 + 0,5O2 2NO2 + 0,5O2 + H2O → 2HNO3 Lời giải chi tiết: Đặt nMg(NO3)2 = x và nNaNO3 = y (mol) PTHH: Mg(NO3)2 \(\xrightarrow{{{t^o}}}\) MgO + 2NO2 + 0,5 O2 x → x → 2x → 0,5x (mol) NaNO3 \(\xrightarrow{{{t^o}}}\) NaNO2 + 0,5O2 y → y → 0,5y (mol) Hỗn hợp khí Y gồm: NO2 (2x mol) và O2 (0,5x + 0,5y mol) Dẫn Y vào H2O dư: 2NO2 + 0,5O2 + H2O → 2HNO3 2x → 0,5x dư 0,5y → 2x (mol) Khí thoát ra là O2 dư => 0,5y = 0,1 => y = 0,2 Dung dịch thu được có pH = 1 => [H+] = 0,1M => nH+ = nHNO3 = 2x = 0,1 mol => x = 0,05 mol => %mNaNO3 = 0,2.85/(0,05.148 + 0,2.85) = 69,67% Đáp án A Câu hỏi 7 : Nung 67,2 gam hỗn hợp Fe(NO3)3, Cu(NO3)2 sau phản ứng thu được 4,48 lít khí oxi (đktc). Chất rắn sau khi nung có khối lượng là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án: C
$$\eqalign{ & 4Fe{(N{O_3}{\rm{)}}_3}{\rm{ }}\buildrel {{t^0}} \over \longrightarrow {\rm{ 2F}}{{\rm{e}}_2}{{\rm{O}}_3}{\rm{ + 12N}}{{\rm{O}}_2} + {\rm{ 3}}{O_2} \uparrow \cr & 2Cu{(N{O_3}{\rm{)}}_2}{\rm{ }}\buildrel {{t^0}} \over \longrightarrow {\rm{ 2CuO + 4}}N{O_2} \uparrow {\rm{ }} + {\rm{ }}{O_2} \uparrow \cr & {n_{{O_2}}} = {\rm{ }}0,2{\rm{ }} = > {\rm{ }}{n_{N{O_2}}} = {\rm{ }}4{n_{{O_2}}} = {\rm{ }}0,8 \cr & = > {m_{r\raise.5ex\hbox{$\scriptstyle 3$}\kern-.1em/ \kern-.15em\lower.25ex\hbox{$\scriptstyle 3$} n}} = {\rm{ }}67,2{\rm{ }} - {\rm{ }}0,2.32{\rm{ }} - {\rm{ }}0,8.46{\rm{ }} = {\rm{ }}24{\rm{ }}(g) \cr} $$ Câu hỏi 8 : Nhiệt phân hết 9,4 gam một muối nitrat kim loại X thu được 4 gam chất rắn. Xác định muối nitrat?
Đáp án: A Phương pháp giải: Lời giải chi tiết: Đáp án: A CT muối X(NO3)n chia trường hợp sản phẩm của pư nhiệt phân
$$\eqalign{ & 4X{(N{O_3}{\rm{)}}_n}{\rm{ }}\buildrel {{t^0}} \over \longrightarrow {\rm{ 2X}}{}_2{{\rm{O}}_n}{\rm{ + 4n}}N{O_2} \uparrow {\rm{ }} + {\rm{ n}}{O_2} \uparrow \cr & {m_{gi\Pm}} = 9,4 - 4 = 5,4(g) = > 32x + 4x.46 = 5,4 = > x = 0,025 = {n_{{O_2}}} \cr & = > {\rm{ }}{{\rm{M}}_{X{{(N{O_3})}_n}{\rm{ }}}} = {\rm{ }}{{9,4} \over {{{4.0,025} \over n}}}{\rm{ }} = {\rm{ }}94n \cr & n = 2 = > X = 64 = > Cu{(N{O_3})_2} \cr} $$ 2 trường hợp còn tạo muối nitrit và kim loại => loại Câu hỏi 9 : Nhiệt phân hoàn toàn 4,7 gam muối nitrat của kim loại M thu được 2 gam chất rắn. Công thức của muối là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án: C CT muối X(NO3)n chia trường hợp sản phẩm của pư nhiệt phân
$$\eqalign{ & 4X{(N{O_3}{\rm{)}}_n}{\rm{ }}\buildrel {{t^0}} \over \longrightarrow {\rm{ 2X}}{}_2{{\rm{O}}_n}{\rm{ + 4n}}N{O_2} \uparrow {\rm{ }} + {\rm{ n}}{O_2} \uparrow \cr & {m_{gi\Pm}} = 4,7 - 2 = 2,7(g) = > 32x + 4x.46 = 2,7 = > x = 0,0125 = {n_{{O_2}}} \cr & = > {\rm{ }}{{\rm{M}}_{X{{(N{O_3})}_n}{\rm{ }}}} = {\rm{ }}{{9,4} \over {{{4.0,0025} \over n}}}{\rm{ }} = {\rm{ }}94n \cr & n = 2 = > X = 64 = > Cu{(N{O_3})_2} = > Ch\"a n{\rm{ C}} \cr} $$ 2 trường hợp còn tạo muối nitrit và kim loại => loại Câu hỏi 10 : Nhiệt phân hoàn toàn m gam hỗn hợp các muối nitrat : Fe(NO3)2 ; Pb(NO3)2; Cu(NO3)2; Al(NO3)3 thu được 8 gam oxit kim loại và 5,04 lít hỗn hợp khí X (NO2 và O2) có tỉ khối so với không khí là 1,2. Gía trị của m là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án: C
$$\eqalign{ & {n_X} = {\rm{ }}5,04:22,4 = {\rm{ }}0,225{\rm{ }}(mol){\rm{ }};{\rm{ }}{\overline M _X}{\rm{ }} = {\rm{ }}1,2.29{\rm{ }} = {\rm{ }}34,8 \cr & = > {m_X} = {\rm{ }}0,225.34,8{\rm{ }} = {\rm{ }}7,83{\rm{ }}(g) \cr & = > m = {\rm{ }}8 + 7,83 = {\rm{ }}15,83{\rm{ }}(g) \cr} $$ Câu hỏi 11 : Nhiệt phân hoàn toàn 27,3 gam hỗn hợp rắn X gồm NaNO3 và Cu(NO3)2 thu được hỗn hợp khí có thể tích là 6,72 lít (đktc). Phần trăm về khối lượng của mỗi muối có trong hỗn hợp X lần lượt là:
Đáp án: B Phương pháp giải: Lời giải chi tiết: Đáp án: B Gọi nNaNO3 = x (mol) ; nCu(NO3)2 = y (mol) \(\eqalign{& = > \left\{ {\matrix{{85x + 188y{\rm{ }} = {\rm{ }}27,3} \cr {0,5x + (0,5y + 2y){\rm{ }} = {\rm{ }}0,3} \cr } } \right. = > \left\{ {\matrix{{x{\rm{ }} = {\rm{ }}0,1} \cr {y{\rm{ }} = {\rm{ }}0,1} \cr} } \right. \cr & = > \% {m_{NaN{O_3}}}{\rm{ }} = {\rm{ }}(0,1.85):27,3.100\% {\rm{ }} = {\rm{ }}31,14\% ;{\rm{ }}\% {m_{Cu{{(N{O_3})}_2}}}{\rm{ }} = {\rm{ }}68,86\% \cr} \)
Câu hỏi 12 : Nhiệt phân hoàn toàn 34,65 gam hỗn hợp gồm KNO3, Cu(NO3)2 thu được hỗn hợp khí X có tỉ khối của X so với H2 bằng 18,8. Khối lượng muối Cu(NO3)2 có trong hỗn hợp ban đầu là:
Đáp án: C Phương pháp giải: Lời giải chi tiết: Đáp án: C Gọi nKNO3 = x (mol) ; nCu(NO3)2 = y (mol) \(\eqalign{ & = > \left\{ {\matrix{{101x + 188y{\rm{ }} = {\rm{ 34}}{\rm{,65}}} \cr {{{32.0,5x + (32.0,5y + 46.2y)} \over {0,5x + 0,5y + 2y}}{\rm{ }} = {\rm{ 18}}{\rm{,8}}{\rm{.2}}} \cr } } \right. = > \left\{ {\matrix{{x{\rm{ }} = {\rm{ }}0,25} \cr {y{\rm{ }} = {\rm{ }}0,05} \cr } } \right. \cr & = > \% {m_{Cu{{(N{O_3})}_2}}}{\rm{ }} = {\rm{ }}(0,05.188):34,65.100\% {\rm{ }} = 27,13\% {\rm{ }} \cr}\) Câu hỏi 13 : Nhiệt phân hoàn toàn hỗn hợp X gồm a mol KNO3 và b mol Fe(NO3)2 trong bình chân không thu được chất rắn Y và hỗn hợp khí Z. Cho toàn bộ Z vào nước thì thu được dung dịch HNO3 và không có khí thoát ra. Biểu thức liên hệ giữa a và b là
Đáp án: B Phương pháp giải: Lời giải chi tiết: KNO3 → KNO2 + ½ O2 a → 0,5a 2Fe(NO3)2 → Fe2O3 + 4NO2 + ½ O2 b → 2b → 0,25b 2NO2 + ½ O2 + H2O → 2HNO3 2b (0,5a + 0,25b) => 2b = 4(0,5a + 0,25b) => b = 2a Đáp án B Câu hỏi 14 : Nhiệt phân hoàn toàn 35,8 gam hỗn hợp gồm NaNO3 và Cu(NO3)2 thu được hỗn hợp khí X có tỉ khối so với H2 bằng 20. Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
Đáp án: A Phương pháp giải: Phương pháp: MX = 20.2=40 NaNO3 -> NaNO2 + 1/2 O2 x 0,5x Cu(NO3)2 -> CuO + 2NO2 + 1/2 O2 y 2y 0,5y mhh = MX = => x,y => Lời giải chi tiết:
Hướng dẫn giải
MX = 20.2=40 NaNO3 -> NaNO2 + 1/2 O2 x 0,5x Cu(NO3)2 -> CuO + 2NO2 + 1/2 O2 y 2y 0,5y mhh = = 85x+188y =35,8 MX = => 8y-4x=0 =>x= 0,2 y =0,1 => => chọn A Đáp án A Câu hỏi 15 : Nung nóng 37,6 gam hỗn hợp Cu(NO3)2 trong bình kín một thời gian thu được 26,8 gam chất rắn X và hỗn hợp khí Y. Hấp thụ Y vào nước thu được 1 lít dung dịch Z. pH của dung dich Z là
Đáp án: A Phương pháp giải: Phương pháp: Cu(NO3)2 -> CuO + 2NO2 + 1/2 O2 4x x Áp dụng ĐLBTKL mmuối= mchất rắn + mNO2 + mO2 => x 2NO2 +0,5O2 + H2O -> 2HNO3 HNO3 -> H+ + NO3- Lời giải chi tiết:
Hướng dẫn giải Cu(NO3)2 -> CuO + 2NO2 + 1/2 O2 4x x Áp dụng ĐLBTKL mmuối= mchất rắn + mNO2 + mO2 37,6 = 26,8 +46.4x+32.x => x=0,05 2NO2 +0,5O2 + H2O -> 2HNO3 0,2 ....................................0,2 HNO3 -> H+ + NO3- 0,2......................0,2 => chọn A Đáp án A Câu hỏi 16 : Nung hoàn toàn m gam Cu(NO3)2 thu được hỗn hợp khí NO2 và O2. Hấp thụ hoàn toàn lượng khí đó bằng nước thu được 2 lít dung dịch có pH = 1,0. Tính m.
Đáp án: D Phương pháp giải: Phương pháp: => nH+ 2NO2 +0,5O2 + H2O -> 2HNO3 Cu(NO3)2 -> CuO + 2NO2 + 1/2 O2 => m Lời giải chi tiết:
Hướng dẫn giải => nH+ = 0,2 mol 2NO2 +0,5O2 + H2O -> 2HNO3 0,2 ....................................0,2 Cu(NO3)2 -> CuO + 2NO2 + 1/2 O2 0,1 0,2 => m= 188.0,1=18,8 gam => chọn D Đáp án D Câu hỏi 17 : Nhiệt phân hoàn toàn 1,88g một muối nitrat của kim loại hoá trị II thấy thoát ra 0,56 lít hỗn hợp khí (đktc).Biết kim loại nằm trong khoảng từ sau Mg đến Cu. Công thức của muối là:
Đáp án: D Phương pháp giải: Phương pháp: Thu được hỗn hợp khí, kim loại nằm trong khoảng từ sau Mg đến Cu=> nhiệt phân muối thu được oxít kim loại M(NO3)2 -> MO + 2NO2+0,5O2 x.................................2x........0,5x nkhí = 2x+0,5x=2,5x => x => M Lời giải chi tiết:
Hướng dẫn giải nkhí = 0,56:22,4=0,025 mol Thu được hỗn hợp khí, kim loại nằm trong khoảng từ sau Mg đến Cu=> nhiệt phân muối thu được oxít kim loại M(NO3)2 -> MO + 2NO2+0,5O2 x.................................2x........0,5x nkhí = 2x+0,5x=2,5x= 0,025 => x=0,01 => Mmuối = M+ 62.2= 1,88:0,01=188 => M= 64 (Cu) => chọn D Đáp án D Câu hỏi 18 : Hỗn hợp X gồm Fe(NO3)3, Cu(NO3)2, Mg(NO3)2. Thành phần % khối lượng hỗn hợp của nitơ trong X là 11,864%. Có thể điều chế được tối đa bao nhiêu gam hỗn hợp ba kim loại từ 14,16 gam X?
Đáp án: B Phương pháp giải: Lời giải chi tiết: Coi hỗn hợp X gồm hỗn hợp kim loại M và gốc NO3
\(\begin{gathered} => nNO3 = nN = 0,12 (mol) => m hh M = mX – mNO3 = 14,16 – 0,12. 62 = 6,72 (g) Đáp án B Câu hỏi 19 : Nhiệt phân hoàn toàn m gam muối Cu(NO3)2 thu được chất rắn có khối lượng bằng (m-21,6) gam. Giá trị của m là
Đáp án: A Phương pháp giải: Phương pháp: Cu(NO3)2 -> CuO + 2NO2 + 1/2 O2 x 2x 0,5x mgiảm = m-(m-21,6)=21,6= mNO2 + mO2=> x => m Lời giải chi tiết:
Hướng dẫn giải Cu(NO3)2 -> CuO + 2NO2 + 1/2 O2 x 2x 0,5x mgiảm = m-(m-21,6)=21,6= 46.2x+32.0,5x => x=0,2 => m= 188.0,2 = 37,6 gam => chọn A Đáp án A Câu hỏi 20 : Nhiệt phân hoàn toàn hỗn hợp X gồm NaNO3; Al(NO3)3; Cu(NO3)2 thu được 10 gam chất rắn Y và hỗn hợp khí Z. Hấp thụ khí Z vào 112,5 gam H2O được dung dịch axit có nồng độ 12,5% và có 0,56 lít một khí duy nhất thoát ra (đktc). % khối lượng của NaNO3 trong hỗn hợp X là
Đáp án: A Phương pháp giải: BTKL: mX=mY+mNO2+mO2 Lời giải chi tiết: Nhiệt phân: NaNO3→NaNO2+0,5O2(1) 0,05 ← 0,025 2Al(NO3)3→Al2O3+6NO2+1,5O2(2) Cu(NO3)2→CuO+2NO2+0,5O2(3) 2NO2+0,5O2+H2O→2HNO3 x → 0,25x → x nO2 dư=0,56/22,4=0,025=nO2(1) C%HNO3=63x/(46x+0,25x.32+112,5)=0,125=> x=0,25 mol => nNO2=0,25 mol; nO2=nO2(2)+nO2(3)+nO2(1)=0,25x+0,025=0,0875 mol BTKL: mX=mY+mNO2+mO2=10+0,25.46+0,0875.32=24,3 gam %mNaNO3=0,05.85/24,3=17,49% Đáp án A Câu hỏi 21 : Nung nóng m gam Cu(NO3)2 sau 1 thời gian dừng lại, làm nguội rồi cân thấy khối lượng giảm đi 0,54 gam. Khối lượng Cu(NO3)2 đã bị nhiệt phân là
Đáp án: C Phương pháp giải: Viết PTHH. Khối lượng chất rắn giảm chính là khối lượng của NO2 và O2 Lời giải chi tiết: \(\begin{gathered} Đáp án C Câu hỏi 22 : A là hỗn hợp muối Cu(NO3)2, Fe(NO3)3, Fe(NO3)2, Al(NO3)3. Trong đó N chiếm 16,03% về khối lượng. Cho dung dịch KOH dư vào dung dịch chứa 65,5 gam muối A. Lọc kết tủa đem nung trong không khí đến khối lượng không đổi thu được bao nhiêu gam oxit?
Đáp án: C Phương pháp giải: Từ % khối lượng N ta tính được số mol N trong A. Dùng bảo toàn khối lượng ta tính được mkim loại = mA – mNO3- Dùng bảo toàn điện tích ta có nNO3-= nđiện tích dương kim loại = 2.nO2- trong oxit → moxit = mkim loại + mO2- trong oxit Lời giải chi tiết: Khối lượng N có trong 65,5 gam hỗn hợp muối A là: mN = \(\frac{{65,5.16,03}}{{100}}\) = 10,5 gam → nN = 0,75 mol Bảo toàn nguyên tố N ta có: nNO3- (muối) = nN = 0,75 mol → mkim loại = mA - mNO3- = 65,5 - 0,75.62 = 19 gam Bảo toàn điện tích ta có: nNO3-= nđiện tích dương kim loại = 2.nO2- trong oxit → nO2- trong oxit = 0,75/2 = 0,375 mol → moxit = mkim loại + mO2- trong oxit = 19 + 0,375.16 = 25 gam Đáp án C Câu hỏi 23 : Nhiệt phân hoàn toàn 34,65 gam hỗn hợp gồm KNO3 và Cu(NO3)2 thu được hỗn hợp khí X (tỉ khối hơi của X so với khí H2 bằng 18,8). Tính khối lượng Cu(NO3)2 trong hỗn hợp ban đầu?
Đáp án: D Phương pháp giải: Cu(NO3)2 → CuO + 2NO2 + ½ O2 KNO3 → KNO2 + ½ O2 Gọi số mol Cu(NO3)2 và KNO3 lần lượt là x, y mol Lập hệ phương trình về khối lượng hỗn hợp và khối lượng mol trung bình của X để tìm số mol Cu(NO3)2. Từ đó tính được khối lượng Cu(NO3)2 trong hỗn hợp ban đầu. Lời giải chi tiết: Đặt số mol Cu(NO3)2 và KNO3 lần lượt là x, y mol → 188 x + 101y = 34,65 (1) Nhiện phân hỗn hợp: Cu(NO3)2 → CuO + 2NO2 + ½ O2 x 2x 0,5x mol KNO3 → KNO2 + ½ O2 y 0,5y mol Hỗn hợp khí X thu được gồm 2x mol NO2 và x/2+ y/2 mol O2 Ta có:\({\overline M _X} = \frac{{{m_{hh}}}}{{{n_{hh}}}} = \frac{{46.2x + 32.(0,5x + 0,5y)}}{{2x + 0,5x + 0,5y}} = 18,8.2\) suy ra 14x = 2,8y (2) Từ (1) và (2) ta có x = 0,05; y = 0,25 → mCu(NO3)2 = 9,4 gam Đáp án D Câu hỏi 24 : Nhiệt phân hoàn toàn m gam Cu(NO3)2 thu được tổng thể tích khí là 5,376 lít (ở điều kiện tiêu chuẩn). Giá trị của m là
Đáp án: A Phương pháp giải: Tính theo PTHH: 2Cu(NO3)2 Lời giải chi tiết: Ta có: nkhí = 0,24 mol PTHH: 2Cu(NO3)2 x 2x 0,5x → nkhí = nNO2 + nO2 → 2x + 0,5x = 0,24 → x = 0,096 mol → mCu(NO3)2 = 188.0,096 = 18,048 gam Đáp án A Câu hỏi 25 : X là hỗn hợp các muối Cu(NO3)2, Fe(NO3)2, Fe(NO3)3, Mg(NO3)2 trong đó O chiếm 55,68% về khối lượng. Cho dung dịch KOH dư vào dung dịch chứa 75 gam muối X, sau khi các phản ứng xảy ra hoàn toàn, lọc kết tủa thu được đem nung trong điều kiện không có không khí đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là
Đáp án: A Phương pháp giải: Từ khối lượng hh X và phần trăm khối lượng O trong X → nO (X) nNO3- = 1/3nO(X) → mNO3- → mKL = mX - mNO3- Cu(NO3)2 → Cu(OH)2 → CuO 2Fe(NO3)3 → 2Fe(OH)3 → Fe2O3 Fe(NO3)2 → Fe(OH)2 → FeO Mg(NO3)2 → Mg(OH)2 → MgO Nhận xét: nO trong oxit = 1/6nO(X) = ? → moxit = mKL + mO trong oxit Lời giải chi tiết: Ta có: mO(X) = 75 . \(\frac{{55,68\% }}{{100\% }}\) = 41,76 gam nên nO(X) = 2,61 mol nNO3- = 1/3nO = 0,87 mol → mNO3- = 0,87. 62 = 53,94 g → mKL = mX - mNO3- = 75 - 53,94 = 21,06 gam Cu(NO3)2 → Cu(OH)2 → CuO 2Fe(NO3)3 → 2Fe(OH)3 → Fe2O3 Fe(NO3)2 → Fe(OH)2 → FeO Mg(NO3)2 → Mg(OH)2 → MgO Nhận xét: nO trong oxit = 1/6nO(X) = 2,61/6 = 0,435 mol → moxit = mKL + mO trong oxit = 21,06 + 0,435.16 = 28,02 gam Đáp án A Câu hỏi 26 : Nhiệt phân 100 gam Cu(NO3)2 được chất rắn và hỗn hợp khí Y. Dẫn toàn bộ Y vào một lượng dư H2O, thu được dung dịch Z. Cho lượng Cu dư vào Z, đun nóng, thu được dung dịch T và thoát ra khí NO (sản phẩm khử duy nhất). Cô cạn T thu được m gam muối khan. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
Đáp án: C Phương pháp giải: Viết PTHH và tính toán theo phương trình hóa học. Lời giải chi tiết: \(\begin{gathered} Đáp án C Câu hỏi 27 : Nung m gam hỗn hợp X gồm Cu(NO3)2 và AgNO3 trong bình kín không chứa không khí, sau phản ứng hoàn toàn thu được chất rắn Y và 10,64 lit hỗn hợp khí Z (đktc). Cho Y tác dụng với dung dịch HCl dư, kết thúc phản ứng còn lại 16,2 gam chất rắn không tan. Giá trị của m là
Đáp án: A Phương pháp giải:
Lời giải chi tiết:
Câu hỏi 28 : Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thu hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng.
Đáp án: D Phương pháp giải: Lời giải chi tiết: Đáp án: D Tỉ lệ NO2 : O2 = 4: 1 sinh ra trong phản ứng nhiệt phân, cũng là tỉ lệ 4:1 khi hấp thụ vào nước. Khối lượng giảm là tổng khối lượng của NO2 và O2 => 32x+ 4x.46 = 6,58 -4,96 => x =7,5. 10−3 = nO2
$$4N{O_2}{\rm{ }} + {\rm{ }}{O_2}{\rm{ }} + {\rm{ }}2{H_2}O{\rm{ }}\buildrel {} \over \longrightarrow {\rm{ }}4HN{O_3}$$ NHNO3 = nNO2 =0,03 (mol) => [HNO3] = 0,03 :0,3=0,1 => PH = - log(0,1) = 1 Câu hỏi 29 : X là hỗn hợp các muối Cu(NO3)2, Zn(NO3)2, Mg(NO3)2 trong đó O chiếm 55,68% về khối lượng. Cho dung dịch KOH dư vào dung dịch chứa 50 gam muối X, thu được kết tủa Y. Nung Y đến khối lượng không đổi, thu được m gam oxit. Giá trị của m là
Đáp án: B Phương pháp giải: Tính được số mol của O =? => nNO3 = 1/3 nO = ? => mKL = mX – mNO3 = ? => mOXIT < mCuO + mZnO + mMgO = mM + mO Lời giải chi tiết: Gọi công thức chung của các muối là M(NO3)2 nO = 50.0,5568 / 16 = 1,74 (mol) => nNO3 = 1/3 nO = 0,58 (mol) => mKL = mX – mNO3 = 50 – 0,58.62 = 14,04 (g) Cu(NO3)2, Zn(NO3)2, Mg(NO3)2 cho qua KOH dư thì kết tủa thu được là Cu(OH)2 và Mg(OH)2 ( Do Zn(OH)2 tan trong KOH dư) => mOXIT = mMgO + mCuO => mOXIT < mCuO + mZnO + mMgO = mM + mO => mOXIT < 14,04 + 0,29.16 ( nO = ½ nNO3) => mOXIT < 18,68 Chỉ có đáp án B. 12,88 là phù hợp Đáp án B Câu hỏi 30 : Nhiệt phân hoàn toàn 9,4 gam một muối nitrat kim loại thu được 4 gam một chất rắn. Công thức muối đã dùng là
Đáp án: A Phương pháp giải: Quan sát đáp án ta thấy 2 trường hợp sau: TH1: MNO3 → MNO2 TH2: 2M(NO3)n → M2On Lời giải chi tiết: Quan sát đáp án ta thấy 2 trường hợp sau: TH1: MNO3 → MNO2 M + 62 → M + 46 (gam) 9,4 4 (gam) => 4(M + 62) = 9,4.(M + 46) => M = -34,14 (loại) TH2: 2M(NO3)n → M2On 2(M+62n) 2M+16n 9,4 4 => 8(M+62n) = 9,4.(2M+16n) => M = 32n Ta thấy: n = 2 => M = 64 (Cu) => Muối đã dùng là Cu(NO3)2 Đáp án A
|













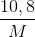
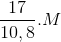 => M=108n
=> M=108n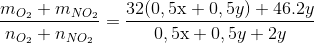 =40
=40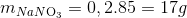
![pH = - \log \left[ {{H^ + }} \right] = 0,699](https://images.tuyensinh247.com/picture/learning/exam/2018/0202/v224458_988605_1.gif)
![pH = - \log \left[ {{H^ + }} \right] = 1 \to \left[ {{H^ + }} \right] = 0,1](https://images.tuyensinh247.com/picture/learning/exam/2018/0202/v224459_885622_1.gif)
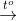 2CuO + 4NO2 + O2
2CuO + 4NO2 + O2