20 bài tập vận dụng cao về axit nitric - muối nitrat có lời giải (phần 2)Làm bàiCâu hỏi 1 : Hòa tan hoàn toàn m gam Al bằng dung dịch HNO3 loãng, thu được 5,376 lít(đktc) hỗn hợp khí X gồm N2, N2O và dung dịch chứa 8m gam muối. Tỉ khối của X so với H2 bằng 18. Giá trị của m là:
Đáp án: B Phương pháp giải: Tìm số mol từng khí N2; N2O dựa vào quy tắc đường chéo Giả sử trong dung dịch thu được chứa muối NH4NO3 Đặt mol Al = a (mol) ; nNH4NO3 = b (mol) Ta có hệ phương trình sau: \(\begin{array}{l}\left\{ \begin{array}{l}BT:e \to 3{n_{Al}} = 10{n_{{N_2}}} + 8{n_{{N_2}O}} + 8{n_{N{H_4}N{O_3}}}\\\frac{{{m_{Al}}}}{{{m_{Al(NO3)3}} + {m_{N{H_4}N{O_3}}}}} = \frac{m}{{8m}} = \frac{1}{8}\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}3a - 8b = 2,16\\3a - 80b = 0\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = ?\\b = ?\end{array} \right.\end{array}\) => m = mAl = 27a = ? (g) Lời giải chi tiết: nhh X = 5,376 :22,4 = 0,24 (mol) MX = 18.2 = 36 (g/mol)
\( \Rightarrow \frac{{{n_{{N_2}}}}}{{{n_{{N_2}O}}}} = \frac{8}{8} = \frac{1}{1} = \frac{{0,12}}{{0,12}}\) Gọi nAl = a (mol) Giả sử trong dd có chứa muối NH4NO3: b (mol) \(\begin{array}{l}\left\{ \begin{array}{l}BT:e \to 3{n_{Al}} = 10{n_{{N_2}}} + 8{n_{{N_2}O}} + 8{n_{N{H_4}N{O_3}}}\\\frac{{{m_{Al}}}}{{{m_{Al(NO3)3}} + {m_{N{H_4}N{O_3}}}}} = \frac{m}{{8m}} = \frac{1}{8}\end{array} \right.\\ \Rightarrow \left\{ \begin{array}{l}3a = 10.0,12 + 8.0,12 + 8b\\\frac{{27a}}{{213a + 80b}} = \frac{1}{8}\end{array} \right. \Rightarrow \left\{ \begin{array}{l}3a - 8b = 2,16\\3a - 80b = 0\end{array} \right. \Rightarrow \left\{ \begin{array}{l}a = 0,8\\b = 0,03\end{array} \right.\end{array}\) nAl = 0,8 (mol) => mAl = 0,8.27 = 21,6 (g) Vậy giá trị của m = 21,6 gam Đáp án B Câu hỏi 2 : Cho 9,6 g hỗn hợp X gồm Mg và Fe3O4 vào 300ml dung dịch HNO32 M thu được dd Y và 0,896 lít (đktc) khí gồm N2O và NO có tí khối so với H2 là 16,75. Trung hòa dd Y cần dùng 40 ml dung dịch NaOH 1M thu được dd A. Khối lượng chất tan trong dd A là
Đáp án: A Phương pháp giải: Quy tắc đường chéo Bảo toàn e Bảo toàn khối lượng Lời giải chi tiết: Theo quy tắc đường chéo tính đươc N2O :0,01 mol và NO : 0,03 mol Đặt nMg =x và nFe3O4= y mol. Số mol NH4NO3 là a mol Ta có mX = 24x + 232y =9,6 Bảo toàn e : 2x + y = 0,01.8 + 0,03.3 + 8a nHNO3(dư) =0,04 mol. Bảo toàn N ta có 2x + 3.3y +2a + 0,01.2 + 0,03 + 0,04= 0,6 Giải được x =0,11 ; y =0,03 ; a=0,01 Ta có mmuối=0,11 .148 + 0,03.3.242 + 0,01.80 +0,04.85 =42,26g Đáp án A Câu hỏi 3 : Cho 5,6g hỗn hợp X gồm Mg, MgO có tỉ lệ mol tương ứng là 5 : 4 tan vừa đủ trong dung dịch hỗn hợp chứa HCl và KNO3. Sau phản ứng thu được 0,224 lít khí N2O (đktc) và dung dịch Y chỉ chứa muối clorua. Biết các phản ứng hoàn toàn. Cô cạn dung dịch Y thu được m gam muối. Gía trị của m là:
Đáp án: B Phương pháp giải: Phương pháp : Giải theo PT ion : 10 H+ + 2 NO3- + 8 e → N2O +5 H2O 10 H+ + NO3- + 8e→ NH4+ + 3 H2O Bảo toàn e : 2 n Mg = 8 n N2O + 8 n NH4+ Chỉ thu được muối clorua => đã hết ion NO3- Bảo toàn nguyên tố : n NO3- = n NH4+ + 2 n N2O Bảo toàn khối lượng : m muôi = m cation dương + m Cl- Lời giải chi tiết:
Hướng dẫn Giải : n N2O = 0,01 mol , n Mg : n MgO = 5 : 4 => Đặt n Mg = 5 a thì ta có n MgO = 4 a m Mg + m MgO = 5,6 => 5 a . 24 + 4a . 40 = 5,6 => a = 0,02 mol => n Mg = 0,1 mol , n MgO = 0,08 mol PT bảo toàn e : 2 n Mg> 8 n N2O => có sản phẩm khử ẩn là NH4+ nằm trong dung dịch PT bảo toàn e đúng : 2 n Mg = 8 n N2O + 8 n NH4+ => n NH4+= ( 0,1 . 2 – 0,01 . 8 ) : 8 = 0,015 mol => n NO3- = n NH4+ + 2 n N2O = 0,015 + 0,01 . 2 = 0,035 mol => n K+ = n KNO3 = 0,035 mol n Mg2+ = n n Mg+ n MgO = 0,18 mol muối gồm : MgCl2 , KCl , NH4Cl m muối = 0,18 . 95 + 0,035 . 74,5 + 0,015 . 53,5 = 20,51 g Đáp án B Câu hỏi 4 : Nung hỗn hợp rắn A gồm a mol Mg và 0,25 mol Cu(NO3)2 sau một thời gian thu được chất rắn B và 10,08 lit khí hỗn hợp D gồm NO2 và O2. Hòa tan hoàn tòa B vào dung dịch chứa 1,3 mol HCl (vừa đủ), thu được dung dịch X chỉ chứa m gam hỗn hợp muối clorua và 1,12 lit hỗn hợp khí Y gồm N2 và H2 có tỉ khối so với hidro là 11,4. Biết các thể tích đều ở dktc. Giá trị của m gần nhất với :
Đáp án: D Phương pháp giải: Phương pháp : Bảo toàn nguyên tố Lời giải chi tiết:
Lời giải : nD = 0,45 => nO(D) = 0,9 mol nY = 0,05 mol Đặt nN2 = x => nH2 = 0,05 – x => 28x + 2(0,05 – x) = 0,05.11,4.2 = 1,14 => x = 0,04 mol => nN2 = 0,04 mol và nH2 = 0,01 mol Trong Y chứa khí H2 chứng tỏ NO3- hết Hỗn hợp muối clorua gồm : a mol MgCl2 ; 0,25 mol CuCl2 ; NH4Cl Bảo toàn Clo : nNH4Cl = 1,3 – 2a – 0,5 = 0,8 – 2a Bảo toàn H : nH2 = ½ (nHCl + 4nNH4Cl – 2nH2) = 4a – 0,96 Bảo toàn O : nO (Cu(NO3)2) = nO(D) + nO(H2O) => 0,25.6 = 0,9 + 4a – 0,96 => a = 0,39 mol => m = 0,39.95 + 0,25.135 + (0,8 – 2.0,39). 53,5 = 71,87g Đáp án D Câu hỏi 5 : Hòa tan hết 11,1g hỗn hợp Fe và Cu trong 94,5g dung dịch HNO3 48% thu được dung dịch X (không chứa muối amoni). Cho X phản ứng với 300 ml dung dịch hỗn hợp NaOH 1M và KOH 0,5M, thu được kết tủa Y và dung dịch Z. Nung Y trong không khí đến khối lượng không đổi, thu được 15g hỗn hợp gồm Fe2O3 và CuO. Cô cạn Z thu được hỗn hợp chất rắn khan T. Nung T đến khối lượng không đổi thu được 32,145g chất rắn hỗn hợp. Nồng độ phần trăm của Fe(NO3)3 trong X có giá trị gần nhất với :
Đáp án: B Phương pháp giải: Bảo toàn electron, Bảo toàn điện tích, Bảo toàn nguyên tố, Bảo toàn khối lượng Lời giải chi tiết: nHNO3 = 0,72 mol ; nNaOH = 0,3 mol ; nKOH = 0,15 mol Đặt nFe = x ; nCu = y => nFe2O3 = 0,5x ; nCuO = y Ta có : 56x + 64y = 11,1g ; 80x + 80y = 15 => x = 0,1125 ; y = 0,075 Giả sử chất rắn khan sau khi nung T gồm 0,3 mol NaNO2 và 0,15 mol KNO2 mT = 0,3.69 + 0,15.85 = 33,45g > 322,145g => trong chất rắn khan sau nung T có cả bazo dư Đặt nNO2 = a ; nOH = b 0,3.23 + 0,15.39 + 46a + 17b = 32,145 a + b = 0,45 => a = 0,405 ; b = 0,045 Do nNO3 muối = 0,405 < 3nFe + 2nCu = 3.0,1125 + 2.0,075 = 0,4875 => Sản phẩm có cả Fe2+ và Fe3+ và HNO3 phản ứng hết. Trong dung dịch X có : z mol Fe2+ ; t mol Fe3+ ; 0,075 mol Cu2+ ; 0,405 mol NO3- Bảo toàn Fe : z + t = 0,1125 Bảo toàn điện tích : 2z + 3t + 2.0,075 = 0,405 => z = 0,0825 và t = 0,03 Bảo toàn H : nH2O = ½ nHNO3 = 0,36 mol Bảo toàn khối lượng : msp khử = mHNO3 – mNO3 muối – mNO3 (X) – mH2O = 13,77g mdd X = mKL + mdd HNO3 – msp khử = 91,83g => C% Fe(NO3)3 = 7,91% Đáp án B Câu hỏi 6 : Hòa tan hết 23,76 gam hỗn hợp X gồm FeCl2; Cu và Fe(NO3)2 vào 400 ml dung dịch HCl 1M thu được dung dịch Y. Cho từ từ dung dịch chứa AgNO3 1M vào Y đến các phản ứng hoàn thấy đã dùng 580ml, kết thúc thu được m gam kết tủa và thoát ra 0,448 lít khí (ở đktc). Biết NO là sản phẩm khử duy nhất của N+5 trong cả quá trình, giá trị của m gần nhất với
Đáp án: A Phương pháp giải: Lời giải chi tiết: Ta có sơ đồ : 23,76g X + 0,4 mol HCl -> NO + dd Y → 0,02 mol NO + Kết tủa + dd Z Trong Z có Fe(NO3)3 , Cu(NO3)2 nH+ = 0,4 mol => nNO = ¼ nH+ = 0,1 mol Trong TN1 : nNO = 0,1 – 0,02 = 0,08 mol => Trong X có 0,04 mol Fe(NO3)2 => Trong Z nNO3 = 0,58 – 0,02 = 0,56 mol Gọi số mol FeCl2 và Cu trong X lần lượt là a và b => 127a + 64b = 16,56g (1) nNO3 (Z) = (a + 0,04).3 + 2b = 0,56(2) Từ (1,2) => a = 0,08 ; b = 0,1 mol Kết tủa thu được gồm : nAgCl = nCl- = 0,4 + 2.0,08 = 0,56 mol nAg = 0,08 + 0,1.2 + 0,04 – 0,1.3 = 0,02 mol => mkết tủa = 82,52g Đáp án A Câu hỏi 7 : Nung hỗn họp X gồm NaNO3 và Cu(NO3)2 ở nhiệt độ cao đến phản ứng hoàn toàn thu được chất rắn và hỗn hợp khí Y. Tỷ khối của hỗn hợp khí Y so với H2 là 19,5. Tính % khối lượng của NaNO3 trong hỗn hợp X:
Đáp án: D Phương pháp giải: Lời giải chi tiết: MY = 39 Y gồm NO2 và O2 Áp dụng qui tắc đường chéo => nNO2 = nO2 NaNO3 → NaNO2 + ½ O2 x → 0,5x Cu(NO3)2 → CuO + 2NO2 + ½ O2 y → 2y → 0,5y ta có 2y = 0,5x + 0,5y => 1,5 = 0,5x => x = 3y => %NaNO3 = 57,6% Đáp án D Câu hỏi 8 : Hòa tan hoàn toàn hỗn hợp gồm 0,03 mol Cu và 0,09 mol Mg vào dung dịch chứa 0,07 mol KNO3 và 0,16 mol H2SO4 loãng thì thu được dung dịch chỉ chứa các muối sunfat trung hòa và 1,12 lít (đktc) hỗn hợp khí X gồm các oxit của nitơ có tỉ khối so với H2 là x. Giá trị của x là
Đáp án: D Phương pháp giải: Lời giải chi tiết:
Câu hỏi 9 : Nhiệt phân hoàn toàn hỗn hợp gồm m1 gam Fe(NO3)2 và m2 gam Al(NO3)3 thu được hỗn hợp khí X. Trộn hỗn hợp khí X với 112ml khí O2(đktc) được hỗn hợp khí Y. Hấp thụ hoàn toàn hỗn hợp khí Y vào 3,5 lít H2O (không thấy có khí thoát ra) được dung dịch có pH=1,7. Giá trị của m1, m2 lần lượt là
Đáp án: C Phương pháp giải: Phương pháp: 2Fe(NO3)2 -> Fe2O3 + 4NO2 + 1/2 O2 2a 4a 0,5 a 2Al (NO3)3 -> Al2O3 + 6NO2 + 3/2 O2 2b 6b 1,5b 4NO2 +O2 +2H2O -> 4 HNO3 4nO2 = [H+] = 10-1,7 => nAxit = nH+= 3,5.10-1,7= 0,07 mol= Thay a=>b => m1,m2 Lời giải chi tiết:
Hướng dẫn giải: 2Fe(NO3)2 -> Fe2O3 + 4NO2 + 1/2 O2 2a 4a 0,5 a 2Al (NO3)3 -> Al2O3 + 6NO2 + 3/2 O2 2b 6b 1,5b 4NO2 +O2 +2H2O -> 4 HNO3 4nO2 = => 4.(0,5a+1,5b+0,005)=4a+6b => a=0,01 [H+] = 10-1,7 => nAxit = nH+= 3,5.10-1,7= 0,07 mol= =4a+6b Thay a= 0,01 => b=0,005 => m1= 2.0,01.180=3,6 gam m2 = 2.0,005.213=2,13 gam => chọn C Đáp án C Câu hỏi 10 : Hoà tan hoàn toàn 12,42 gam Al bằng dung dịch HNO3 loãng (dư), thu được dung dịch X và 1,344 lít (ở đktc) hỗn hợp khí Y gồm hai khí là N2O và N2. Tỉ khối của hỗn hợp khí Y so với khí H2 là 18. Cô cạn dung dịch X, thu được m gam chất rắn khan. Giá trị của m là:
Đáp án: C Phương pháp giải: Phương pháp: nAl = 0,46 mol → ne cho =0,46.3= 1,38 mol nY = 0,06 mol ; Áp dụng phương pháp đường chéo =>
→ dung dịch X còn chứa muối NH4NO3 => => mX = Lời giải chi tiết:
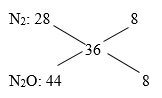
Hướng dẫn giải nAl = 0,46 mol → ne cho =0,46.3= 1,38 mol nY = 0,06 mol ; N2O 44 8 36 N2 28 8 =>
→ dung dịch X còn chứa muối NH4NO3 ne nhận =n e cho = 1,38 => => mX = Đáp án C. Câu hỏi 11 : Nung hỗn hợp X gồm a mol Mg và 0,25 mol Cu(NO3)2 sau một thời gian thu được chất rắn Y và 0,45 mol hỗn hợp khí Z gồm NO2 và O2. Cho Y phản ứng vừa đủ với dung dịch chứa 1,3 mol HCl thu đưuọc dung dịch chỉ chứa m gam hôn hợp muối clorua và 0,05 mol hỗn hợp khí T ( gồm N2 và H2 có tỉ khối so với H2 là 11,4) Giá trị của m gần nhất với giá trị nào sau đây là
Đáp án: A Phương pháp giải: + Bảo toàn nguyên tố, bảo toàn điện tích, bảo toàn khối lượng Lời giải chi tiết: \(\begin{gathered}
Bảo toàn điện tích đối với hỗn hợp muối clorua ta có: 2a+ 0,25.2 + 0,02.1 = 1,3 =>a = 0,39 => m = 0,39. 24 +0,25.64 + 0,02.18 + 1,3.35,5 = 71,87 (g) ≈ 72(gam) Đáp án A Câu hỏi 12 : Hòa tan hoàn toàn 3,60g Mg trong 500 ml dung dịch HNO3 0,80 M, phản ứng kết thúc thu được 448 ml một khí X (ở dktc) và dung dịch Y có khối lượng lớn hơn khối lượng dung dịch HNO3 ban đầu là 3,04g. Để phản ứng hết với các chất trong Y cần vừa đủ V ml dung dịch NaOH 2,00 M. Giá trị của V là :
Đáp án: D Phương pháp giải: Phương pháp : - Bảo toàn e - Bảo toàn nguyên tố Lời giải chi tiết:
Hướng dẫn giải : nMg = 0,15 mol ; nHNO3 = 0,4 mol ; nX = 0,02 mol mX = 3,6 – 3,04 = 0,56g => MX = 28g (N2) Bảo toàn e : nNH4NO3 = 1/8 (0,15.2 – 0,02.10) = 0,0125 mol Bảo toàn Nito : nHNO3(Y) = 0,4 – (2nMg + 2nN2 + 2nNH4NO3) = 0,035 mol nNaOH = nHNO3 (Y) + 2nMg + nNH4NO3 = 0,3475 mol => Vdd NaOH = 173,75 ml Đáp án D Câu hỏi 13 : Hoà tan 11,6 gam hỗn hợp A gồm Fe và Cu vào 87,5 gam dung dịch HNO3 50,4%, sau khi kim loại tan hết thu được dung dịch X và V lít (đktc) hỗn hợp khí B ( gồm hai chất khí có tỉ lệ số mol 3:2). Cho 500 ml dung dịch KOH 1M vào dung dịch X thu được kết tủa Y và dung dịch Z. Lọc lấy Y rồi nung trong không khí đến khối lượng không đổi thu được 16,0 gam chất rắn. Cô cạn dung dịch Z được chất rắn T. Nung T đến khối lượng khống đổi thu được 41,05 gam chất rắn. Biết các phản ứng xảy ra hoàn toàn. Nồng độ % của Fe(NO3)3 trong X là:
Đáp án: B Phương pháp giải: Bảo toàn nguyên tố, bảo toàn electron, bảo toàn khối lượng Lời giải chi tiết: Trong T có KNO3
\(KN{O_3}{\text{ }}\xrightarrow{{{t^o}}}{\text{ }}KN{O_2}{\text{ }} + {\text{ }}0,5{O_2}\) Nếu trong T không có KOH, vậy khối lượng chất rắn thu được sau khi nhiệt phân T là khối lượng của KNO2. mKNO2 = 0,5. 85 = 42,5 > 41,05 => T gồm KOH dư và KNO2
\(\begin{gathered} Đáp án B Câu hỏi 14 : Nung m gam hỗn hợp gồm Mg và Cu(NO3) trong điều kiện thích hợp không có không khí, sau một thời gian thu được chất rắn X và 10,08 lít (đktc) hỗn hợp khí gồm NO2 và O2. Hòa tan hoàn toàn X bằng 650ml dung dịch HCl 2M, thu được dung dịch Y chỉ chứa 71,87 gam muối clorua vào 0,05 mol hỗn hợp khí Z gồm N2 và H2. Tí khối của Z với He bằng 5,7. Giá trị của m gần giá trị nào nhất sau đây?
Đáp án: A Phương pháp giải: + Bảo toàn nguyên tố O, H, Cl Lời giải chi tiết:
\(m\,gam\left\{ \begin{gathered} Đặt nMg = a và nCu(NO3)2 = b (mol) ∑n (NO2 +O2) = 0,45 BTNT O => nO ( trong X) = 6b – 0,45. 2 = 6b – 0,9 (mol) => nH2O = 6b – 0,9 Dùng quy tắc đường chéo tính được nN2 = 0,04 ; nH2 = 0,01 (mol) Bảo toàn nguyên tố H: nHCl = 4nNH4Cl + 2nH2 + 2nH2O => nNH4Cl = (3,08 – 12b)/4 Bảo toàn nguyên tố Cl: nHCl = 2a + 2b + ( 3,08 – 12b)/4 = 1,3 (1) mmuối = 95a + 135b + 53,5 ( 3,08 -12b)/4 = 71,87 (2) Từ (1) và (2) => a = 0,39 và b = 0,25 => m = 0,39.24 + 0,25. 188 = 56,36 (g) => gần nhất với giá trị 55 gam Đáp án B Câu hỏi 15 : Cho 8,64 gam Mg vào dung dịch hỗn hợp NaNO3 và H2SO4, đun nhẹ hỗn hợp phản ứng, lúc đầu tạo ra sản phẩm khử là khí NO, sau đó thấy thoát ra khí không màu X. Sau khi các phản ứng kết thúc thấy còn lại 4,08 gam chất rắn không tan. Biết rằng tổng thể tích của hai khí NO và X là 1,792 lít (đktc) và tổng khối lượng là 1,84 gam. Cô cạn cẩn thận dung dịch sau phản ứng tu được m gam chất muối khan. Giá trị nào sau đây gần với m nhất?
Đáp án: A Phương pháp giải: - Khí X là H2. Gọi nNO = a (mol); nH2 = b (mol) ∑ nX = a + b = 0,08 (1) ∑ mX = 30a + 2b = 1,84 (2) Từ (1) và (2) => a = ?; b = ? - Bảo toàn electron thấy: ∑ ne (nhận) = 3nNO + 2nH2 < ne (Mg nhường) => tạo muối NH4+ - Bảo toàn electron => => nNH4+ = (2nMg pư - 3nNO - 2nH2)/8 - Bảo toàn nguyên tố N => nNO3- => nNa+ => nNa2SO4 => mmuối = mMgSO4 + m(NH4)2SO4 + mNa2SO4 Lời giải chi tiết: mMg pư = 8,64 – 4,08 = 4,56 (g) => nMg pư = 0,19 (mol) => ne (Mg nhường) = 0,38 (mol) nX = 0,08 (mol) => MX = 1,84: 0,08 = 23(g/mol) => khí X là H2 Gọi nNO = a (mol); nH2 = b (mol) ∑ nX = a + b = 0,08 (1) ∑ mX = 30a + 2b = 1,84 (2) Từ (1) và (2) => a = 0,06 ; b = 0,02 => ∑ ne (nhận) = 3nNO + 2nH2 = 0,06.3 + 0,02.2 = 0,22 < ne (Mg nhường) = 0,38 => tạo muối NH4+ Bảo toàn electron => 2nMg pư = 3nNO + 2nH2 + 8nNH4+ => nNH4+ = (2nMg pư - 3nNO - 2nH2)/8 = 0,02 (mol) BTNT N => nNO3- = nNO + nNH4+ = 0,06 + 0,02 = 0,08 (mol) => nNa+ = 0,08 (mol) => mmuối = mMgSO4 + m(NH4)2SO4 + mNa2SO4 = 0,19. 120 + 132. 0,01 + 0,04. 142 = 29,8 (g) ≈ 29,6 (g) Đáp án A Câu hỏi 16 : Hòa tan hoàn toàn 1,28 g Cu vào 12,6 gam dd HNO3 60% thu được dung dịch X. Cho X tác dụng hoàn toàn với 105ml dung dịch KOH 1M, sau đó lọc bỏ kết tủa thu được dung dịch Y. Cô cạn Y được chất rắn Z. Nung Z đến khối lượng không đổi, thu được 8,78 gam chất rắn. Nồng độ phần trăm của Cu(NO3)2 trong X là:
Đáp án: A Phương pháp giải: \(\begin{gathered} ∑nKOH = a + b = 0,105 (1) ∑ mrắn = 85a + 56b = 8,78 (2) Từ (1) và ( 2) => a = ? ; b =? Bảo toàn electron => kết luận được N+5 bị khử thành NO và NO2 => tìm số mol mỗi khí => mdd X = mCu + mdd HNO3 – m khí => C% Cu(NO3)2 = ? Lời giải chi tiết: \(\begin{gathered} ∑nKOH = a + b = 0,105 (1) ∑ mrắn = 85a + 56b = 8,78 (2) Từ (1) và (2) => a = 0,1 (mol) ; b = 0,005 (mol) nKNO3 tạo ra từ Cu(NO3)2 = 0,04 (mol) => nKNO3 tạo ra từ HNO3 dư = 0,1 – 0,04 = 0,06 (mo) => nHNO3 dư = 0,12- 0,06 = 0,06 (mol) => nHNO3 bị khử = 0,06 – 0,02.2 = 0,02 (mol) Với ne( Cu nhường) = 2.nCu = 0,04 (mol) => Trung bình mỗi N+5 nhận 0,04/0,02 = 2e => Tạo NO2 (1e) và NO ( 3e) => nNO = nNO2 = 0,02/ 2= 0,01(mol) Vậy mdd X = mCu + mdd HNO3 – m khí = 1,28 + 12,6 – 0,01.30 – 0,01.46 = 13,12 (g) => C% Cu(NO3)2 = [( 0,02.188) : 13,12].100% = 28,66% Đáp án A Câu hỏi 17 : Hỗn hợp X gồm Cu2O, FeO, M (kim loại M có hóa trị không đổi), trong X số mol của O gấp 2 lần số mol M. Hòa tan 38,55 gam X trong dung dịch HNO3 loãng dư thấy có 1,5 mol HNO3 phản ứng, sau phản ứng thu được 118,35 gam hỗn hợp muối và 2,24 lít NO (đktc). Phần trăm khối lượng của M trong X là
Đáp án: D Phương pháp giải: + BTKL: mH2O = mX + mHNO3 – m muối – mNO => nH2O + BTNT H: nHNO3 = 4nNH4+ + 2nH2O => nNH4+ + BTNT N: nNO3- muối = nHNO3 – nNH4+ - nNO + mKL = m muối – mNH4+ - mNO3- => mO => nO => nM Giả sử X gồm: 2x mol Cu; y mol Fe; 0,3 mol O; 0,15 mol M Lập 2 pt dựa vào khối lượng lim loại và BT e tìm mối liên hệ giữa M và n. Biện luận tìm M => %mM Lời giải chi tiết: BTKL: mH2O = mX + mHNO3 – m muối – mNO = 38,55 + 1,5.63 – 118,35 – 0,1.30 = 11,7 gam => nH2O = 0,65 mol BTNT H: nHNO3 = 4nNH4+ + 2nH2O => nNH4+= (1,5-2.0,65)/4 = 0,05 mol BTNT N: nNO3- muối = nHNO3 – nNH4+ - nNO = 1,5-0,05-0,1 = 1,35 mol mKL = m muối – mNH4+ - mNO3- = 118,35 – 0,05.18 – 1,35.62 = 33,75 gam => mO = 38,55-33,75 = 4,8 gam (0,3 mol) => nM = 0,15 mol Giả sử X gồm: 2x mol Cu; y mol Fe; 0,3 mol O; 0,15 mol M mKL=64.2x+56y+0,15M=33,75 (1) BT e: 2.2x+3y+0,15n = 0,3.2+0,1.3+0,05.8 (2) (1) và (2) => M = 72n - 79 Với n = 2 thì M = 65 (Zn) %mZn = 0,15.65/38,55 = 25,29% Đáp án D Câu hỏi 18 : Hòa tan hoàn toàn 5,22 gam hỗn hợp bột M gồm Mg, MgO, Mg(OH)2, MgCO3, Mg(NO3)2 bằng một lượng vừa đủ 0,26 mol HNO3. Sau khi phản ứng kết thúc thu được dung dịch X và 0,448 lít hỗn hợp khí gồm N2O và CO2. Dung dịch X phản ứng vừa đủ với 250 ml dung dịch NaOH 1M, sau phản ứng thu được 6,96 gam kết tủa màu trắng. Phần trăm theo khối lượng của Mg(OH)2 trong hỗn hợp đầu gần nhất là
Đáp án: C Phương pháp giải: Lời giải chi tiết: Trong dung dịch X chứa Mg(MO3)2 và NH4NO3 nMg(NO3)2 = nMg(OH)2 = 0,12 nNaOH = 2nMg(NO3)2 + nNH4NO3 => nNH4NO3 = 0,01 m khí = 0,02.44 = 0,88 BTKL: 5,22 + mHNO3 = mMg(NO3)2 + mNH4NO3 + m khí + mH2O => nH2O = 0,12 BTNT H: 2nMg(OH)2 + nHNO3 = 4nNH4NO3 + 2nH2O => nMg(OH)2 = 0,01 => %Mg(OH)2 = 0,01.58/5,22 = 11,11% Đáp án C Câu hỏi 19 : Hỗn hợp X gồm FeO, Fe3O4 và Cu (trong đó số mol FeO bằng 1/4 số mol hỗn hợp X). Hòa tan hoàn toàn 27,36 gam X trong dung dịch chứa NaNO3 và HCl, thu được 0,896 lít khí NO (sản phẩm khử duy nhất của NO3- ở đktc) và dung dịch Y chỉ chứa muối clorua có khối lượng 58,16 gam. Cho Y tác dụng với AgNO3 dư thu được m gam kết tủa. Giá trị của m là :
Đáp án: D Phương pháp giải: BTNT, BTKL. Lời giải chi tiết: \(\begin{gathered} Đáp án D Câu hỏi 20 : Hòa tan hoàn toàn 7,98 gam hỗn hợp X chứa Mg, Al và MgCO3 trong dung dịch chứa NaNO3 và 0,62 mol NaHSO4. Sau phản ứng thu được dung dịch Y chỉ chứa 3,808 lít hỗn hợp khí Z gồm H2, NO, CO2 với tỷ lệ mol tương ứng là 9:4:4. Cô cạn Y được hỗn hợp muối trung hòa khan Z. Phần trăm khối lượng muối natri trong Z gần nhất với giá trị
Đáp án: A Phương pháp giải: \(7,98gX\left\{ \begin{gathered} BTNT C, H, O, N => x, y = ? Bảo toàn khối lượng ta có: mY = m(Mg2+, Al3+) + mNa+ + mNH4+ + mSO42- Lời giải chi tiết: \(7,98gX\left\{ \begin{gathered} BTNT C: => nMgCO3 = nCO2 = 0,04 (mol) BTNT: N => x = y + 0,04 (1) BTNT : H => nH2O = ( 0,62 – 4y – 0,09.2)/2 = 0,22- 2y BTNT: O => 3n MgCO3 + 3nNaNO3 = nH2O + nNO + 2nCO2 => 3. 0,04 + 3x = (0,22- 2y) + 0,04 + 2.0,04 => 3x + 2y = 0,22 (2) Từ (1) và (2) => x = 0,06 và y = 0,02 (mol) Bảo toàn khối lượng ta có: mY = m(Mg2+, Al3+) + mNa+ + mNH4+ + mSO42- = (7,98 – 0,04.60) + ( 0,06 + 0,62).23 + 0,02.18 + 0,62.96 = 81,1(g) %mNa2SO4 = [(0,34.142):81,1].100% = 59,53% ≈ 59,5 % Đáp án A
|














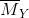 = 36
= 36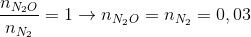
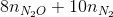 = 8.0,03+10.0,03 = 0,54 mol < ne cho
= 8.0,03+10.0,03 = 0,54 mol < ne cho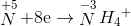
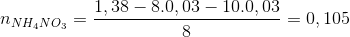
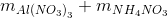 = 0,46.213 + 0,105.80 = 106,38 gam
= 0,46.213 + 0,105.80 = 106,38 gam



