Nội dung từ Loigiaihay.Com
Cho nhiệt tạo thành chuẩn của các chất tương ứng trong phương trình

Biến thiên enthalpy của phản ứng N2O4(g) + 3CO(g) \( \to \) N2O(g) + 3CO2(g) có giá trị là:
-
A.
-209,66 kJ
-
B.
-776,11 kJ
-
C.
776,11 kJ
-
D.
210,11 kJ
Biến thiên enthalpy của phản ứng: \({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o(c{\rm{d}}) - {\Delta _f}H_{298}^o(sp)\)
\(\begin{array}{l}{\Delta _r}H_{298}^o = {\Delta _f}H_{298}^o({N_2}{\rm{O) + 3}}{\Delta _{\rm{f}}}{\rm{H}}_{298}^o(C{O_2}) - 3{\Delta _f}H_{298}^o(CO) - {\Delta _f}H_{298}^o({N_2}{{\rm{O}}_4})\\ = 82,05 + 3.( - 393,5) - 3.( - 110,5) - 9,16 = - 776,11kJ\end{array}\)
Đáp án B
Đáp án : B

Các bài tập cùng chuyên đề
Số oxi hóa của các nguyên tử trong đơn chất bằng
Phản ứng nào sau đây là phản ứng oxi hóa – khử?
Quá trình Ostawald để sản xuất nitric acid từ ammonia được đề xuất vào năm 1902. Ở giai đoạn đầu của quá trình, ammonia bị oxi hóa với oxygen ở nhiệt độ cao khi có chất xúc tác:
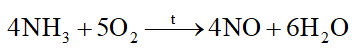
Chất bị oxi hóa trong quá trình trên là
Dấu hiệu để nhận biết một phản ứng oxi hóa khử là
Cho phương trình nhiệt hóa học sau: S(s) + O2(g) \( \to \) SO2(g) \({\Delta _r}H_{298}^o = - 296.80kJ\)
Enthalpy tạo thành chuẩn của SO2(g) là
Phản ứng thu nhiệt có
Cho 2 phương trình nhiệt hóa học sau:
C(s) + H2O(g) \( \to \) CO(g) + H2(g) \({\Delta _r}H_{298}^o = 121,25kJ\) (1)
CuSO4(aq) + Zn(s) \( \to \) ZnSO4(aq) + Cu(s) \({\Delta _r}H_{298}^o = - 230,04kJ\)(2)
Chọn phát biểu đúng:
Cho phương trình nhiệt hóa học của phản ứng
2H2(g) + O2(g) \( \to \) 2H2O(l) \({\Delta _r}H_{298}^o = - 571,68kJ\)
Phản ứng trên là phản ứng
Trong các phản ứng sau, phản ứng không phải là phản ứng oxi hóa – khử?
Số oxi hóa của sulfur (S) trong các phân tử H2SO3, S, SO3, H2S lần lượt là
Cho phương trình hóa học của các phản ứng sau:
(a) 2KMnO4 \( \to \) K2MnO4 + MnO2 + O2
(b) Cl2 + 2KOH \( \to \) KCl + KClO + H2O
(c) NH4Cl + NaOH \( \to \) NH3 + NaCl + H2O
(d) CaCO3 \( \to \) CaO + CO2
(e) HCl + NaHCO3 \( \to \) NaCl + CO2 + H2O
(g) 2SO2 + O2 \( \to \) 2SO3
Số phản ứng có kèm theo sự thay đổi số oxi hóa của các nguyên tử là
Những ngày nóng nực, pha viên vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn là do
Enthalpy tạo thành chuẩn của một đơn chất bền là
Cho các phản ứng sau xảy ra ở điều kiện chuẩn
CH4(g) + 2O2 \( \to \) CO2(g) + 2H2O (l) \({\Delta _r}H_{298}^o = - 890,36kJ\)
CaCO3(g) \( \to \) CaO(s) + CO2(g) \({\Delta _r}H_{298}^o = 178,29kJ\)
Ở điều kiện chuẩn, cần phải đốt cháy hoàn toàn m gam CH4(g) để cung cấp nhiệt tạo cho phản ứng tạo 3 mol CaO bằng cách nung CaCO3. Giả thiết hiệu suất các quá trình đều là 100%. Giá trị gần nhất của m là
Dựa vào phươgn trình nhiệt hóa học của phản ứng sau:
H2(g) + F2(g) \( \to \) 2HF(g) \({\Delta _r}H_{298}^o = - 546,00kJ\)
Giá trị \({\Delta _r}H_{298}^o\)của phản ứng \(\frac{1}{2}{H_2}(g) + \frac{1}{2}{F_2}(g) \to HF(g)\)là
Bình “gas” sử dụng trong hộ gia đình A có chứa 10,76 kg khí hóa lỏng (LPG) gồm propane và butane với tỉ lệ mol tương ứng là 3:7 (thành phần khác không đáng kể). Khi được đốt cháy hoàn toàn, 1 mol propane tỏa ra lượng nhiệt là 2220 kJ và 1 mol butane tỏa ra lượng nhiệt là 2850 kJ. Hỏi trung bình lượng nhiệt tiêu thụ từ đốt 1 bình khí “gas” trên của hộ gia đình A tương ứng với bao nhiêu số điện? (Biết hiệu suất sử dụng nhiệt là 67% và 1 số điện = 1 kWh = 3600 kJ).
Theo nghiên cứu của Đại học Harvard vào năm 2013, trẻ em sinh sống tại những khu vực có nguồn nước bị nhiễm Fluorine có chỉ số IQ trung bình sẽ thấp hơn so với những trẻ em sống tại vùng khác. Anion F- (fluoride) có độc tính mạnh với hệ thần kinh. Với lượng tương đối thấp: 0,2 gam ion Ftrên cơ thể có trọng lượng 70 kg có thể gây tử vong. Tuy nhiên, sự có mặt của anion fluoride lại giúp men răng chắc khỏe và chống chọi các bệnh về sâu răng, vì vậy anion fluoride được thêm vào nước uống đóng chai với nồng độ 1mg ion Ftrên 1L nước và bổ sung một lượng nhỏ dưới dạng muối sodium fluoride (NaF) trong kem đánh răng. 1. Một bạn học sinh nặng khoảng 63kg sử dụng loại nước chứa ion Fvới lượng 1mg/1L để giúp men răng chắc khỏe, chống sâu răng. Sau khi đọc thông tin về độc tính của ion F- , bạn học sinh rất lo lắng. Hãy tính xem với thể tích nước mà bạn học sinh này uống một ngày là bao nhiêu lít thì ion Fcó trong nước đạt đến mức có thể gây độc tính?
Theo hiệp hội nha khoa Hoa Kỳ, một người trưởng thành nên bổ sung 3,0 mg F- mỗi ngày dưới dạng muối sodium fluoride (NaF) để ngăn ngừa sâu răng. Lượng NaF không gây độc cho cơ thể khi ở mức 3,19.10-2 gam/ 1 kg cơ thể. Một mẫu kem đánh răng chứa 0,28% NaF, hãy tính khối lượng mẫu kem đánh răng mà một người nặng 65 kg có thể nuốt nhưng không gây độc tính với cơ thể?












