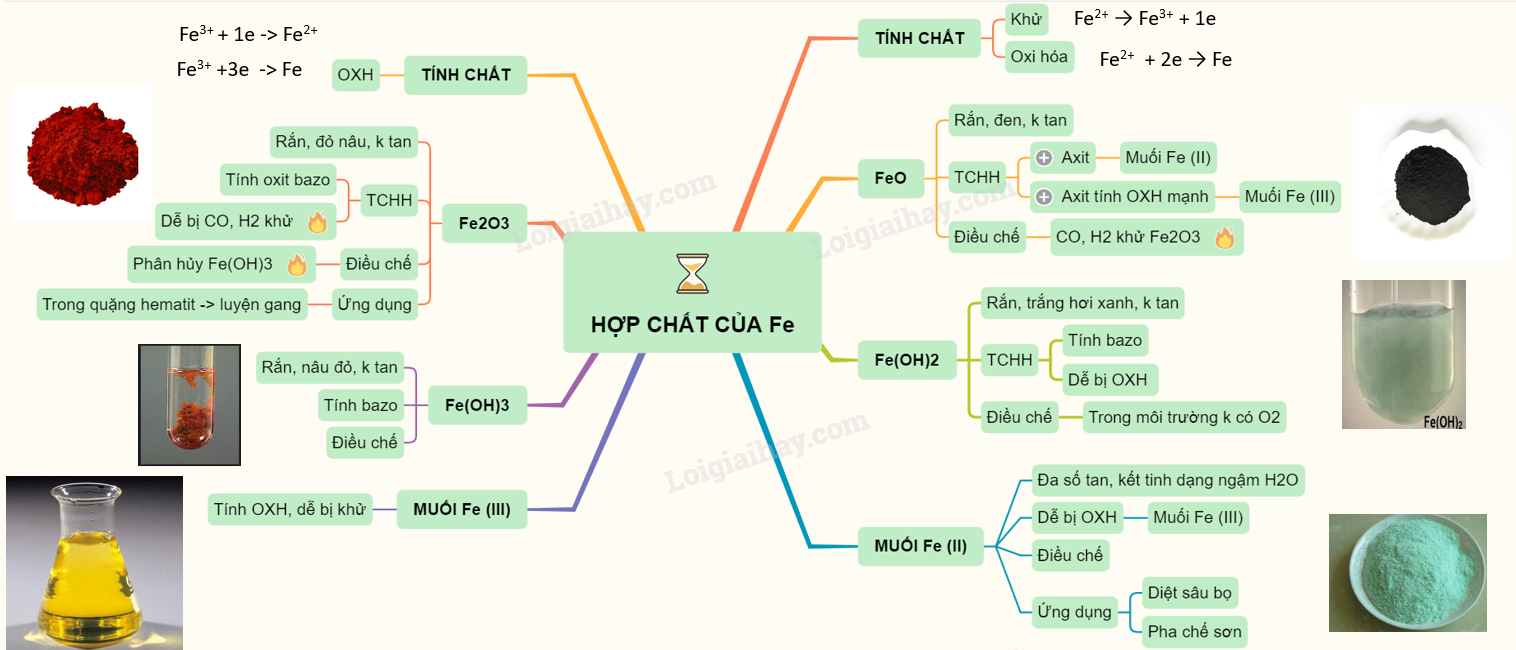
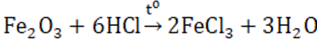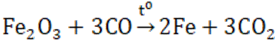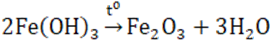Lý thuyết về hợp chất của sắtHợp chất sắt (II) I. SẮT (II) Có tính khử: Fe2+ \( \to\) Fe3+ + 1e và tính oxi hóa : Fe2+ + 2e \( \to\) Fe 1. Oxit FeO - Chất rắn màu đen, không có trong tự nhiên, không tan trong nước - Tác dụng được với axit sinh ra muối sắt (II) còn khi tác dụng với axit có tính oxi hóa mạnh thì thu được muối sắt (III) 3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O - Điều chế bằng cách dùng CO hay H2 khử sắt (III) oxit ở 500oC Fe2O3 + CO \(\xrightarrow{{{t^o}}}\) 2FeO + CO2 2. Hidroxit Fe(OH)2 - Là chất rắn, màu trắng hơi xanh, không tan trong nước. - Dễ bị oxi hóa thành sắt (III) hiđroxit màu nâu đỏ trong không khí 4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 - Có tính bazơ (tác dụng với axit (HCl, H2SO4 loãng) tạo nên muối sắt (II)) - Điều chế: trong môi trường không có oxi để thu được sản phẩm tinh khiết 3. Muối sắt (II) - Đa số tan trong nước, khi kết tinh ở dạng ngậm nước. - Dễ bị oxi hóa thành muối sắt (III) 2FeCl2 + Cl2 → 2FeCl3 - Chú ý: dung dịch muối sắt (II) điều chế được cần dùng ngay, vì trong không khí muối sắt (II) sẽ chuyển dần thành muối sắt (III). - Điều chế: cho Fe (hoặc FeO, Fe(OH)2) tác dụng với HCl hoặc H2SO4 loãng: Fe + 2HCl → FeCl2 + H2 FeO + H2SO4 → FeSO4 + H2 - Ứng dụng: muối FeSO4 được dùng làm chất diệt sâu bọ, pha chế sơn, mực nhuộm vải. II. SẮT (III) Có tính oxi hóa : tác dụng với một số kim loại, một số hợp chất có tính khử. Fe3+ + 1e -> Fe2+ hoặc Fe3+ +3e -> Fe 1. Oxit Fe2O3 - Là chất rắn màu đỏ nâu, không tan trong nước - Dễ tan trong cả dung dịch axit mạnh
- Ở nhiệt độ cao, Fe2O3 bị CO khử hoặc H2 khử thành Fe.
- Điều chế: qua phản ứng phân hủy sắt (III) hiđroxit ở nhiệt độ cao.
- Sắt (III) oxit tồn tại trong tự nhiên dưới dạng quặng hemantit dùng để luyện gang 2. Hidroxit Fe(OH)3 - Là chất rắn màu nâu đỏ, không tan trong nước nhưng dễ tan trong các dung dịch axit tạo muối sắt (III) 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O - Điều chế: cho dung dịch kiềm tác dụng với muối sắt (III). FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl 3. Muối sắt (III) - Các muối sắt (III) có tính oxi hóa, dễ bị khử thành muối sắt (II). Fe + 2FeCl3 → 3FeCl2 - Bột đồng tan trong dung dịch muối sắt (III). Cu + 2FeCl3 (vàng nâu) → CuCl2 + FeCl2 ⇒ Dung dịch CuCl2 (màu xanh) và dung dịch FeCl2 (không màu) nên dung dịch thu được có màu xanh. Sơ đồ tư duy: Hợp chất của sắt
HocTot.Nam.Name.Vn
|