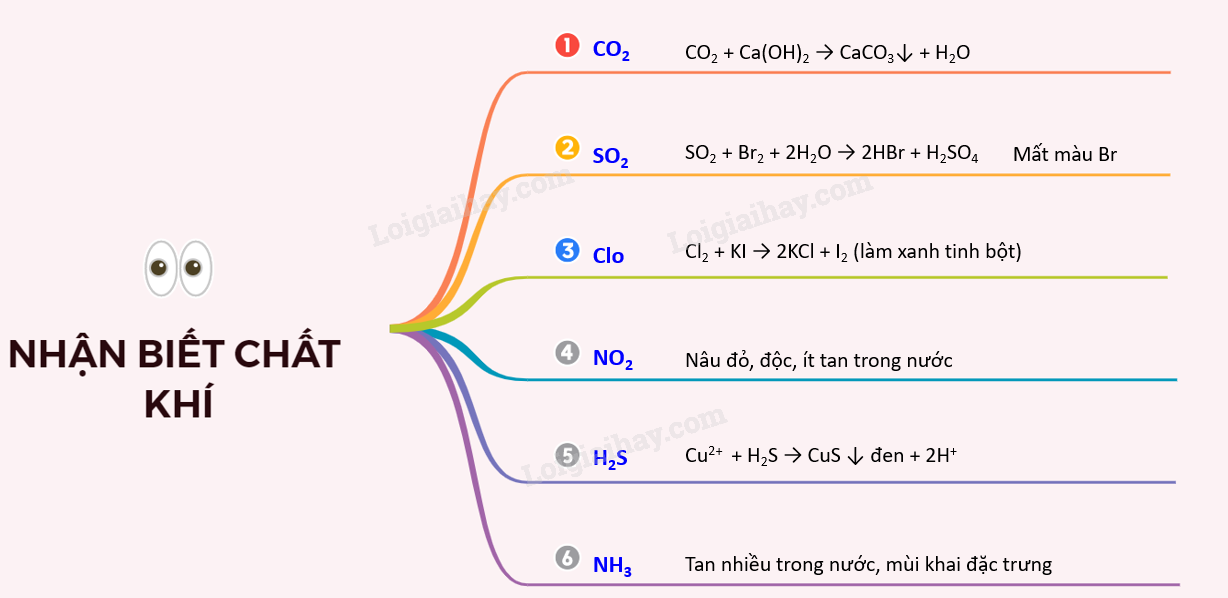
Lý thuyết nhận biết một số chất khíKiến thức trọng tâm I. NGUYÊN TẮC CHUNGCó thể dựa vào tính chất vật lý hoăc tính chất hóa học đặc trưng của nó như màu, mùi, khả năng tạo kết tủa với các chất khác. II. NHẬN BIẾT 1 SỐ CHẤT KHÍ1. Nhận biết khí CO2 - Không màu, không mùi nặng hơn không khí, ít tan trong nước, làm đục nước vôi trong - Khi thêm Ca(OH)2 dư/ Ba(OH)2 dư tạo kết tủa trắng CO2 + Ca(OH)2 → CaCO3 + H2O 2. Nhận biết khí SO2 - Không màu, nặng hơn không khí, có mùi hắc, gây ngạt và độc, làm đục nước vôi trong giống CO2 - Làm nhạt màu dung dịch nước brom hoặc dung dịch iot. SO2 + Br2 + 2H2O → 2HBr + H2SO4 SO2 + I2 + 2H2O → 2HI + H2SO4 3. Nhận biết khí Clo - Màu vàng lục, mùi hắc, độc, ít tan trong nước - Nhận biết bằng giấy tẩm KI và hồ tinh bột. Do phản ứng tạo ra I2 gặp hồ tinh bột tạo màu xanh tím. Cl2 + KI → 2KCl + I2 (làm xanh tinh bột) 4. Nhận biết khí NO2 - Màu nâu đỏ, độc, ít tan trong nước. Có thể nhận biết qua màu nâu đỏ khi nồng độ NO2 đủ lớn. 4NO2 + O2 + 2H2O → 4HNO3 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O 5. Nhận biết khí H2S - Không màu, mùi trứng thối, độc. - Tạo muối sunfua kết tủa có màu với nhiều dung dịch muối Cu2+ + H2S → CuS + 2H+ Pb2+ + H2S → PbS + 2H+ 6. Nhận biết khí NH3 - Không màu, tan nhiều trong nước, mùi khai đặc trưng. - Làm xanh quỳ tím ẩm Sơ đồ tư duy: Nhận biết một số chất khí
|