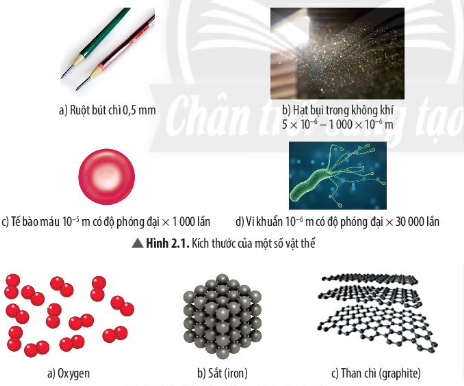
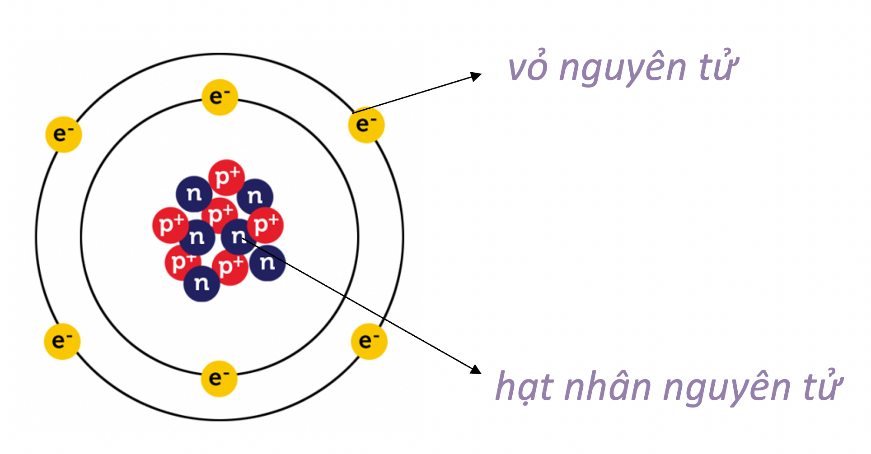
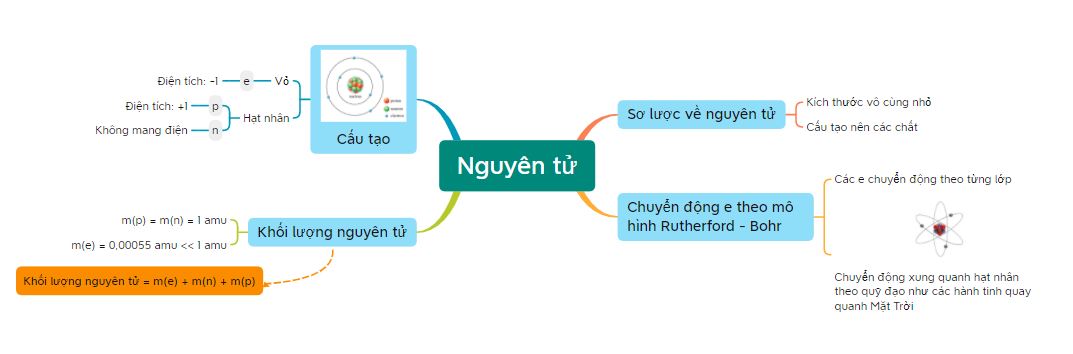
Lý thuyết bài 2: Nguyên tử - KHTN 7 Chân trời sáng tạoNguyên tử được cấu tạo từ ba loại hạt cơ bản: proton, neutron, electron Tổng hợp đề thi học kì 1 lớp 7 tất cả các môn - Chân trời sáng tạo Toán - Văn - Anh - Khoa học tự nhiên... Lý thuyết: Nguyên tử 1. Mô hình nguyên tử Rutherford – Bohr Tìm hiểu sơ lược về nguyên tử - Các chất đều được tạo nên từ những hạt vô cùng nhỏ, gọi là nguyên tử - Nguyên tử có kích thước vô cùng nhỏ, tạo nên các chất Ví dụ 1: Nếu xếp các nguyên tử iron liền nhau thành một hàng dài thì với độ dài 1 nm thôi cũng đã có từ vài triệu đến vài chục triệu nguyên tử Khái quát về mô hình nguyên tử - Nguyên tử có cấu tạo rỗng. - Cấu tạo nguyên tử: + hạt nhân ở tâm mang điện tích dương; + electron ở lớp vỏ mang điện tích âm; + electron chuyển động xung quanh hạt nhân như các hành tinh quay quanh Mặt Trời.
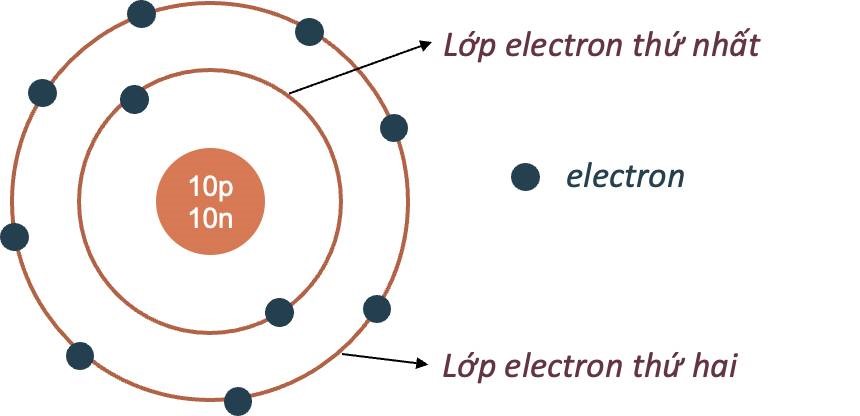
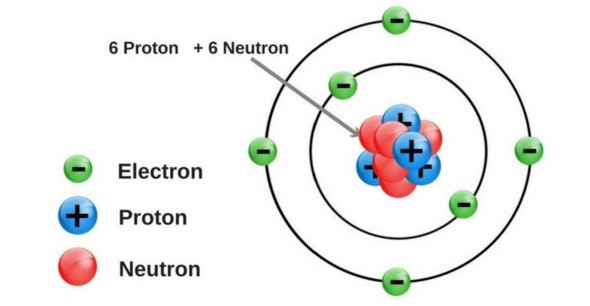
Mô hình hành tinh nguyên tử của Rutherford - Bohr - Các electron chuyển động xung quanh hạt nhân theo từng lớp khác nhau: + Lớp trong cùng có 2 electron, bị hạt nhân hút mạnh nhất. + Các lớp khác chứa tối đa 8 electron hoặc nhiều hơn, bị hạt nhân hút yếu hơn. Mô hình nguyên tử Neon Hạt nhân nguyên tử - Hạt nhân nằm ở tâm, có kích thước rất nhỏ so với kích thước nguyên tử. - Hạt nhân nguyên tử được tạo bởi các proton và neutron. - Proton: + Kí hiệu: p. + Mang điện tích dương. + Giá trị bằng một điện tích nguyên tố (1,602.10-19 culong), viết gọn là +1. - Neutron: + Kí hiệu: n. + Không mang điện tích. - Số đơn vị điện tích hạt nhân (kí hiệu là Z), bằng tổng số hạt proton có trong hạt nhân. Mô hình nguyên tử carbon Ví dụ 2: Hạt nhân nguyên tử carbon có 6 proton và 6 neutron. Vỏ nguyên tử - Vỏ nguyên tử được tạo nên bởi các electron. - Electron: + Kí hiệu: e. + Mang điện tích âm. + Giá trị điện tích bằng một điện tích nguyên tố (1,602.10-19 culong), viết gọn là -1. - Các electron được sắp xếp thành từng lớp, lần lượt theo thứ tự từ trong ra ngoài. - Mỗi lớp có số electron tối đa xác định: + Lớp thứ nhất có 2 electron. + Lớp thứ hai có 8 electron. Ví dụ 3: Vỏ nguyên tử carbon có 6 electron được sắp xếp thành hai lớp, lớp trong cùng có 2 electron, lớp tiếp theo có 4 electron.
2. Khối lượng nguyên tử - Khối lượng proton ≃ Khối lượng neutron ≃ 1 amu. - Khối lượng electron ≃ 0,00055 amu ≪ 1 amu. 1 amu = 1,6605.10-24 gam - Khối lượng nguyên tử = khối lượng proton + khối lượng neutron + khối lượng electron ≃ khối lượng proton + khối lượng neutron = khối lượng hạt nhân
Sơ đồ tư duy |