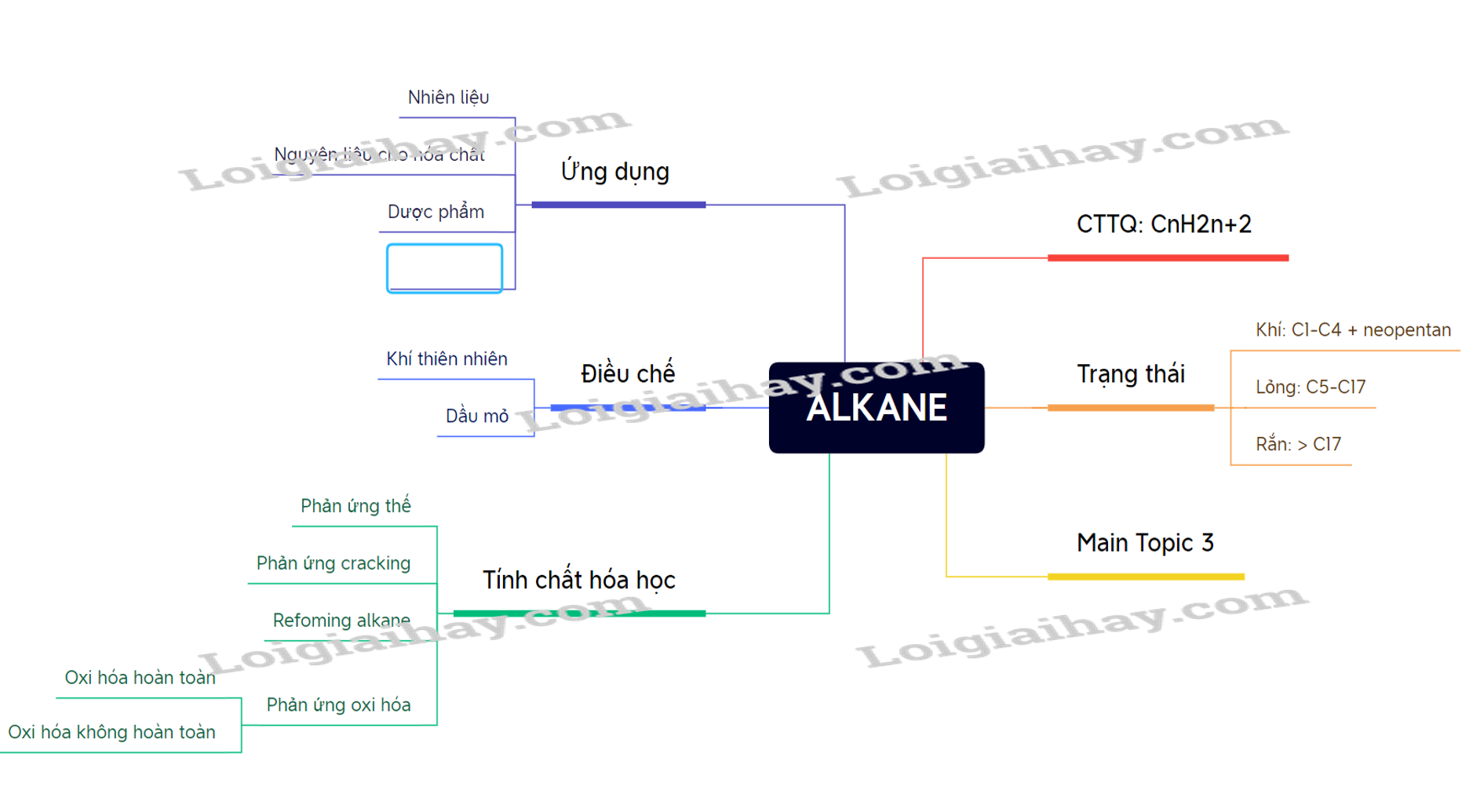
Lý thuyết Alkane - Hóa học 11 - Kết nối tri thức- Khái niệm: Alkane là các hydrocarbon no mạch hở chỉ chứa liên kết đơn C-H và C-C trong phân tử. I. Khái niệm, danh pháp 1. Khái niệm và công thức chung của alkane - Khái niệm: Alkane là các hydrocarbon no mạch hở chỉ chứa liên kết đơn C-H và C-C trong phân tử. - CTPT chung: CnH2n+2 (n ≥ 1) 2. Danh pháp a, Alkane không phân nhánh Danh pháp thay thế = Phần nền + ane. VD: CH4: mathane b, Alkane mạch nhánh Tên gốc alkyl = Phần nền + yl Tên danh pháp thay thế của alkane = Số chỉ vị trí machj nhánh + tên alkane mạch chính - Lưu ý: + Chọn mạch C dài nhất, có nhiều nhánh nhất làm mạch chính. + Đánh số sao cho mạch nhánh có số chỉ vị trí nhỏ nhất. II. Đặc điểm cấu tạo - Chỉ có liên kết đơn C-C và C-H (bền vững và kém phân cực) nên alkane khá trơ về mặt hóa học. III. Tính chất vật lí - Trạng thái: C1 đến C4 và neopentan: khí, C5-C17: lỏng; C18 trở lên: rắn. - Không tan trong nước, tan tốt hơn trong các dung môi hữu cơ. - Nhẹ hơn nước. - Nhiệt độ nóng chảy, nhiệt độ sôi tăng theo chiều tăng phân tử khối. IV. Tính chất hóa học 1. Phản ứng thế - Alkane phản ứng thế nguyên tử hydrogen trong alkane bằng nguyên tử halogen. CnH2n+2 + X2 → CnH2n+2-mXm + HX VD: CH4 + Cl2 →CH3Cl + HCl. 2. Phản ứng cracking - Cracking alkane là quá trình phân cắt liên kết C-C của các alkane mạch dài tạo thành hỗn hợp hydrocarbon có mạch carbon ngắn hơn. VD:
3. Phản ứng reforming - Reforming alkane là quá trình chuyển các alkane không phân nhánh thành các alkane mạch phân nhánh và mạch vòng nhưng không làm thay đổi số nguyên tử carbon trong phân tử. 4. Phản ứng oxi hóa a, Phản ứng oxi hóa hoàn toàn (phản ứng cháy) CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1) H2O Có: + nH2O < nCO2. + nH2O – nCO2 = nCnH2n+2. b, Phản ứng oxi hóa không hoàn toàn - Alkane bị oxi hóa thành hỗn hợp carboxylic acid. RCH2-CH2R’ + O2 → RCOOH + R’COOH + H2O V. Ứng dụng - Nhiên liệu trong sản xuất và đời sống. - Nguyên liệu sản xuât phân bón. - Nhiên liệu xăng, diesel… VI. Ô nhiễm không khí do phương tiện giao thông 1. Các chất trong khí thải của phương tiện giao thông gây ô nhiễm không khí - Quá trình cháy xăng, dầu trong động cơ tạo ra khí CO2 (gây hiệu ứng nhà kính). - Xăng, dầu cháy không hoàn toàn tạo ra hợp chất arene đa vòng rất độc. - Nhiên liệu chứa sulfur cháy tạo ra oxide của sulfur SOx. - Ở nhiệt độ cao oxygen với nitrogen phản ứng với nhau tạo NOx → Các chất này gây ô nhiễm môi trường. 2. Một số biện pháp hạn chế ô nhiễm môi trường do phương tiện giao thông - Sử dụng nhiên liệu sạch. - Sử dụng nhiên liệu sinh học như xăng phan ethanol (E5, E10..), biodiesel. - Sử dụng các phương tiện giao thông tiết kiệm năng lượng và chuyển đổi các loại động cơ điện. SƠ ĐỒ TƯ DUY
|