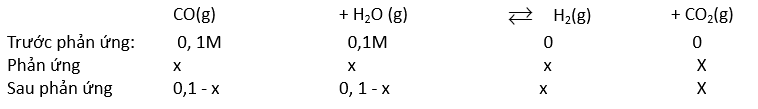Bài 3. Ôn tập chương 1 trang 27, 28 Hóa học 11 Kết nối tri thứcHằng số KC của một phản ứng phụ thuộc vào yếu tố nào sau đây? A. Nồng độ. B. Nhiệt độ. C. Áp suất. D. Chất xúc tác. Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 28 Video hướng dẫn giải
Phương pháp: Câu 1. Hằng số K C của một phản ứng phụ thuộc duy nhất vào bản chất của phản ứng và nhiệt độ. Câu 2. Pha loãng dung dịch 100 lần thì nồng độ giảm 100 lần ⇒ pH tăng 2 đơn vị. Câu 3. a) NaOH → Na + + b) HCl → H + + c) Ca(OH) 2 → Ca 2+ + 2 Áp dụng công thức: (H + ).()= pH = -log(H + ) Câu 4. Áp dụng công thức: {{\rm{K}__{\rm{C}}} = \frac{{{\left( {\rm{C}} \right)}^{ \rm{c}}}{{\left( {\rm{D}} \right)}^{\rm{d}}}}}{{{\left( {\rm{A}} \right )}^{\rm{a}}}{{\left( {\rm{B}} \right)}^{\rm{b}}}}} Câu 5. Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ và chất phản ứng. Câu 6. Để cân bằng chuyển dịch theo chiều cần thiết: - Tăng nồng độ CO. - Giảm nhiệt độ. - Áp dụng không gây ảnh hưởng đến cân bằng. Câu 7. (CO)=110=0,1M; \(\left( {{{\rm{H}___2}{\rm{O}}} \right) = \frac{1}{{10}} = 0,{\rm{1 M}}\ ) CO( g ) + H 2 O( g ) ⇌ CO 2 ( g ) + H 2 ( g ) Ban đầu: 0,1 0,1 0 0 M Phản ứng: x x x x M Cân bằng: (0,1 – x) (0,1 – x) x x M Thay đổi công thức số: {{\rm{K}__{\rm{C}}} = \frac{{\left( {{\rm{C}}{{\rm{O}__{\rm{2} }}} \right)\left( {{{\rm{H}__{\rm{2}}}} \right)}}{{\left( {{\rm{CO}}} \right) \left( {{{\rm{H}__{\rm{2}}}{\rm{O}}} \right)}} Lời giải chi tiết: Câu 1. Câu trả lời đúng: B. Hằng số K C của một phản ứng phụ thuộc duy nhất vào bản chất của phản ứng và nhiệt độ. Câu 2. Câu trả lời đúng: D. Pha dịch dịch 100 lần thì nồng độ giảm 100 lần ⇒ pH tăng 2 đơn vị. Câu 3. a) NaOH → Na + + 0,1M → 0,1M Ta có: (H + ).()= ⇔(H+)=10−14(OH−)=10−140,1=10−13M → pH = -log(H + ) = 13. b) HCl → H + + 0,1M→ 0,1M Ta có: pH = -log(H + ) = 1 M. c) Ca(OH) 2 → Ca 2+ + 2 0,01 → 0,02 M Ta có: (H + ).(OH) - = 10 -14 ⇔(H+)=10−14(OH−)=10−140,02=5×10−13M → pH = -log(H + ) = 12,3 Câu 4. a) 2SO 2 ( g ) + O 2 ( g ) ⇌ 2SO 3 ( g ) KC=[SO3]2[SO2]2[O2] b) 2C( s ) + O 2 ( g ) ⇌ 2CO( g ) {{\rm{K}__{\rm{C}}} = \frac{{{{\left( {{\rm{CO}}} \right)}^2}}}{{\ trái( {{{\rm{O}__{\rm{2}}}} \right)}} c) AgCl( s ) ⇌ Ag + (aq) + (aq) K C = (Ag + ).(Cl - ) Câu 5. Câu trả lời đúng là: C Hằng số cân bằng chỉ phụ thuộc vào nhiệt độ và chất phản ứng, không phụ thuộc vào nồng độ. Câu 6. Để cân bằng chuyển dịch theo chiều cần thiết: - Tăng nồng độ CO, cân bằng sẽ chuyển dịch theo chiều làm giảm nồng độ CO, tức chiều thuận lợi, chiều tăng hiệu suất phản ứng. - ∆ r H o < 0 ⇒ Chiều thuận lợi cho nhiệt độ ⇒ Giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều làm tăng nhiệt độ chiều thuận lợi, chiều tăng hiệu suất phản ứng. - Phản đối thuận lợi về tổng số lượng các chất khí ở hai vế bằng nhau, việc thay đổi hiệu suất không gây ảnh hưởng đến cân bằng. Câu 7. Ta có: [CO] =110=0,1M; [H2O] = 110=0,1M
KC=[H2][CO2][CO][H2O]=x.x(0,1−x).(0,1−x)=8,3x=0,074M[CO]=[H2O]=0,1−0,074=0,026M[H2]=[CO2]=0,074M
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM; 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|