Bài 4. Nitrogen trang 29, 30, 31, 32 Hóa học 11 Kết nối tri thứcTrong công nghiệp, đơn chất nitrogen kết hợp với hydrogen tạo thành ammonia là một hợp chất quan trọng trong sản xuất phân bón, hoá chất. Tại sao phản ứng trên cần thực hiện ở nhiệt độ cao? Đơn chất nitrogen đóng vai trò gì trong phản ứng đó? Tổng hợp đề thi học kì 2 lớp 11 tất cả các môn - Kết nối tri thức Toán - Văn - Anh - Lí - Hóa - Sinh
Lựa chọn câu để xem lời giải nhanh hơn
CH tr 29 Video hướng dẫn giải
Phương pháp: - Phản ứng trên cần thực hiện ở nhiệt độ cao do liên kết ba giữa 2 nguyên tử N trong phân tử nitrogen có năng lượng liên kết lớn. - Nitrogen đóng vai trò chất oxi hóa. Lời giải chi tiết: - Phản ứng giữa nitrogen và hydrogen cần được thực hiện ở nhiệt độ cao do liên kết ba giữa 2 nguyên tử N trong phân tử nitrogen có năng lượng liên kết rất lớn (945 kJ/ mol) nên khó bị phá vỡ. - Phương trình hoá học: ⇌ Số oxi hoá của nitrogen giảm từ 0 xuống -3 nên trong phản ứng này đơn chất nitrogen đóng vai trò là chất oxi hoá.
Phương pháp: Lời giải chi tiết: - Ứng dụng thực tiễn của khí nitrogen (N2): Người ta thường dùng khí nitrogen để thay thế hoàn toàn hoặc một phần không khí trong rất nhiều trường hợp khác nhau để giảm nguy cơ cháy, nổ, giảm quá trình oxi hoá do oxygen trong không khí gây nên. Trong lĩnh vực hoá học, khi cần nghiên cứu sự biến đổi chất ở môi trường trơ thì cần đẩy không khí ra và thay vào đó là nitrogen hoặc các khí trơ khác. - Ứng dụng thực tiễn của diêm tiêu Chile (NaNO3, sodium nitrate): Sản xuất phân bón; sản xuất thuốc nổ; sản xuất dược phẩm; sản xuất kính; bảo quản thịt … CH tr 30 Video hướng dẫn giải
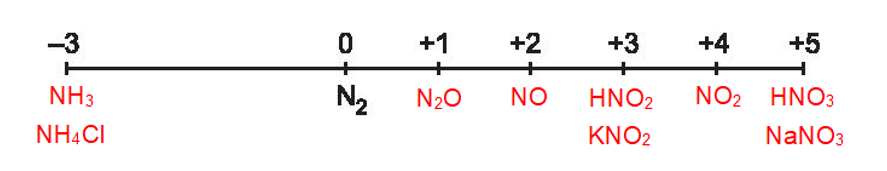
Phương pháp: 1. 2. Số oxi hóa của nitrogen có thể tăng, có thể giảm nên nitrogen có cả tính oxi hóa cả tính khử. Lời giải chi tiết: 1. 2. Khi tham gia phản ứng oxi hoá – khử, số oxi hoá của nitrogen có thể giảm hoặc tăng, do đó nitrogen thể hiện tính oxi hoá hoặc tính khử. Một số quá trình minh hoạ: Quá trình oxi hoá: Quá trình khử:
Phương pháp: 1. Tương tác van der Waals phụ thuộc vào hai yếu tố chính là số lượng eletron và điểm tiếp xúc giữa các phân tử suy ra giữa các phân tử nitrogen tồn tại tương tác van der Waals nhưng rất yếu. Do đó đơn chất N2 khó hoá lỏng và ít tan trong nước. Lời giải chi tiết: 1. Tương tác van der Waals tăng theo sự tăng của số electron trong phân tử. Làm tăng nhiệt độ nóng chảy, nhiệt độ sôi của các chất. Ngoài ra tương tác van der Waals còn phụ thuộc vào điểm tiếp xúc giữa các phân tử nên giữa các phân tử nitrogen tồn tại tương tác van der Waals nhưng rất yếu. Vậy nên đơn chất N2 khó hoá lỏng và ít tan trong nước. CH tr 31 Video hướng dẫn giải
Phương pháp: 2. N2(g) + 3H2(g) ⇌ 2NH3(g) Nguyên tử thay đổi số oxi hóa là nitrogen: 0 → -3; hydrogen 0 → +1. Vai trò của nitrogen là chất oxi hóa. 3. a) N2(g) + O2(g) ⇌ 2NO(g). nitrogen: 0 → +2 và oxi: 0 → -2. b) Do hiệu suất phản ứng rất thấp. Lời giải chi tiết : 2. Phương trình hoá học: N2(g) + 3H2(g) ⇌ 2NH3(g) Số oxi hoá của nitrogen giảm từ 0 xuống -3 nên trong phản ứng này đơn chất nitrogen đóng vai trò là chất oxi hoá. Số oxi hóa của hydrogen tăng từ 0 lên +1. 3. a) Phản ứng: N2(g) + O2(g) ⇌ 2NO(g). Nguyên tử có sự thay đổi số oxi hóa là nitrogen: 0 → +2 và oxi: 0 → -2. b) Phản ứng này xảy ra ở nhiệt độ cao trên 30000C hoặc có tia lửa điện, nhưng hiệu suất tạo ra NO rất thấp, do đó thực tế không sử dụng phản ứng này để tạo ra NO. 4. N2(g) + O2(g) ⇌ 2NO(g)
CH tr 32 Video hướng dẫn giải
Phương pháp: Ứng dụng của nitrogen: bảo quản thực phẩm, bảo quản mẫu vật sinh học, sản xuất phân bón,… Lời giải chi tiết: Một số hình ảnh về ứng dụng của nitrogen trong thực tiễn: Tham khảo thuyết trình về ứng dụng của nitrogen trong thực tiễn: Mỗi năm có hàng trăm triệu tấn nitrogen được sản xuất trên toàn cầu; trong đó, lượng nitrogen dạng khí chiếm khoảng hai phần ba, còn lại là nitrogen lỏng. Vì tính chất kém hoạt động hoá học (tính trơ), nitrogen không oxi hoá các chất khác ở nhiệt độ thường. Dựa vào tính chất này, người ta thường dùng khí nitrogen để thay thế hoàn toàn hoặc một phần không khí trong rất nhiều trường hợp khác nhau để giảm nguy cơ cháy nổ, giảm quá trình oxi hoá do oxygen trong không khí gây nên. Chẳng hạn, khi rút xăng, dầu ra khỏi các bồn chứa hoặc khi đóng gói thực phẩm, người ta bơm khí nitrogen vào để làm giảm nồng độ của oxygen. Trong lĩnh vực hoá học, khi cần nghiên cứu sự biến đổi chất ở môi trường trơ thì cần đẩy không khí ra và thay vào là nitrogen hoặc các khí trơ khác. Nitrogen hoá lỏng ở nhiệt độ thấp, -196 oC. Vì vậy, nitrogen lỏng được sử dụng để làm lạnh nhanh, bảo quản thực phẩm ngay tại nhà máy và trong quá trình vận chuyển. Nitrogen lỏng còn được sử dụng để đóng băng và kiểm soát dòng chảy trong các đường ống. Trong lĩnh vực sinh học và y học, các mẫu vật sinh học (máu, mô, tế bào, bộ phận cơ thể,...) được bảo quản trong bình nitrogen lỏng. Bình này thường có hai khoang, khoang chứa nitrogen lỏng cùng ống chứa mẫu vật cần bảo quản và khoang chân không để cách nhiệt với bên ngoài.
Phương pháp: a) Nitrogen hóa hỏng ở nhiệt độ rất thấp (-1960C). b) Nitrogen là chất kém hoạt động hóa học (tính trơ). Lời giải chi tiết: a) Nitrogen lỏng được dùng để bảo quản mẫu vật phẩm trong y học vì nitrogen hóa hỏng ở nhiệt độ rất thấp (-1960C). b) Vì tính chất kém hoạt động hoá học (tính trơ) nên nitrogen không oxi hoá các chất khác ở nhiệt độ thường. Do đó, khí nitrogen được dùng để làm căng vỏ bao bì thực phẩm mà không phải là không khí.
>> 2K8 Chú ý! Lộ Trình Sun 2026 - 3IN1 - 1 lộ trình ôn 3 kì thi (Luyện thi 26+TN THPT, 90+ ĐGNL HN, 900+ ĐGNL HCM; 70+ ĐGTD - Click xem ngay) tại Tuyensinh247.com.Đầy đủ theo 3 đầu sách, Thầy Cô giáo giỏi, 3 bước chi tiết: Nền tảng lớp 12; Luyện thi chuyên sâu; Luyện đề đủ dạng đáp ứng mọi kì thi.
|